서 언
환경부에서 지정한 생태계교란식물(生態系攪亂植物, ecosystem disturbance plant)은 2021년 10월 현재 16종(KLIC, 2021)으로 가시 또는 가시를 연상시키는 단어가 들어간 식물체로는 가시박, 가시상추, 도깨비가지 3종이 있다. 가시박은 덩굴성인 반면에 가시상추와 도깨비가지는 직립형이다. 가시박은 줄기와 잎에 연한 털이 빽빽하게 나 있고, 별사탕 모양의 열매에는 여러 개가 뭉쳐서 털 같은 흰 가시(1 cm 내외)로 덮여 있다. 가시상추는 줄기와 잎맥을 따라 작은 가시(1 mm 내외)가 줄지어 배열되어 있고, 도깨비가지는 가지와 잎자루, 잎 뒷면 주맥 위에 송곳 모양의 튼튼한 노란색의 가시(1 cm 내외)가 있다(Kim and Park, 2009).
식물체에 있는 가시는 자신을 보호하기 위해 또는 주변 환경으로부터 적응하기 위해 만들어졌다. 대표적인 것이 선인장과 가시연꽃이다. 이들 식물체의 가시는 무엇이 변해서 가시가 되었는지에 따라 크게 세 종류로 구분된다. 첫 번째는 피침(皮針, prickle)은 나무껍질이 변해 가시가 된 것으로 장미, 산딸기, 해당화 등이 해당된다. 두 번째는 엽침(葉針, spine)으로 잎이나 턱잎이 변해 가시가 된 것으로 선인장, 아카시나무, 초피나무 등이다. 세 번째는 경침(莖針, thorn)으로 나무의 가지나 줄기가 변해 가시가 된 것으로 탱자나무, 유자나무, 석류나무 등이 있다. 또 Inagaki (2015)는 식물의 가시는 동물이 갉아먹어 해치는 일을 막는 대표적인 방어 수단이라고 하였다. 따라서 가시가 있는 생태계교란식물 3종은 가시로 인해 자연생태계로 확산하는데 기여했다고 할 수 있다. 여기에 추가적으로 생리·생태적 특성이 결부된다면 독자적으로 생존할 수 있는 확산속도는 더 빨라졌을 것이다.
생태계교란식물에는 가시박, 가시상추, 도깨비가지와 같이 식물체에 가시 이름이 포함된 것이 3종이 있다. 그 중 생태계교란식물의 대명사인 가시박에 대한 관리방안은 Lee et al. (2021)에 의해 보고된 바가 있다. 가시가 있는 생태계교란식물의 두번째로 도깨비가지에 대한 발생과 생리·생태적 특성, 환경에 미치는 영향, 그리고 다양한 관리방법을 정리하였다. 특히 도깨비가지가 목초지에서 과수원, 도로변, 제방 등으로 확산되고 있어 이와 관련된 연구보고가 시급하였다.
도깨비가지의 형태와 분포
도깨비가지 줄기는 곧게 자라며, 높이는 40-70 cm, 많은 가지를 친다. 또 가지, 잎자루, 잎의 주맥(主脈, vein)과 간혹 측맥(側脈, lateral vein)까지 송곳모양의 튼튼한 노란색 가시(1 cm 내외)가 있다. 잎은 어긋나기(互生, growing in alternation)이고 잎 모양은 장타원형 또는 계란형이며, 길이 7-14 cm이다(Kim and Park, 2009). 꽃은 5-9월에 피며, 꽃자루는 줄기에 측생(側生)하며 3-10개의 꽃이 달려서 총상화서(叢狀花序, raceme)를 만든다. 꽃은 지름 약 2.5 cm, 백색 또는 엷은 자색으로 가지 꽃과 비슷하다. 열매는 구형(球形)이고 지름 1.5 cm, 익으면 주황색이 된다. 또 열매를 짓이기면 은행나무 열매에서 나는 악취가 발생한다.
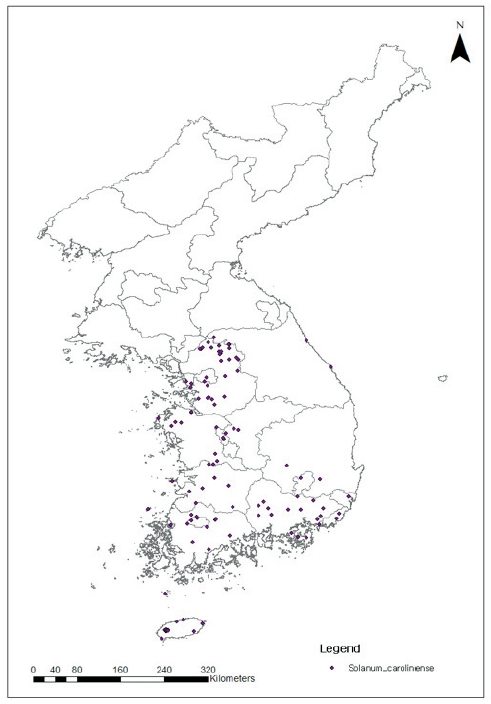
도깨비가지는 북미의 걸프 연안(Gulf Coast)이 원산지이며, 지금은 캐나다를 포함한 거의 모든 북미대륙에서 발생한다(Bassett and Munro, 1986; Lorenzi and Jeffery, 1987; USDA-NRCS, 1999). 그리고 남미에는 브라질, 아시아에는 우리나라, 일본, 중국, 인도 등, 유럽에는 독일, 이탈리아, 노르웨이 등에, 남반구에는 호주와 뉴질랜드에서 발생하고 있다(Fig. 1; CABI, 2021). 우리나라에서는 1964년에 처음으로 발생된 후 1978년부터 여러 논문이나 보고서에 언급(KEITI, 2021; Kim et al., 2001; Oh et al., 1999)되었다. 농촌진흥청을 중심으로 농경지에 발생하는 잡초를 전국단위로 조사하는 과정에서 우리나라 전역에 도깨비가지가 목초지, 과수원 등에 발생하고 있음을 확인하였다(Lee et al., 2016). 특히 우리나라 최북단 백령도, 최서단 흑산도, 최남단 거문도, 그리고 제주도 부속도서인 추자도에서도 발생이 확인되었다(Fig. 2; Kim et al., 2010). 또한 보호구역인 충남 태안의 천연기념물 431호 신두리 해안사구에도 발생하여 확산방지를 위한 물리적 방제연구가 일부 기관에서 진행되고 있다(KEITI, 2021). 현재 도깨비가지의 국내 분포지점으로 Maxent를 이용(Lim et al., 2020)하여 확산예측을 한 결과, 제주도와 강원도 북쪽을 중심으로 확산되었다. 또 30년 후 기후변화 시나리오(RCP 4.5)를 이용하여 도깨비가지의 확산을 예측한 결과, 기온과 강수량이 상승할수록 서해안을 중심으로 확산되었다(KEITI, 2021).
우리나라에서 도깨비가지는 사료용 옥수수 재배지와 과수원 및 논둑에 일부 발생하고, 도로변 등에도 발생하며 점차 확산되고 있어 문제이다. 특히 농경지나 그 주변에 발생하는 도깨비가지를 무심코 맨손으로 만져 피부발진이나 부스럼 등이 유발되어 피해를 주고 있다.
한편, 도깨비가지와 유사한 왕도깨비가지는 2000년 10월 제주특별자치도 서귀포시 안덕면 동하목장의 일부 초지에서 처음 발생이 확인된 외래잡초이다(Yang et al., 2007). 왕도깨비가지는 잎과 줄기에 3 cm 내외의 강하고 날카로운 가시가 부착된 지상부가 1.5 m까지 자라며, 가지가 분지(分校)되어 수관(樹冠, crown)이 1 m에 달한다. 왕도깨비가지의 꽃은 2-3 cm 백색으로 5개 꽃잎으로 이루어져 있으며 뒤로 젖혀진다. 과실은 구형(球形)으로 흰 줄이 있는 녹색에서 성숙 시 노란색으로 변한다. 왕도깨비가지는 소 흑은 다른 동물의 섭식에 의하거나 씨앗이 포함된 건초, 잔디 그리고 기계들에 의해 급속히 확산된다(Yang et al., 2007).
도깨비가지의 생리·생태적 특성
도깨비가지는 종자, 뿌리 및 뿌리에서 떨어진 절편(切片)에 의해 전파되는 다년생잡초이다. 종자 생산량은 열매 한 개당 종자수가 80.2립이며, 천립중은 1.54 g이다. 토양 중에서 종자 수명은 112년에 이르는 경우도 있다(Kim and Park, 2009). Oh et al. (1999)와 Nishida et al. (2000)에 의하면, 도깨비가지 종자의 발아온도 범위는 25-35℃이고 발아 최적온도는 33-35℃로 비교적 고온조건에서 발아하였다. 이런 발아온도 때문에 도깨비가지의 분포의 잠재적 영역은 위도 50o N까지라고 하였다(AgroAtlas, 2021). 광조건은 도깨비가지 종자발아에는 큰 영향을 미치지 않는다(Buhler and Hoffman, 1999; Ilnicki et al., 1962). 도깨비가지의 지하경은 깊고 길게 뻗는데, 깊이로는 2 m, 옆으로는 6 m에 이르며, 재생력도 강하다. 이 지하경의 단편(斷片, section)은 토심 30 cm 깊이에 심어도 신초(新梢, shoots)를 형성한다. 이때 지하경의 줄기 조각이 2-5 mm로 작아도 58%의 새로운 개체형성율을 보였다(Smith and Calvert, 1980). 또 도깨비가지 뿌리는 땅속에 매몰된 5일부터 출현하는데 매몰심도가 깊을수록(15 cm까지) 그 기간은 지연되었으나 일정기간이 경과되면 100% 출현된다. 또 이 절단된 뿌리가 출현에 소요되는 예측일수는 30℃의 경우 약11일, 노지(4월 13일 재식)에서는 약 31일이 걸린다고 하였다(Moon et al., 2002). 도깨비가지의 싹은 10 cm 깊이에 묻혀도 출현할 수 있으며(Ilnicki et al., 1962), 종자는 8-12 cm 깊이에 묻혀도 적어도 3년 동안 생존력은 유지한다(Brown and Porter, 1942). 도깨비가지에서는 타감물질이 분비되어 다른 식물(양상추, 순무, 옥수수, 콩, 톨페스큐)의 생육을 억제하는 것으로 알려졌다(Kim et al., 2021; Takahashi et al., 1995; Wiepke and Glenn, 1982).
한편, 왕도깨비가지 종자는 15-35℃의 범위에서 발아가 가능하였으나, 40℃이상에서는 발아되지 않으며, 발아할 때 광조건에 거의 영향을 받지 않는다(Oh et al., 2012). 또 왕도깨비가지 종자의 파종심도별 출현율은 0-2 cm 에서는 95%이상으로 종자의 성숙정도에 따라 변화가 없었으나, 4-8 cm 에서는 파종심도가 깊어질수록 출현율이 점차 감소하여 12 cm 이하에서는 출현하지 않았다(Oh et al., 2012).
도깨비가지의 생태적 위협
도깨비가지는 번식력이 강하고 날카로운 가시가 달려있어 가축이 먹지 않으며, 사람이 농작업을 하다가 가지에 찔리거나 긁혀도 피부발진 등이 발생하여 피해를 주고 있다. 또 농경지에 침입하면 군생(群生, gregariousness)을 한다. 도깨비가지는 종자와 지하경으로 번식을 하고, 번식력이 강해 쉽게 완전 방제가 어려운 데다가 군생하면서 인축에 피해를 주고 확산하여 생태계를 위협하고 있다.
도깨비가지 열매를 먹은 가축(소, 말, 돼지, 양)의 소화관을 통과하여도 종자의 생존력을 유지할 수 있어(Muenscher, 1955; Nishida et al., 1998), 축분(畜糞, livestock manure)에 포함된 씨앗은 나중에 넓은 영역으로 흩어진다(Ilinicki et al., 1962). 또 도깨비가지는 경운을 통해 뿌리가 절단되어 다른 곳으로 전파를 촉진시키는 방법이 될 수도 있다(AgroAtlas, 2021).
도깨비가지는 미국, 캐나다 및 일본에서 목초지(Nichols et al., 1991; Nishida et al., 1999a)뿐만 아니라, 옥수수밭(Prostoko et al., 1994), 땅콩밭(Hackett et al., 1987), 채소밭(Bassett and Munro, 1986), 과수원(Frank and King, 1979; Weatherspoon and Wooten, 1981)에서 골치 아픈 문제잡초이다. 도깨비가지에는 솔라닌(solanine)과 글리코 알칼로이드(glycoalkaloid) 그리고 질산염을 함유하고 있어 가축(말과 양)이 섭취할 때 유독하다(KEITI, 2021; Kim and Park, 2009).
도깨비가지에 의한 경제적 피해
도깨비가지의 확산 및 우점으로 농작물과의 경합이 발생하면 농작물의 수확량 손실을 초래한다. 땅콩 수확 시 도깨비가지의 열매가 포함되면 특유의 악취가 발생하여 땅콩의 상품화 등급 또는 품질에 영향을 미친다(Woodruff, 1966). Frank (1990)는 도깨비가지가 3년 및 1년동안 심어졌던 밭에 Snapbeans (Phaseolus vulgaris)를 재배하면 수확량은 각각 48-65% 및 18-20% 감소했다고 보고하였다.
도깨비가지의 관리 및 방제기술
경종적 방제
도깨비가지가 농경지에 침입하면 방제하기가 매우 어렵기 때문에 사전에 들어오지 못하도록 예방하는 것이 가장 중요하고 효율적인 통제 수단이다. 즉 도깨비가지 종자가 포함되어 있을 가축분뇨는 이용하기 전에 55°에서 72시간, 60°에서 24시간 처리하면 종자의 발아력이 상실된다(Nishida et al., 1999b). Muenscher (1955)은 몇 년마다 주기적으로 작물재배를 위해 경운하면 도깨비가지의 발생밀도를 줄일 수 있다고 하였다.
도깨비가지는 독일과 이탈리아 북부의 옥수수와 사탕무 재배지에 발생하여 수량감소 뿐만 아니라 이들 제거에 들어가는 비용이 상당하나 어떠한 경종적 방제방법을 제시하지 못하고 있는데 이는 도깨비가지의 빠른 성장으로 인해 효과적인 제어가 어렵기 때문이라고 하였다(EPPO, 2021).
우리나라에서 도깨비가지는 목초지뿐만 아니라 주로 사료용 옥수수밭에서 발생하고 있다(Moon et al., 2002). 그러나 밭에 발생하는 도깨비가지는 경운할 경우, 절단된 뿌리 절편이 새로운 개체로 형성되어 확산될 수 있기 때문에 효과적으로 방제할 수 있는 경종적인 방제법은 제시하지 못하였다.
물리적 방제
도깨비가지는 종자뿐만 아니라 절단된 여러 뿌리조각에서 재생하여 확산된다. 특히 지하경은 5 mm 내외로 잘려도 신초(新梢, shoot)가 발생(Buhler and Hoffman, 1999)하므로 잦은 경운은 지하경의 영양분 소실을 유도하는 방법이 될 수도 있다. 이런 방법은 도깨비가지 단일 군락이 형성된 곳이 유리할 것으로 판단되어 국내 연구진에 의해 현장 연구가 진행되고 있다. 충청남도 태안군 신두리 해안사구(砂丘, dune, sandhill)에 발생된 도깨비가지 군락지에서 2021년 6월 중순부터 30일 간격으로 5회 경운하여 도깨비가지 발생밀도를 감소시키는 현장 실증연구가 진행되었다(KEITI, 2021). 보고서에 의하면, 경운 전 도깨비가지의 피복도가 5회 경운으로 26%에서 1.2%로 감소되었다. 향후 겨울철 경운으로 도깨비가지의 뿌리가 노출되어 동사(凍死)와 건조사(乾燥死)되면 익년도(2022년) 발생량은 더 줄어들 것으로 예상하고 있다. 그러나 주기적인 경운으로 도깨비가지의 발생밀도를 줄이는 방법은 사구나 휴경한 밭에서만 적용이 가능하다. 농작물이 심겨진 밭이나 목초지 또는 도로변의 도깨비가지 발생밀도를 줄일 수 있는 물리적 방법 개발도 필요하다.
또 다른 물리적 방제법의 하나로 고압의 전기를 처리하는 방법이다(Ock and Pyon, 2011). 이 방법은 도깨비가지만을 선택적으로 방제가 가능하다. 즉 고압전기(5,000 V, 1 A=5 kw)가 도깨비가지 체내에 흐르면서 발생한 열로 인하여 전해질이 파괴되어 지상부 및 지하부를 동시에 죽일 수 있다. 이 방법은 도깨비가지의 발생이 적을 경우에 적용이 가능하다(KEITI, 2021). 또 제초제 사용이 불가능한 경우에는 손으로 줄기와 뿌리를 철저히 제거하는 것이 좋다고도 하였다(AgroAtlas, 2021).
화학적 방제
Moon et al. (2002)에 의하면, 도깨비가지 종자를 대상으로 한 토양처리제 효과에서 alachlor+pendimethalin 유제 및 alachlor 유제를 처리하면 약제처리 15일 후부터 높은 방제효과를 보인다고 하였다. 또 경엽처리제인 glyphosate, triclopyr-TEA, dicamba를 약제처리 10일에 95% 이상 방제되었으나, 30일경에는 80% 내외로 저하되었다. 따라서 도깨비가지를 효과적으로 방제하려면 적용 제초제의 처리횟수를 늘려 뿌리 재생을 철저히 억제하거나 종자를 맺지 못하게 하는 등 수년에 걸친 철저한 관리가 필요하다고 제안하였다.
도깨비가지는 광엽잡초 방제용 제초제에 대해 감수성으로, 이들 제초제의 일부는 단기적으로 효과적이며 다른 일부는 장기적인 효과를 보여주고 있다. 즉 Albert (1960)는 화본과 목초지에서 2,4-D, Gorrell et al. (1981)은 triclopyr가 효과적이라고 하였다. Glyphosate는 과수원에서 과일이 익어가는 동안 적용될 수 있는 가장 효과적인 제초제이다(Banks and Santelmann, 1978; Banks et al., 1977; Nashiki et al., 1985). Whitwell et al. (1980)은 glyphosate 처리가 고온(32℃)일 때 저온(13℃)보다 더 효과적이었다고 보고하였다. 도깨비가지의 유묘(幼苗)는 atrazine, cloransulam, metribuzin와 같은 토양처리 제초제에 민감하게 반응한다(Vangessel, 1999). 옥수수밭에 출현한 도깨비가지는 dicamba로 방제할 수 있다(Prostko et al., 1994). 캐나다 온타리오에서는 옥수수밭에 발생하는 도깨비가지(2-8엽기)를 대상으로 방제시험한 결과, glyphosate 처리는 98%, dicamba+atrazine은 75%, atrazine+2,4-D는 72%, dicamba는 64% 억제되었다(MAFRA, 2021). 또 콩(대두)밭에서 발생한 도깨비가지(2-8엽기)에 경엽처리제인 glyphosate는 98%, glyphosate+cloransulam-methyl은 87% 억제한다(MAFRA, 2021). 이런 화학적 방제는 열매 맺는 단계에서 사용할 때 효과적이다(EPPO, 2021).
생물학적 방제
도깨비가지의 잎과 줄기에 날카로운 가시가 있어 가축(말과 소)이 섭식하는데 장애가 있어 발생밀도를 낮추는데 한계가 있다. 저자들이 제주에서 목초지 발생잡초를 조사할 때, 말이나 소는 목초와 같이 발생한 어리고 연약한 도깨비가지 최상단부의 잎만 먹었고, 줄기에 있는 날카로운 가시로 인해 가축들이 앉지 못하는 것 등을 목격하였다(상세정보 생략). 곤충이 도깨비가지를 갉아먹어 생장을 저지할 수 있는 생물학적 방제법으로 콜로라도감자잎벌레(Leptinotarsa decemlineata)와 가지벼룩딱정벌레(Epitrix cucumeris)가 있다. 또 뿔나방과에 속하는 Gelechiidae 등의 곤충도 도깨비가지의 잎으로 가해한다(KEITI, 2021). 담배 모자이크 바이러스(Tobacco mosaic virus)도 도깨비가지의 생장을 억제시키기도 한다(CABI, 2021). 이런 생물학적 방제방법은 모두 해외 자생 천적들로 이들을 도입하여 적용하는 데는 국내 관련 법률이나 지침이 부재하여 현실적으로 적용 가능하지는 않다.
도깨비가지 확산 방지를 위한 종합방제 제언
도깨비가지는 주로 목초지에 발생하나 발생지역과 관계없이 모두 일률적으로 적용할 수 있는 종합적인 방제모형을 제안하는데 한계가 있다. 따라서 종합방제모형은 빈번하게 경운을 할 수 있는 지역과 경운을 하지 못하거나 1년에 1-2회만 경운을 할 수 있는 지역으로 나누어 각각 제안하는 것이 합리적이다.
빈번하게 경운을 할 수 있는 지역
본문에서 언급한 바와 같이 도깨비가지는 종자와 뿌리, 뿌리에서 떨어진 조각(단편)으로 발생되고 확산된다. 사구(沙丘)나 휴경한 밭과 같이 빈번하게 경운을 할 수 있는 지역에서는 주기적인 경운으로 도깨비가지 뿌리를 계속 절단하는 방법으로 발생밀도를 줄일 수 있다. 이런 결과는 KEITI (2021)와 같이 30일 간격으로 5회 경운으로 발생밀도를 25%에서 1.5%로 낮출 수 있다. 사구에서는 제초제 사용이 제한적이지만, 휴경한 밭에서는 광엽잡초 방제용 제초제인 2,4-D, dicamba, triclopyr-TEA 또는 glyphosate와 같은 이행성 비선택성 제초제 사용도 가능하다.
경운을 할 수 없는 지역
도깨비가지는 목초지뿐만 아니라 도로변, 농로 등과 같은 비농경지에서도 발생한다. 이들 지역에서는 물리적 및 화학적 방제 방법이 유효하다. 즉 삽이나 소형 굴삭기를 이용하여 도깨비가지의 줄기와 뿌리를 굴취(掘取)하는 것이다. 이때 잔뿌리도 잘 수거한 후 제거하여야 한다. 도로변은 도깨비가지를 굴취하는데 제약이 따르므로 glyphosate 등의 흡수이행성 비선택성 제초제를 사용하는 것이 효과적이다.
요 약
생태계교란식물인 도깨비가지의 주요 서식처는 목초지이다. 그러나 현재는 목초지뿐만 아니라 도로변, 제방, 논둑과 밭둑 및 해안사구 등 우리 생활주변에서도 발생되고 있다. 도깨비가지는 6-7월경에 가지꽃과 유사한 보라색 꽃이 피고 9월경에 둥근모양의 노란색 열매를 맺는다. 도깨비가지는 종자와 지하경으로 번식한다. 특히 잘려진 뿌리는 0.5 cm만 있어도 새로운 개체를 만들어 확산한다. 따라서 무분별한 경운은 도깨비가지의 확산을 초래할 수 있으나, 주기적인 경운(30일 간격으로 3회 이상)으로 지하경 영양분을 고갈시켜 제거하는 방법을 고려할 수 있다. 또 dicamba나 triclopyr-TEA 등이나 glyphosate 등과 같은 제초제 살포로 방제할 수 있다. 한편으로는 도깨비가지를 체계적으로 관리할 수 있는 경종적 방제법과 생물학적 방제법에 대한 연구가 더 필요하다.
주요어: 도깨비가지, 목초지, 생태계교란식물, dicamba
Acknowledgements
This study was supported by joint research project from Ministry of Environment, Republic of Korea (Project number: 2021002270004).
Authors Information
In-Yong Lee, Hankyong National University, Research Professor
Seung-Hwan Kim, Hankyong National University, Research Professor
Yong-Ho Lee, Hankyong National University, Research Professor
Jae-Ho Ahn, Hankyong National University, Professor
Sun-Hee Hong, Hankyong National University, Professor