서론
농경지에서 만연하는 잡초를 효율적으로 제거하기 위해서는 제초제의 사용이 필수적인데, 작용기작이 같거나 분해경로가 유사한 제초제들을 장기간 사용하게 되면 많은 잡초종에서 저항성 문제가 발생하게 된다(Aung et al., 2017; Holt et al., 1993; Prather et al., 2000). 많은 잡초종들은 같은 작용점을 갖는 제초제들은 물론 서로 다른 작용점을 갖는 제초제들에 대해서도 저항성을 보이는데, 2019년까지 전 세계적으로 255종 의 잡초종에서 저항성이 보고되었다(Heap, 2019a). 우리나라의 논에서는 주로 acetolactate synthase (ALS) 및 acetyl-CoA carboxylase (ACCase) 저해 제초제가 광범위하고 다년간 지속적으로 사용된 결과 이들 제초제에 대한 저항성 물달개비와 피가 전국적으로 발생하는 것으로 보고되었다(Lee et al., 2017). 한편 화본과인 피속 잡초들은 전 세계적으로 벼의 재배와 수량에 가장 해로운 영향을 끼치는 잡초들 중의 하나이다(Holm et al., 1977). 이러한 피속 잡초들은 현재까지 ALS 및 ACCase 저해제들을 비롯한 여러 주요 제초제들에 대하여 저항성을 보여 왔으며, 두개 또는 그 이상의 서로 다른 작용기작에 속하는 제초제들에 대해서도 복합저항성을 갖는 것으로 알려져 있다(Heap, 2019b; Im, 2009; Im et al., 2009; Park et al., 2010).
제초제 저항성 잡초의 발생이 우려될 때 이의 신속한 진단은 저항성 잡초를 합리적으로 관리하기 위한 선결 조건이라 할 수 있다. 현재까지 제초제 저항성을 진단하기 위해 개발된 방법들은 whole-plant assay, leaf disc flotation assay(Hensley, 1981), petri dish assay (Beckie et al., 1990; Moss, 1995), pollen germination test (Richter and Powles, 1993), chlorophyll fluorescence measurement (Norsworthy et al., 1998), trimmed seedling test 및 stem node test (Kim et al., 2000), enzyme assays(Marshall and Moss, 2008; Reade and Cobb, 2002), DNA assay (Kaundun and Windass, 2006) 및 제초제를 함유한 agar 배지에서 수행되는 Syngenta RISQ test (Kaundun et al., 2011) 등이 있다. 그러나, 제초제 저항성을 확인하기 위해 개발된 기존의 여러 방법들은 비용, 용이성, 측정 항목의 기능적인 한계 등과 같은 일련의 조건들에 따라 사용이 제한될 수 있다. 그러므로 실험 과정이 가능한 단순하고 저비용이며, 결과가 신속 · 정확하게 도출되어 저항성의 평가에 신뢰할 수 있는 결과를 제공할 수 있는 새로운 방법이 필요한데, 이와 같은 이점을 갖는 방법으로써 식물 뿌리의 생장과 발달을 추적하는 growth pouch 방법이 보고되었다(Zhang et al., 2015). 본 연구는 이러한 growth pouch 방법을 이용하여 경남 각 지역의 논에서 수집한 316개 논피 수집종의 ALS와 ACCase 저해 제초제에 대한 저항성의 차이를 평가할 목적으로 수행되었다.
Penoxsulam에 대한 논피 수집종들의 반응성
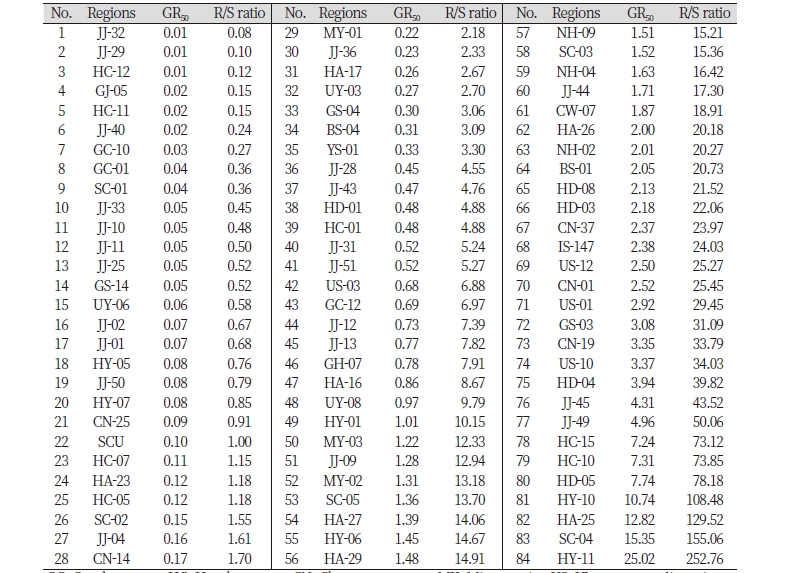
논피 종자는 2016년 9월 하순부터 10월 하순까지 부산광역시와 울산광역시를 포함한 경상남도 20개 시 · 군에서 산간지역, 도시화가 진행된 지역 및 격리된 지역 등을 제외하고 도로‧하천 등을 인접하고 있는 개활지나 평야지대 등의 논 을 중심으로 총 321개 지점에서 채취하였다. 종자의 수집 지점들은 논피가 극심하게 만연된 포장이었으며, 1개체의 식물체에서 결실된 종자만을 수집하였다. 채취된 종자는 4℃에서 저온침지하여 휴면을 타파하고 petri dish에서 발아를 시 켰다. 수집된 논피의 저항성 검정을 위해 Penoxsulam은 0, 0.08, 2.0, 50.0 μg a.i. L-1 농도로 약액을 조제한 후 growth pouch에 각 농도의 제초제를 10 mL씩 주입하였다. Petri dish에서 발아된 종자들 중 뿌리가 1-2 mm 이상 고르게 발아한 개체를 선별하여 growth pouch에 6개씩 치상하고, 200 μEm-2의 광조건 12시간/30℃, 암조건 12시간/25℃의 식물생육상에서 생육 시켰으며, 6일 후에 뿌리의 길이를 측정한 후 각 약제에 의한 GR50값을 계산하였다. 실험은 각 약제 농도별로 3반복의 완전임의배치법으로 수행되었다. ALS 저해 제초제인 Penoxsulam에 대한 표준 감수성은 순천대 수집종(SCU)을, 저항성은 익산 147(IS-147) 수집종을 사용하였다(Table 1). 순천대 수집종과 익산 147의 뿌리 길이에 대한 Penoxsulam의 GR50값은 각각 0.10 μg 및 2.38 μg a.i. L-1 이었다. 321개의 논피 수집종 중 Penoxsulam에 대한 GR50값이 구해진 수집종은 82개 로, 그 중에서 순천대 수집종의 GR50값은 22번째에 속하였으며 그것보다 3배 이상 되는 GR50값을 갖는 수집종들을 저항성으로 정하였다(Fig. 1). 그 결과 고성 04번 수집종(GS-04, GR50값 0.30 μg a.i. L-1)부터 함양 11번 수집종(HY-11, GR50값 25.02 μg a.i. L-1)까지 62.2%에 달하는 51개의 수집종이 Penoxsulam에 대한 저항성인 것으로 나타났다. 경남지역 논 토양에서 ALS 저해 제초제 저항성 논잡초의 발생 및 분포 현황을 보고한 최근의 연구에 의하면 저항성 논피는 물달개비 다음으로 많이 발생하였고, 부산시와 함양군을 제외한 18개 시 · 군에서 발생하였는데(Lee et al., 2018), 본 연구에서도 저항성 논피는 거제, 산청 및 통영을 제외한 17개 시군에서 광범위하게 발생하였다. 또한 저항성 수집종 중 함양 296번은 가장 높은 GR50값을 나타냈는데, 순천대 수집종과의 Resistance/susceptible (R/S) ratio는 257.76으로 나타났다.
Cyhalofop-butyl에 대한 논피 수집종들의 반응성
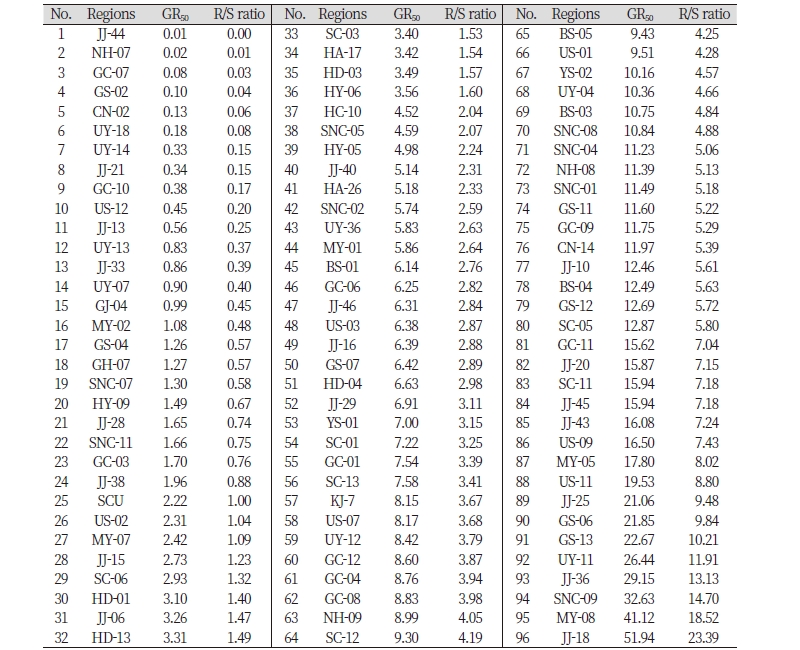
ACCase 저해 제초제인 Cyhalofop-butyl에 대한 표준 감수성 수집종도 Penoxsulam에서와 같이 순천대 수집종을, 저항성은 광주 7(KJ-7) 수집종을 사용하였다(Table 2). 논피 종자는 Penoxsulam에서와 같이 발아되어 0, 3.2, 12.8 및 51.2 μg a.i. L-1 농도의 Cyhalofop-butyl 10 mL가 첨가된 growth pouch에 치상하여 식물생육상에서 생육 시켰으며, 6일 후에 뿌리의 길이를 측정한 후 GR50값을 계산하였다. 실험은 Penoxsulam에서와 같이 각 농도별로 3반복의 완전임의배치법으로 수행되었다. Cyhalofop-butyl에 대한 뿌리 길이의 GR50값은 순천대 수집종에서 2.22 μg a.i. L-1, 광주 수집종(KJ-07)에서 8.15 μg a.i. L-1이었다(Table 2). 321개의 논피 수집종 중 뿌리의 길이 생장에 대한 Cyhalofop-butyl의 GR50값이 구해진 수집종은 94개였다. 순천대 수집종의 GR50값은 25번째에 속하였는데, 그것보다 3배 이상 되는 GR50값을 갖는 수집종들을 저항성으로 정하여 다른 것들과 비교한 결과 진주 29번 수집종(JJ-29, GR50값 6.91 μg a.i. L-1)부터 진주 18번 수집종(JJ-18, GR50값 51.94 μg a.i. L-1)까지 46.8%에 달하는 44개의 수집종이 저항성인 것으로 나타났다(Fig. 2). 또한 표준 저항성 수집종인 광주 수집종 보다 더 높은 GR50값을 갖는 수집종들도 39개 이상이었으며, 가장 높은 GR50값을 갖는 진주 18번과 순천대 수 집종의 R/S ratio는 23.39로 나타났다. 저항성 수집종은 Penoxsulam의 경우에 달리 거창, 산청, 진주 사천, 고성 등의 서부 지역과 울산, 양산 및 부산 등의 동부 지역에 주로 분포되어 있었다(결과 미제시).
위에서와 같이 growth pouch 방법을 사용하여 경남 지방 논피 수집종들의 제초제에 대한 반응성을 조사한 결과, 다수의 수집종들은 ALS 저해 제초제인 Penoxsulam과 ACCase 저해 제초제인 Cyhalofop-butyl에 대하여 감수성이 현저하게 차이가 났으며, 표준 감수성 수집종 보다 3배 이상의 저항성을 보이는 수집종들도 다수가 있는 것으로 나타났다. 또한 Cyhalofop-butyl 보다 Penoxsulam에 대한 저항성 개체의 비율이 더 높고, R/S ratio도 현저하게 더 높은 것을 알 수 있었다. 제초제 저항성 검정의 가장 일반적인 방법인 whole-plant assay법(HRAC, 2019)에 비해 Zhang et al. (2015)이 개발한 growth pouch 법은 피 속에서 신속하고 간단하게 살초효과를 평가할 수 있으며, whole-plant assay 법으로 구한 GR50 값의 R/S ratio 와도 유사한 경향을 보여 제초제 저항성의 진단을 위해 신뢰성이 높은 방법으로 평가된다. 이러한 결과로 미루어 볼 때 경남지역의 논에서 ALS나 ACCase 저해 제초제 저항성 피의 확산을 막기 위해서는 이들 제초제가 함유된 단제나 복합제의 장기간에 걸친 사용을 피하고 가능한한 다른 작용기작을 갖는 제초제의 사용을 권고할 필요가 있다. 또한 Penoxsulam과 Cyhalofop-butyl에 대한 저항성이 큰 수집종들에서 그 원인이 각각의 표적 효소인 ALS나 ACCase의 돌연변이에 의한 것인지 또는 비특이적 분해효소의 변화에 의한 것인지 등을 파악하기 위한 연구도 필요할 것으로 사료된다.
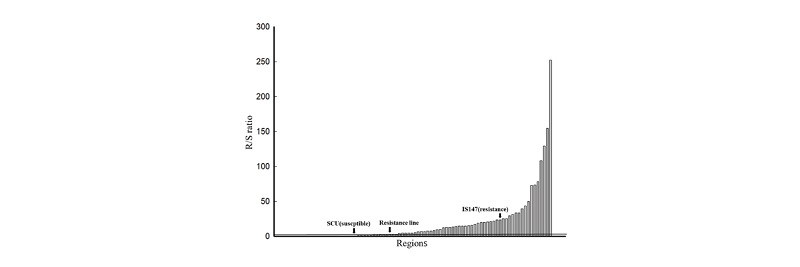
Fig. 1.R/S ratio of Penoxsulam resistant Echinochloa oryzicola to susceptible Echinochloa oryzicola in Gyeongnam province. GC: Geochang-gun; HC: Hapcheon-gun; CN: Changnyeong-gun; MY: Miryang-city; US: Ulsan-metropolitan-city; HY: Hamyang-gun; SNC: Sancheong-gun; UY: Uiryeong-gun; HA: Haman-gun; CW: Changwon-city; GH: Gimhae-city; YS: Yangsan-city; HD: Hadong-gun; JJ: Jinju-city; BS: Busan-metropolitancity; SC: Sacheongun; GS: Goseong-gun; NH: Namhae-gun; TY: Tongyeong-city; GJ: Geoje-city. The regions on the X axis correspond to the respective regions corresponding to the R/S ratio of Table 1.
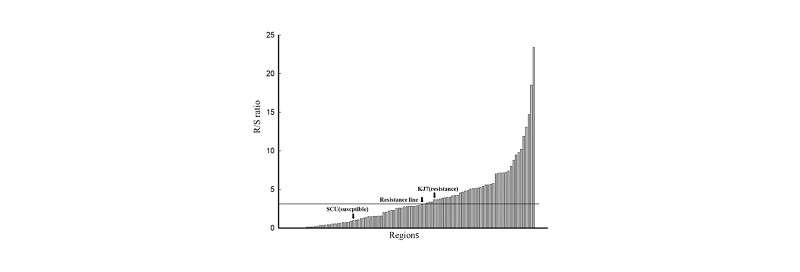
Fig. 2.R/S ratio of Cyhalofop-butyl resistant Echinochloa oryzicola to susceptible Echinochloa oryzicola in Gyeongnam province. GC: Geochang-gun; HC: Hapcheon-gun; CN: Changnyeong-gun; MY: Miryang-city; US: Ulsan-metropolitan-city; HY: Hamyang-gun; SNC: Sancheong-gun; UY: Uiryeong-gun; HA: Haman-gun; CW: Changwon-city; GH: Gimhae-city; YS: Yangsan-city; HD: Hadong-gun; JJ: Jinju-city; BS: Busan-metropolitancity; SC: Sacheongun; GS: Goseong-gun; NH: Namhae-gun; TY: Tongyeong-city; GJ: Geoje-city. The regions on the X axis correspond to the respective regions corresponding to the R/S ratio of Table 2.