서 언
세계 주요 재배작물 중 하나인 콩(Glycine max)은 일부 비타민과 아미노산, 이소플라본, 사포닌 등의 성분을 함유하고 있으며, 혈관 질환 위험 요소 완화, 콜레스테롤 수치 완화, 암 예방, 비만 예방 등과 같은 이점으로 인해 세계적으로 소비가 증가하고 있으며, 이에 따라 콩의 재배량 역시 증가하는 추세를 보이고 있다(Natarajan et al., 2013; Thao and Tran, 2012). 2018년 국내 콩 생산량은 89.4천톤으로 이는 전년도 대비 4.4% 증가한 수치이며, 재배 면적 역시 11.2% 증가한 약 5만 헥타르로 조사되었다(KOSTAT, 2018).
ISAAA (International Service for the Acquisition of Agri-biotech Applications)의 발표에 따르면 세계 GM (genetically modified, 유전자변형) 작물의 재배 면적은 1996년 이후 2015년을 제외하고 매년 지속적으로 증가해왔다. 2018년 GM 작물의 재배 면적은 약 1억 9,170백만 헥타르이며 이는 2017년 1억 8,980 만 헥타르보다 약 2백만 헥타르 증가한 수치이다(ISAAA, 2019). 1994년 처음으로 상품화된 GM 토마토가 개발된 이후로 GMO (genetically modified organism)의 상품화 및 상업적 이용을 목적으로 한 생산도 지속적으로 증가하고 있는 추세이다(Kim et al., 2008). 콩은 전체 GM 작물의 재배면적 중 50% 이상을 차지하는 주요 작물로, 일반 재배 콩에 비해 GM 콩의 재배 면적이 약 4배에 달한다(KBCH, 2018). 1992년 이후 40개의 국가에서 식품용 및 사료용으로 GM 작물을 이용하고 있으며, 우리나라의 경우 2017년 식품용 수입 승인 GM 작물 중 GM콩이 46%를 차지하는 등 높은 수입량을 보였다(KBCH, 2018).
GM 콩을 포함한 GM 작물의 재배가 증가함에 따라 유전자 이동성과 이에 따른 생태학적 문제 예방 및 해결을 위한 다양한 연구들이 시도되었다(Lu, 2004). 자연 내 교잡율이 낮더라도 교잡에 의한 야생종으로의 유전자 이동은 생태계 교란, 생태계 다양성 감소 등의 부정적인 결과를 초래할 수 있기 때문에 GM 작물과 야생종 사이의 자연 내 교잡 가능성에 대한 연구의 필요성이 대두되었다(Lu, 2004; Mizuguti et al., 2010). 일반적으로 작물 간 유전자 이동은 종내 이동으로 한정되어 있으나 매우 드물게 종간 이동이 발생할 수 있으며(Ryffel, 2014), 일부 작물에서는 바람과 곤충 등에 의하여 수 킬로미터 내에서도 수분이 가능한 것으로 보고되어 있다(Dale et al., 2002). 콩은 자가수분을 하는 종으로 알려져 있고 재배종 콩의 타가수분율은 1% 이하로 매우 드물게 나타난다(Lee et al., 2018; Ray et al., 2003). 하지만 특정 환경에서 2.5% 이상의 타가수분율을 보이는 연구가 보고되었고, 야생콩(G. soja)에서도 최대 19%의 높은 타가수분율이 보고되기도 하였다 (Nakayama and Yamaguchi, 2002; Ray et al., 2003). Park et al. (2016)은 GM 콩이 자연환경에 방출될 경우 도입 유전자의 이동 및 잡초화에 의해 환경위해성을 나타낼 가능성이 있다고 보고하였다. 우리나라를 포함하는 동아시아 지역은 야생콩의 원산지로 야생콩이 전국적으로 분포하고 있어 야생콩과 GM 콩의 완전한 격리가 이루어지기 어려운 환경이므로 야생콩과 GM 콩 간의 교잡이 우려되는 실정이다(Mizuguti et al., 2010; Wang and Li, 2011).
바이오안전성정보센터의 보고에 따르면, 2017년 국내에서 GM 유채와 GM 면화가 비의도적으로 환경 방출된 사례가 보고되었고, 핀란드의 경우 자연 생태계에서 GM 페튜니아가 발견되는 등 GM 작물의 환경 방출 사고가 발생함에 따라 GM 작물의 안전관리방안 마련이 중요시되고 있다(KBCH, 2018). GM 작물로부터의 자연 환경 내 비의도적인 환경 방출에 의한 유전자 이동 가능성은 야생종과 GM 작물이 교잡된 F1 세대를 비롯하여 이후 세대들의 종자 활력과 생식능력에 따라 크게 좌우된다. 작물의 활성 능력은 해당 개체의 생장 및 생식 정도에 따라 평가할 수 있다. 야생콩과 GM 콩 간의 유전자 이동에 대한 여러 연구가 있었지만, GM 콩으로부터 전달된 야생콩 내의 도입 유전자의 안정성과 세대간 전달 및 교잡종의 활성 평가 연구는 거의 이루어지지 않고 있다(Guan et al., 2015). GM 콩과 야생콩 간의 교잡종에 대한 환경 위해성 평가를 위해서는 종자 활성 능력과 발아 휴면 특성이 중요한 평가 요소이다. 이는 콩이 대표적인 자가수분 작물이며, 따라서 타가수분 작물에 비해 세대 진전에 따른 도입 유전자의 잔존할 가능성이 높으며, 월동성이 높을수록 종자 활력을 오래 유지할 수 있기 때문이다(Park et al., 2016). GM 작물의 잡초화 가능성 역시 GM 작물의 잠재적 위해 영향 요인 중 하나이다. 토양 내 월동 종자의 활력 유지 기간이 길거나, 비경작 환경에서의 생장 지속 능력이 높을수록 잡초화 가능성이 높다고 판단할 수 있다(Ko et al., 2016).
본 연구는 GM 콩으로부터 야생콩으로의 유전자 교잡 평가요소 발굴 및 환경 영향 평가를 위한 기초 자료 확보를 위해 수행되었다. 이를 위해 베타카로틴 강화 콩(Qin et al., 2015)과 야생콩 간의 교잡종을 선발하여 생육 특성을 비교 분석하고 월동성 비교 평가를 통한 발아 휴면 특성 분석을 실시하였다.
재료 및 방법
야생콩과 베타카로틴 강화콩의 교잡 유도
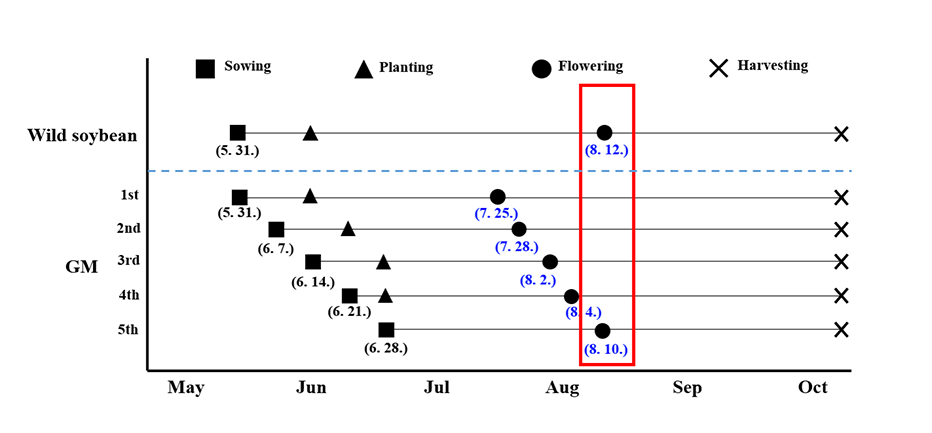
GM콩과 야생콩의 교잡 가능성 및 교잡종의 생육 특성 분석을 위하여 카로티노이드 합성 관련 유전자인 Phytoene synthase (Psy)와 Carotene desaturase (CrtI) 유전자가 공동으로 과발현 되는 베타카로틴 강화콩(Glycine max)과 경북대학교에서 분양 받은 PI483463 계통의 야생콩(G. soja)을 교잡하였다. 교잡유도를 위하여 전주시 농업과학원 LMO (living modified organisms) 격리 포장(RDA-가AB-2013-041) 내에서 베타카로틴 강화 콩과 야생콩을 12각 포트(외경 21.5 cm, 내경 18.7 cm, 높이16.3 cm)에 한 개체씩 파종한 후 약 15 cm 간격으로 교차 배열하여 밀식 재배하였다. 인위적인 교잡을 위한 야생콩과 베타카로틴 강화콩의 개화기 일치를 위해 베타카로틴 강화콩을5월 31일, 6월 7일, 6월 14일, 6월 21일, 6월 28일 등 총 5회에 나누어 파종하였고, 야생콩의 개화일(8월 12일)과 유사한 6월 28일에 파종한 베타카로틴 강화콩(개화일 8월 10일)을 부본으로 13개체와 야생콩 12개체를 5줄씩 교차배열하여 교잡 유도를 수행하였다(Fig. 1).
교잡종의 제초제 선발 및 PCR 검정
글루포시네이트(glufosinate) 저항성 유전자인 bar 유전자를 선발마커로 사용하여 교잡종 확인을 위한 제초제 선발 과정을 진행하였다. 교잡이 유도된 야생콩 12개체들로부터 수확된 전체 종자를 파종하였고, 파종 2주 후 0.5% 글루포시네이트 암모늄(바스타)을 7일 간격으로 2회 처리하여 제초제 저항성 개체를 선발하였다. 이 후 선발된 개체에 대하여 immunostrip 검정 및 PCR 검정을 실시하였다. 2차 제초제 처리 후 생존한 개체에 대하여 베타카로틴 강화 콩의 도입단백질인 PAT (phosphinothricin acetyltransferase)단백질의 검정이 가능한 LL Immunostrip kit (Romerlabs Inc., Union, USA)을 사용하여 검정을 수행하였다. Immunostrip 검정 결과, 양성인 개체에 대해서는 잎으로부터 genomic DNA를 추출하여 PCR 검정을 실시하였다. 분석에 사용된 genomic DNA의 추출은 DNeasy Plant Mini Kit (Qiagen, Valencia, USA)를 이용하여 매뉴얼에 따라 추출하였고, 교잡종 검정을 위해 bar 유전자 특이적 프라이머(F:5’-TCTGCACCATCGTCAACCACTACAT-3’, R:5’-CTGAAGTCCAGCTGCCAGAAACCCA-3’) 및 베타카로틴 강화콩의 도입유전자인 PsyCrtI 유전자를 목적으로 한 프라이머(F:5’-ACGTTGCTGGTACGGTTGGGTTC-3’, R:5’-GCCCGACCGCCGGGTTTATC-3’)를 사용하였다. 또한 야생콩(G. soja)과 재배콩(G. max)의 품종 판별에 이용하는 SSR (simple sequence repeat) 마커(F:5’-CACTGCTTTTTCCCCTCTCT-3’, R:5’-AAGATACCCCCAACATTATTTGTAA-3’)를 이용하여 교잡종의 특성 분석을 실시하였다(Cho et al., 2006). PCR 검정은 94℃에서 5분간 DNA 변성 및 94℃ 30초, 57℃ 30초, 72℃ 30초의 조건으로 35회 반복한 후 72℃에서 5분간 반응하였다. 증폭된 PCR 산물은 1% 아가로스겔을 이용한 전기영동법으로 확인하였다.
생육 특성 평가
품종별 생육 특성 평가를 위하여 교잡 후대종(hybrid F2) 및 부본인 베타카로틴 강화 콩과 베타카로틴 강화 콩의 모품종인 광안콩(Glycine max), 교잡종의 모본인 야생콩을 각각 파종하여 온실 내에서 발아를 유도한 뒤 약 2주 후 LMO 격리포장에 정식하였다. 정식 밀도는 70 cm×30 cm이었으며, 관행 재배법에 따라 재배하였다. 각 품종별 종자의 등숙이 완료되는 시점에서 생육조사를 수행하였으며, 경장, 도복 정도, 분지수, 절수, 개체당 전체 협수 및 종자수에 대해 조사를 실시하였다. 모든 생육조사는 각 품종별 10개체에 대해 반복 수행하였다. 모든 결과에 대한 통계 분석은 SPSS (23.0.0 for Windows, Rel.23.0, 2015., SPSS Inc., Chicago, USA)를 이용하여 p < 0.05 수준에서 Duncan test와 ANOVA로 평균간의 유의성 여부를 검정하였다.
종자 특성 평가
교잡 후대종(hybrid F2) 종자의 발아 및 형태적 특성 평가를 위하여 교잡 후대종(hybrid F2)과 베타카로틴 강화 콩, 광안콩, 야생콩 종자에 대해 발아율 및 종자 크기, 종피색, 발아속도에 대한 조사를 실시하였다. 수확된 각 품종별 종자 중 정선이 완료된 300립의 종자를 파종하여 LMO 격리 온실 내에서 생육하였고, 파종 2주 후 발아한 개체 수를 조사하여 발아율을 측정하였다. 야생콩의 경우 단단한 종피로 인해 균일한 발아율 조사가 어려우므로 물리적으로 종피 일부를 제거하여 사용하였다. 종자의 형태적 특성 분석을 위해 각 품종별 무작위로 선발된 정상 종자에 대해 종자의 길이와 너비 및 100립중을 측정하였다. 전체 수확 종자 중 무작위로 선발된 정상 종자 100립에 대해 길이와 너비를 측정하였고, 100립중의 측정은 10회 반복 실시하였다. 각 품종별 종피의 색깔은 육안으로 판단하여 분류하였다. 종자의 발아 속도에 대한 평가는 각 품종별 총 100립에 대해 조사하였다. 페트리디쉬(100 mm×40 mm, SPL life science, Pocheon, Korea)에 필터페이퍼(90 mm, ADVANTEC, Tokyo, Japan)를 깔고 증류수를 10 mL 첨가하여 종자를 10 립씩 25℃의 암조건에서 배양하였고, 24시간 간격으로 떡잎(cotyledon)이 형성된 종자의 개수를 측정하였다. 야생콩의 경우, 별도의 인위적인 종피 제거 없이 자연 상태로 이용하였다.
월동성 평가
콩 품종별 종자의 월동성 평가 실험은 국립농업과학원 LMO 격리포장에서 2017년 12월부터 2018년 5월 사이에 진행되었다. 각 콩 품종별 종자 100립을 무작위로 선별하여 망사형 봉투(크기 6 cm×8 cm, 체눈 2 mm)에 넣어 0, 5, 10, 20 cm 깊이의 토양에 매립하였고, 각각 3개월과 5개월의 월동 기간을 처리한 후 종자를 꺼내어 발아율 검정에 이용하였다. 토양에서 꺼낸 종자는 증류수로 세척하여 페트리디쉬에서 파종 및 배양한 후, 발아된 개체 수 및 발아율을 측정하여 각 품종별의 월동성을 평가하였다.
결과 및 고찰
교잡종 선발
교잡을 유도한 야생콩 12개체들에서 총 3,769립의 종자를 수확하였고, 이중 최종적으로 8개체가 제초제 저항성을 보이는 것으로 나타났으며, 교잡율은 0.212%로 분석되었다. 제초제 저항성 확인된 8개체를 대상으로 PAT 단백질에 대한 immunostrip 검정을 실시한 결과 모든 개체에서 양성반응을 나타냈다(Fig. 2).
추가로 실시한 PCR 분석 결과, 선발된 8개체의 교잡종에서 글루포시네이트 저항성 유전자와 베타카로틴 강화콩의 목적유전자인 PsyCrtI 유전자가 모두 검출되었다(Fig. 3). 일본에서 수행한 Yoshimura et al. (2006)의 보고에 따르면, 재배콩과 GM콩의 교잡율 분석 연구 결과에서도 본 실험과 비슷한 결과를 나타내었다. 2001년부터 2004년까지 4회에 걸쳐 재배콩과 GM콩 사이의 자연적인 유전자 이동 발생률을 분석한 결과 0.7 m의 재식거리에서 최대 0.19%의 교잡률을 나타내었다. Guan et al. (2015)에 의해 발표된 연구 결과에서도 2종류의 GM콩과 야생콩을 교잡한 결과, 각각 100개체를 수분하여 13개체와 8개체의 교잡종이 확인되어 매우 낮은 교잡종의 발생 비율을 보였다. 본 연구에서는 인위적으로 교잡종 선발을 위해 야생콩과 베타카로틴 강화콩의 개화 시기를 일치하여 연구에 이용한 것으로, 일반적 재배조건에서는 재배콩의 개화시기와 야생콩의 개화시기는2-3주 이상 차이가 있는 것으로 알려져 있어 일반적인 자연 환경 내에서는 이보다 낮은 교잡율을 보일 것으로 사료된다.
야생콩과 재배콩의 분자적 판별 마커로 사용된 SSR 마커의 경우, 야생콩과 재배콩이 각각 다른 크기의 대립유전자를 보임으로써 품종을 구분할 수 있다. 광안콩과 베타카로틴 강화콩에서는 같은 크기의 밴드(200 bp)가 검출되었으며, 야생콩과 교잡종 8개체에서는 100 bp의 동일한 밴드가 검출되어 선발된 8개체의 교잡종은 분자생물학적으로 모본인 야생콩 형질에 가까운 것으로 판별되었다(Fig. 3). Park et al. (2016)과 Lim et al. (2015)의 보고에서는 각각 콩과 유채의 교잡종을 선발하여 발아 특성을 평가한 결과, 교잡종의 발아 특성이 부본에 비해 모본과 유사한 것으로 확인되었다. 이러한 결과들은 본 실험의 PCR 결과와 상응하는 것으로, 교잡 후대종(hybrid F2)이 모본과 유사한 생육 특성 및 발아 특성을 보이는 것은 분자생물학적으로 모본에 가까운 특성을 지니고 있기 때문인 것으로 사료된다. 선발된 야생콩과 베타카로틴 강화콩의 교잡종 8개체들을 육성하여, 총 3,786립의 교잡 후대종(hybrid F2) 종자를 채종하였으며, 이후 종자 특성 등의 분석을 위해 사용되었다.
콩 품종별 생육 특성
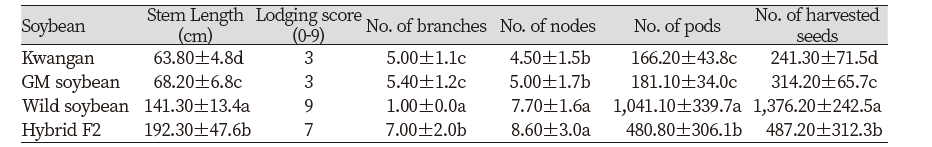
콩 품종별 생육 특성을 조사한 결과, 베타카로틴 강화콩과 교잡종, 야생콩간의 유의한 차이가 확인되었다(P<0.05). 교잡종의 부본인 베타카로틴 강화콩의 경장은 68.2±6.8 cm, 분지수는 5.4±1.2개, 절수는 5.0±1.7개, 협수는 181.1±34.0개, 총 수확 립수는 314.2±65.7개으로 조사되었다. 교잡종의 모본으로 이용된 야생콩의 경우에는 경장 141.3±13.4 cm, 분지수 1.0±0.0개, 절수 7.7±1.6개, 협수 1,041.1±339.7개, 전체 립수는 1,376.2±242.5개로 측정되었다. 교잡종의 경장은 192.3±47.6 cm, 분지수는 7.0±2.0개, 절수는 8.6±3.0개, 협수는 480.8±306.1개, 전체 립수는 487.2±312.3개로 조사되어, 경장의 길이, 분지수 및 절수는 모부본에 비해 증가하였고, 협수와 립수의 경우 모부본의 중간형질을 나타내고 있다. 베타카로틴 강화콩의 모품종인 광안콩의 경우에는 베타카로틴 강화콩과 유사한 생육 특성을 보였다. 도복 특성은 야생콩에서 가장 높게 나타났고, 광안콩과 베타카로틴 강화콩은 낮은 도복 특성을 보였다. 교잡종은 야생콩보다는 약하지만 베타카로틴 강화 콩보다는 높은 도복 특성을 보였다(Table. 1).
콩 품종별 종자 특성
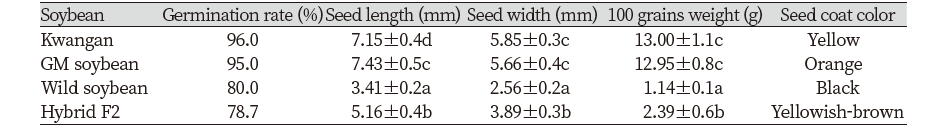
각 품종별 종자의 발아율은 베타카로틴 강화콩과 광안콩이 95% 이상으로 높은 발아율을 보였고, 야생콩과 교잡 후대종(hybrid F2)은 약 80% 이하의 비슷한 발아율을 나타냈다. 교잡 후대종(hybrid F2)과 모본인 야생콩, 부본인 베타카로틴 강화 콩의 종자 특성을 조사한 결과 종자 형태와 무게 및 종피색 모두에서 유의한 차이를 보였다 (P<0.05). 야생콩의 경우 종자의 길이는 3.41 mm, 종자의 너비는 2.56 mm로 가장 작은 크기를 보였으며 백립중 역시 1.14 g으로 가장 적은 수치를 나타내었다. 반면, 베타카로틴 강화콩은 종자 길이 7.43 mm, 종자너비 5.66 mm로 야생콩에 비해 2배 이상 큰 크기로 측정되었다. 교잡 후대종(hybrid F2)의 경우 종자의 길이가 5.16 mm, 종자의 너비가 3.89 mm, 백립중은 2.39 g으로, 모본인 야생콩과 부본인 베타카로틴 강화콩의 중간 형질을 나타내었다. 베타카로틴 강화콩의 모품종인 광안콩의 경우에는 베타카로틴 강화콩과 종자의 형태적인 특성 중에서 종자길이를 제외하고 유의적인 차이를 보이지 않았다(Table. 2). 종피색에서는 각각의 품종별로 확연한 차이가 보였다. 야생콩은 검정색, 베타카로틴 강화콩은 주황색을 나타냈고, 교잡 후대종(hybrid F2)은 이들의 중간형질이라 보여지는 황갈색을 띠었다(Fig. 4). Park et al. (2016)의 실험 결과에 의하면, 염 스트레스 저항성 유전자가 도입된 GM콩과 야생콩 간의 교잡 후대종(hybrid F2) 역시 종피 색깔을 비롯한 종자 특성에서 모부본의 중간형질을 나타내었다. 이러한 결과를 토대로, 교잡종 종자의 형태적 특성은 야생콩과 베타카로틴 강화콩의 복합된 형질에 의해 결정되는 것으로 사료된다.
종자의 발아 속도에서는 베타카로틴 강화 콩과 광안콩이 크게 차이를 보이지 않았고, 야생콩은 현저히 느린 속도를 보였으며, 교잡종은 야생콩보다는 베타카로틴 강화콩에 유사한 특성을 보였다(Fig. 5). 24시간 이내에 발아한 립수는 총 100 립 중 17립으로 교잡콩에서 가장 많았으나, 48시간째 베타카로틴 강화콩과 광안콩의 발아율이 크게 증가하였다. 베타카로틴 강화 콩과 광안콩은 72시간 이내에 60% 이상의 발아율을 보였고, 교잡종의 경우 48%, 야생콩은 4%의 낮은 발아율을 나타냈다. Lindgren et al. (2003)의 보고에 따르면, 베타카로틴 생합성 과정에 관여하는 phytoene synthase 유전자를 과발현시킨 애기장대에서 베타카로틴 함량 증가 및 발아의 지연이 확인되었다. 따라서 베타카로틴 함량이 증가된 베타카로틴 강화콩의 발아가 광안콩에 비해 지연될 것으로 예상하였으나, 결과적으로 광안콩과 유사한 발아 속도를 보였다. 그러나 교잡종의 경우, 모본인 야생콩에 비해 현저하게 발아가 촉진되는 것을 확인할 수 있었다. 야생콩은 단단한 종피로 인해 자연적인 발아가 어렵지만, 교잡에 의한 종자 내 특성 변화로 인해 교잡종의 발아가 용이해진 것으로 사료된다. 더 정확한 결론을 위하여 차후 종자 내 호르몬 함량 및 관련 유전자 발현 비교를 비롯한 분자적 수준에서의 분석이 필요할 것이다.
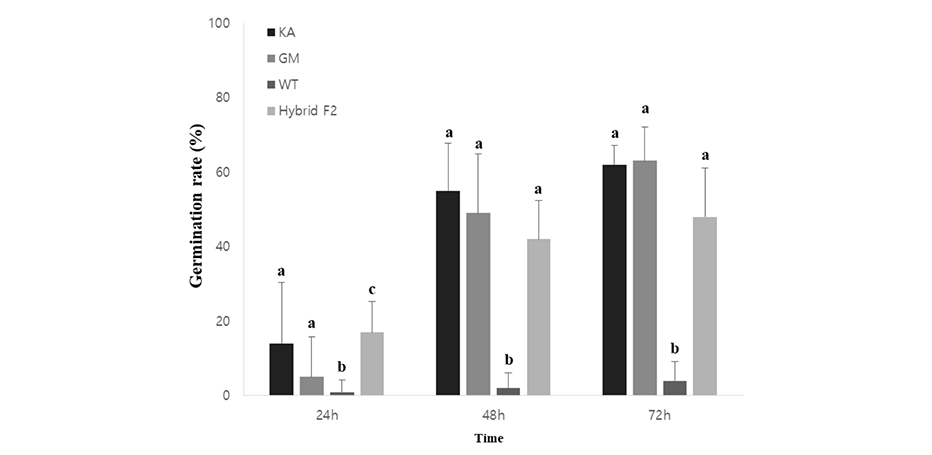
Fig. 5. The germination rates of soybeans under dark conditions. KA: Glycine max; GM: β-carotene enhanced transgenic soybean; WT: Glycine soja (PI483463, wild soybean); Hybrid F2: β-carotene enhanced transgenic soybean×wild soybean hybrid F2. a-c: Values with different letters in column means significantly different.
월동휴면성 평가
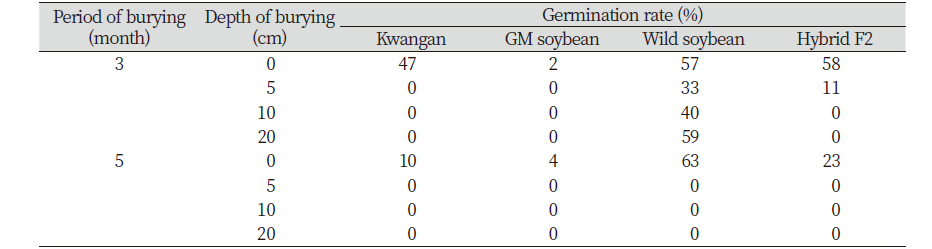
콩 품종별 월동휴면성을 분석하기 위해서 2017년 12월 7일에 국립농업과학 LMO 격리 포장에 각각 100립을 토양 깊이에 따라 매립하여 3개월과 5개월 간 처리한 후 종자의 발아율을 비교하였다. 3개월의 월동 처리 후 발아율을 분석한 결과, 야생콩은 20 cm의 매립 깊이에서도 59%의 비교적 높은 발아율을 보였다. 교잡종의 경우에는 10 cm이상의 깊이에서는 월동하지 못했으며, 5 cm깊이에서도 야생콩에 비해 매우 낮은 수치인 약 11%의 발아율을 보였다. 반면, 베타카로틴 강화콩은 0 cm깊이에서 2%의 매우 낮은 발아율을 보였으며 0 cm를 제외한 모든 토양 깊이에서 월동성을 보이지 않았다. 베타카로틴 강화콩의 모본인 광안콩의 경우에는 0 cm에서 47%의 발아율을 보인 것에 비해, 5 cm 이상의 토양 깊이에서는 베타카로틴 강화콩과 마찬가지로 전혀 발아하지 않는 것으로 나타났다. 5개월 간의 월동 처리 후에는 0 cm 매립 깊이에서 야생콩이 63%, 교잡종이 23%, 베타카로틴 강화 콩이 4%, 광안콩이 10%의 발아율을 보였으며, 5cm이상의 모든 매립 깊이에서 각 품종들은 전혀 발아하지 않았다(Table. 3). Kubo et al. (2013)에 의해 수행된 연구에서도 이와 유사한 결과를 보였다. 3개월간 4℃에 저장한 종자의 발아율을 시험한 결과, 재배콩과 GM콩은 0% 또는 0%에 가까운 발아율을 보였고 야생콩과 교잡종은 50% 이상의 유사한 발아율을 보였다. 이러한 결과를 바탕으로 교잡종의 월동성은 GM 콩에 의해 삽입된 도입유전자와는 무관하게 모본인 야생콩의 특성에 따라 결정되는 것으로 판단된다.
기존에 보고된 결과들을 비롯해 본 연구 결과에 따르면 자연 환경 내에서의 GM콩의 도입 유전자 이동은 매우 낮은 비율로 발생할 것으로 사료된다. 일반적인 재배 환경 조건에서는 GM콩과 야생콩의 경우 개화기가 일치하지 않으므로 GM콩이 비의적인 환경 방출이 될 경우에도 야생콩간의 화분에 의한 유전자 이동이 발생할 확률은 낮을 것으로 보인다. 그러나 Lee et al. (2015)의 보고에 따르면, 총채벌레가 매개충으로 작용하여 GM콩의 도입유전자가 야생콩으로 전이되기도 하였다. 이처럼 개화기 이외에도 재배환경과 충매 이동 등 다양한 기타 요인들에 의해 교잡이 발생할 가능성을 완전히 배제할 수 없다. 반면, 베타카로틴 강화콩과 야생콩간의 교잡종의 경우 일반 재배콩보다 다소 높은 월동휴면성을 보였는데, 향후 월동 종자들에 대한 유전자 활성 분석을 통해 도입 유전자 활성의 잔존 여부 조사가 필요할 것이다. 또한 장기적인 교잡 후대종의 종자 발아, 휴면 및 생식 특성 조사를 통한 교잡 후대종의 잡초화 가능성 평가가 지속적으로 이루어져야 할 것이다.
요 약
본 연구에서는 야생콩과 베타카로틴 강화콩의 교잡으로 형성된 교잡종의 종자 및 생육 특성과 월동성을 조사하여 교잡종의 잡초화 가능성을 평가하고자 하였다. 야생콩과 베타카로틴 강화 콩을 개화기 일치 등의 인위적으로 교잡한 결과 최종 교잡율은 0.21% 로, 8개체의 교잡종이 선발되었다. 교잡종은 생육 형태는 모본인 야생콩과 유사한 형태를 보였으며, 형성된 협수와 종자 수 및 종자의 크기는 야생콩과 베타카로틴 강화 콩의 중간 형질을 나타냈다. 반면, 종자의 발아 속도는 야생콩보다 크게 증가하여 베타카로틴 강화콩과 유사한 속도를 보였다. 교잡종은 표토조건에서 3개월간 월동한 경우 야생콩과 비슷한 수치의 월동성을 보였으나, 이를 제외한 나머지 조건에서는 야생콩보다 낮은 월동휴면성을 보였다. 베타카로틴 강화콩과 야생콩간의 낮은 교잡율과 월동휴면성을 바탕으로 교잡종이 환경 내 방출되어 생태계 교란을 유발할 가능성은 낮지만, 다양한 요인을 고려하여 장기적인 교잡 후대종의 도입 단백질 활성 평가 및 잡초화 가능성 평가 등을 비롯한 환경 안전성 평가가 필요할 것으로 사료된다.
주요어: 교잡콩, 발아, 베타카로틴 강화 GM콩, 야생콩, 유전자이동
Acknowledgement
This study was carried out with the support of "Next-generation BioGreen 21 Program (PJ01368003)", Rural Development Administration, Republic of Korea.
Authors Information
Sung-Dug Oh, National Institute of Agricultural Sciences, Researcher, http://orcid.org/0000-0001-8574-6773
Ye-Jin Jang, National Institute of Agricultural Sciences, Researcher
Soo-Yun Park, National Institute of Agricultural Sciences, Researcher
Sang Jae Suh, Kyungpook National University, Professor
Bumkyu Lee, Jeonju University, Professor