서 언
제초제는 작물의 수확량과 생산효율을 높이는데 중요한 역할을 하고 있으나, 사용량이 증가함에 따라 저항성 잡초가 발생할 수 있다. 우리나라 논잡초의 발생과 관련된 연구에 따르면 1980년대에는 새롭게 도입된 제초제 뷰타클로르의 사용으로 피의 발생이 현저히 줄어들었고, 물달개비, 올미 및 벗풀 등의 광엽 잡초가 우점하였다(Kim et al., 1992). 1990년대에 들어와서는 acetolactate synthase (ALS) 저해제인 sulfonylurea (SU)계를 포함한 논 일발처리제의 사용으로 일년생잡초보다는 올방개, 올미 및 벗풀 등과 같은 다년생 잡초가 우점하였으며, 2000년에 실시된 논잡초 조사 결과에서는 SU계 제초제의 광범위한 사용으로 인하여 저항성 물달개비가 전국적으로 발생한 것으로 보고되었다(Park et al., 2002). 또한 2013년 보고에 따르면 그동안 국내의 논에서 발생한 제초제 저항성 잡초들은 주로 SU계 제초제 저항성 잡초였으며(Lee et al., 2013), 2014년 보고에서는 SU계 제초제 저항성 잡초인 피와 물달개비가 우점하였고, 그 다음으로 올방개 및 올챙이고랭이가 많이 발생한 것으로 나타났다(Ha et al., 2014). 1999년 SU계 제초제 저항성 물옥잠이 보고된(Park et al., 1999) 이래로 물달개비(Kwon et al., 2000), 미국외풀(Kuk et al., 2002), 마디꽃(Kuk et al., 2002), 알방동사니(Im et al., 2003), 올미(Im et al., 2005), 올챙이고랭이(Park et al., 2006), 올챙이자리(Kwon and Kuk, 2007), 새섬매자기(Park et al., 2009), 쇠털골(Kwon et al., 2009), 강피(Im, 2009; Lim et al., 2010) 및 벗풀(Park et al., 2013) 등의 SU계 저항성 논잡초가 발생한 것으로 보고되었으며, 그 수도 점차 증가하고 있는 실정이다(Lee et al., 2013; Lee et al., 2016). 올챙이고랭이는 건답이나 논, 수로 등에 분포하는 사초과의 잡초이며 근경으로 월동이 가능하지만 주로 종자 번식을 하는데, 2013년 실시한 조사 결과 우리나라 논에서 네 번째로 우점하는 것으로 나타났다(Lee et al., 2016). 한편 2018년에 보고된 전국의 논잡초 발생 조사 결과 물달개비, 논피, 물피 및 올챙이고랭이 등에서 ALS 저해 제초제에 대한 저항성이 광범위하게 발생한 것으로 나타났는데, 특히 올챙이고랭이는 경기 21.1% 및 강원 20.9% (Lim et al., 2018), 충북 29.0% (Lee et al., 2018a), 충남 10.8% (Won et al., 2018), 전북 46.3% (Choi et al., 2018), 전남 10.5% (Jeong et al., 2018), 경북 14.5% (Han et al., 2019), 경남 13.5% (Lee et al., 2018b) 순으로 발생하였다.
ALS 저해 제초제에 대한 작물과 광엽잡초간의 선택성은 감수성 잡초에 비해 내성 작물에서 이루어지는 제초제의 급속한 대사와 관련이 있다. 실제로 ALS를 저해하는 SU계 제초제는 한가지 이상의 효소시스템에 의해 제초제의 여러 부위가 공격을 받아 무독화 될 수 있는 것으로 알려져 있다(Beyer et al., 1987). 또한 ALS 저해 제초제를 연속적으로 사용한 농경지에서 발생한 다양한 종류의 잡초종들에서 나타난 저항성은 als 유전자의 돌연변이에 의해서 기인된 것으로 보고되었다(Reed et al., 1989). 우리나라에서 ALS 저해 제초제 저항성으로 보고된 올챙이고랭이(Ma et al., 2002), 물옥잠(Park et al., 2003) 및 물달개비(Park et al., 2007)의 경우에도 als의 돌연변이가 그 원인인 것으로 보고되었다. 본 연구와 관련된 선행연구에서 경남의 각 지역에서 발생한 올챙이고랭이는 ALS저해 제초제에 대한 저항성에 차이가 있는 것으로 나타났다(Lee et al., 2018b). 본 연구는 이와 관련하여 ALS저해 제초제에 대한 각 지역별 올챙이고랭이의 저항성 차이가 기존에 알려진 대로 als 유전자의 돌연변이에 의한 것인지 또는 비작용점 저항성(non-target site resistance, NTSR)을 야기하는 cytochrome P-450 monooxygenase (P-450)와 같은 제초제 대사와 관련된 효소에 의한 것인지를 구명하기 위하여 수행되었다.
재료 및 방법
실험재료
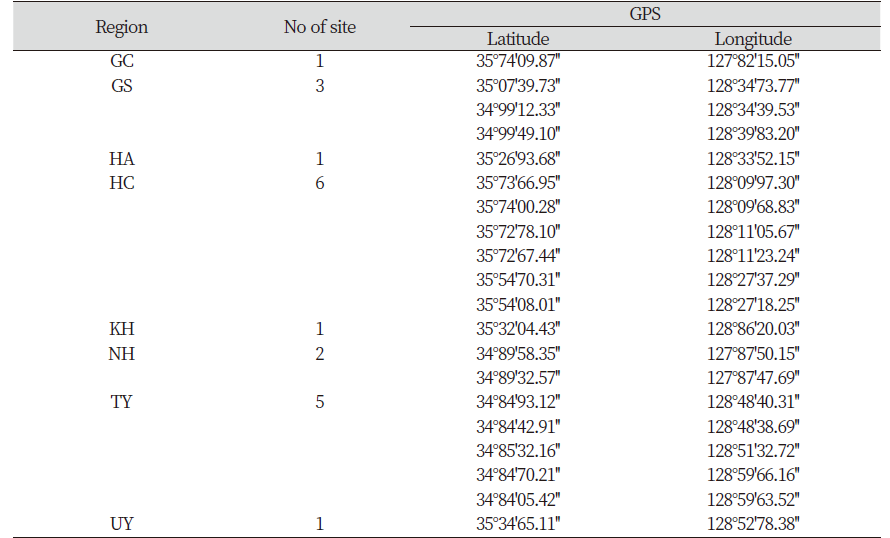
2017년 10월에 경남의 20개 지점의 논(거창 1, 고성 3, 함안 1, 합천 6, 김해 1, 남해 2, 통영 5 및 의령 1지점)에서 각각 완숙된 1개체씩의 올챙이고랭이로부터 종자를 수집하였다(Table 1). 올챙이고랭이 수집종들의 상대적인 저항성 정도를 평가하기 위해 사용된 SU계 제초제 감수성 수집종(HS)은 충남대학교 농업생명과학대학 식물자원학과로부터 제공받았다. 공시제초제는 ALS저해 제초제인 sulfonylurea (SU)계의 flucetosulfuron 50% 수화제 및 triazolopyrimidine계의 penoxsulam 3% 액상수화제를 사용하였다.
저항성 검정
채집된 올챙이고랭이 종자는 4℃에서 담수 상태로 1달간 보관하여 휴면을 타파하였다. 휴면 타파된 종자는 페트리디쉬에 치상하여 광 14시간(30℃)/암 10시간(25℃)의 인큐베이터에서 발아시켰다. 발아된 종자는 수도용 상토로 충진된 사각 폿트에 파종하여 초엽의 전개시까지 유리온실에서 생육시킨 후, 생육이 건전한 유묘를 선발하여 72공 트레이에 1홀 당 3개씩 이식하고 본엽이 4엽기에 도달하였을 때 공시약제를 경엽처리하였다. 유리온실의 생육조건은 평균일장 14시간, 최고기온 35℃ 및 최저기온 18℃였다. 공시제초제인 penoxsulam 및 flucetosulfuron은 표준량(1배)을 기준으로 하여 1/48 (0.625), 1/32 (0.9375), 1/16 (1.875), 1/8 (3.75), 1/4 (7.5), 1 (30), 8 (240), 16 (480), 32 (960) 및 64배(1920 g a.i. ha-1)의 농도 범위에 걸쳐서 살포하였다. 저항성의 평가를 위해 제초제 처리 15일 후에 지상부의 생체중을 측정하였으며, log-logistic model (Streibig, 1980)에 의한 비선형 회귀분석법으로 각 제초제에 대한 growth reduction (GR)50 값을 구하였다. 제초제에 대한 각 수집종의 상대적 저항성은 충남대의 감수성 수집종을 기준으로 평가하였다.
als 유전자 염기서열 분석
als 유전자 염기서열 분석은 감수성 수집종인 HS를 포함하여 고성28, 남해58, 함안135 및 통영238번 수집종을 대상으로 실시하였다. 발아된 유식물을 사각포트(가로 12세로 18높이 10 cm)에 파종하여 온실에서 4-5엽기까지 생육시킨 후에 약 0.1 g의 잎을 수확하고 DNeasy Plant Mini Kit (Qiagen, Valencia, USA)를 사용하여 DNA를 추출하였다. PCR을 위한 primer는 Genbank als1 및 als2 nucleotide 서열에 따라 2쌍을 이용하였다(Sada et al., 2012). PCR을 이용한 genomic DNA의 증폭 조건은 F1&R1 및 F2&R2 모두 초기 변성을 위해 95℃에서 3분을 경과한 후, 95℃에서 30초, 60℃에서 30초, 72℃에서 60초로 34번의 사이클을 반복하였으며, 최종 연장을 위해 72℃에서 5분간 경과하였다.
ALS 활성 측정
ALS의 활성은 penoxsulam에 대해 감수성인 통영238 및 저항성인 고성28번 수집종에서 측정되었다. 효소활성의 측정을 위해 발아된 올챙이고랭이 수집종의 유식물을 사각포트(가로 12세로 18높이 10 cm)에 이식하여 온실 조건에서 4엽기까지 생육 시킨 후 약 4 g씩 잎을 잘라 -80℃에 보관하였으며, 3반복으로 채취하였다. 채취한 올챙이고랭이 잎은 액체 질소를 이용하여 마쇄하고, 10% polyvinyl pyrrolidone (W/W) 및 extraction buffer (pH 7.5의 100 mmol L-1 K2HPO4, 10 mmol L-1 Na-pyruvate, 0.5 mmol L-1 MgCl2, 0.5 mmol L-1 thiamine pyrophosphate [TPP], 10 μmol L-1 flavin adenine dinucleotide [FAD], 1 mmol L-1 dithiothreitol [DTT]) 12 mL을 첨가한 후 균질화 하였다(Christopher et al., 1992; Hart et al., 1992). 균질액은 3겹의 miracloth (CALBIOCHEM®, San Diego, USA)로 여과하고, 4℃에서 20분동안 27,000 g로 원심분리 하였다. 상등액 6 mL를 동일한 부피의 100% 유안용액에 첨가하고 10분간 얼음에 정치한 후, 4℃에서 20분동안 27,000 g로 원심분리 하였다(Singh et al., 1988). 침전된 pellet을 reaction buffer (pH 7.5의 50 mmol L-1 HEPES, 200 mmol L-1 Na-pyruvate, 20 mmol L-1 MgCl2, 2 mmol L-1 TPP, 20 μmol L-1 FAD) 2.5 mL에 현탁하여 Sephadex G25 (Pharmacia PD-10®, Piscataway, USA) column으로 여과하였다. ALS 효소가 포함된 여과액 200 µL를 제초제 용액(penoxsulam 102, 101, 100, 10-1, 10-2, 10-3, 10-4 μmol L-1) 200 µL에 첨가하여 37℃에서 60분간 반응시켰다. 반응액에 6 N H2SO4 80 µL를 첨가하여 반응을 종료한 후 60℃에서 15분간 가열하여 acetolactate를 acetoin으로 전환시켰다. 전환된 acetoin에 0.55% creatine solution 380 µL와 5.5% α-naphthol solution 380 µL을 첨가하고 60℃에서 15분간 가열하여 발색반응을 유도하였다. 발색된 acetoin은 UV 분광광도계(UV-2501PC UV-VIS Recording Spectrophotometer, Shimazu, Kyoto, Japan)를 사용하여 530 nm에서 흡광도를 측정하였다. ALS의 활성은 acetoin을 이용하여 standard curve를 작성한 후(Watanabe, 2007), 올챙이고랭이 시료의 흡광도를 대입하여 계산하였다.
비특이적 저항성의 검정
각각의 올챙이고랭이 수집종의 건전한 유묘를 선발하여 72공 트레이에 이식하고 유리온실에서 생육시킨 후, 본엽이 4엽기에 도달하였을 때 p450 억제제인 fenitrothion을 2000 g a.i. ha-1로 경엽처리하였다. Fenitrothion 처리 24시간 후 penoxsulam 및 flucetosulfuron을 1 (30), 2 (60), 4 (120), 8 (240), 16 (480), 32 (960), 48 (1440) 및 64배(1920 g a.i. ha-1)의 농도 범위에 걸쳐 경엽처리하였다. 제초제 처리 2주 후에 지상부를 채취하여 85℃의 드라이 오븐에서 72시간 건조하여 건물중을 측정하였다. 각 제초제의 처리 농도별 건물중은 log-logistic model에 의한 비선형 회귀분석법으로 분석하였으며(Streibig, 1980), 제초제 농도에 따른 건물중의 변화를 계산하였다.
결과 및 고찰
Penoxsulam 및 flucetosulfuron에 대한 올챙이고랭이 수집종의 저항성 검정
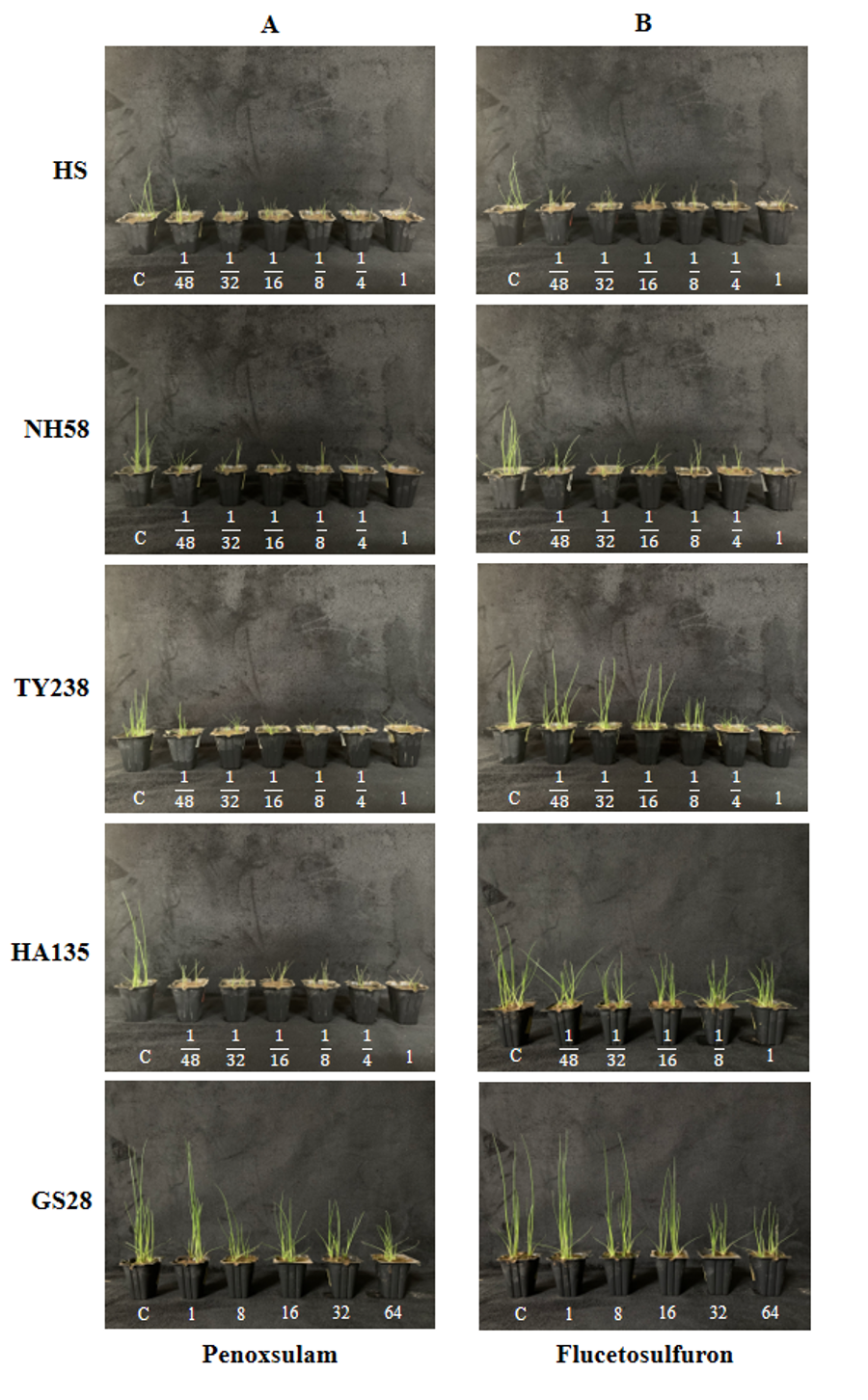
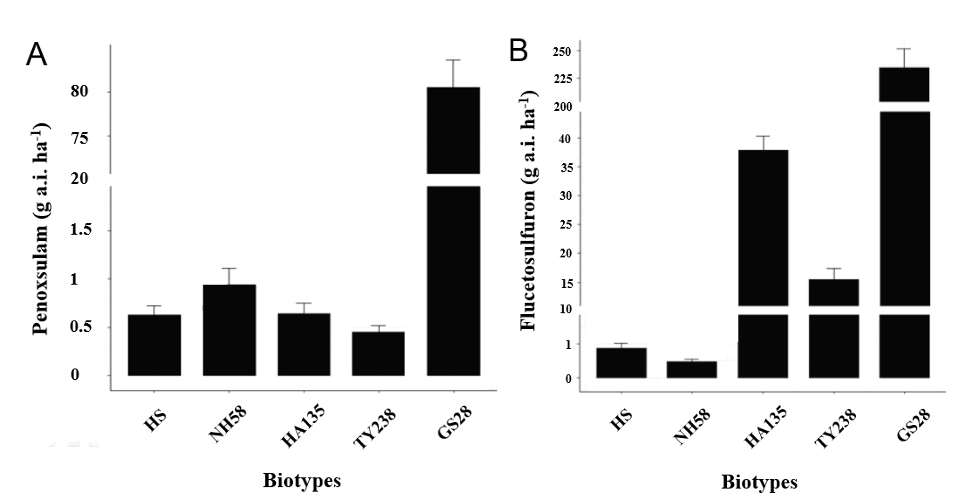
경남지역의 8개 시군에서 수집된 20개체의 올챙이고랭이 종자의 발아력과 penoxsulam 및 flucetosulfuron에 대한 감수성을 예비 검정한 결과, 발아력이 우수하고 약제에 대한 반응성이 일관되게 발현되는 충남대의 감수성 HS, 고성28, 남해58, 함양135 및 통영238번을 저항성 검정을 위한 시료로 선발하였다(자료 미제시). 온실에서 생육시킨 올챙이고랭이 수집종들에 대한 penoxsulam 및 flucetosulfuron에 대한 반응성을 검정한 결과, 남해58, 함안135 및 통영238번은 penoxsulam 표준량의 1/48 (0.63 g a.i. ha-1) 농도에서도 감수성인 HS와 유사하거나 더 심하게 생육이 억제되는 경향이었다(Fig. 1A). 그러나 고성28번은 표준량(30 g a.i. ha-1)에서 별다른 영향이 없었으며, 표준량의 64배 농도(1920 g a.i. ha-1)에서도 생육은 억제되었지만 고사하지 않았다. 한편 flucetosulfuron에 대해 남해58번은 표준량의 1/48 (0.63 g a.i. ha-1) 농도에서도 HS와 유사하게 생육이 억제되었으나, 함안135 및 통영238번은 다소간의 저항성을 나타내는 경향이었다(Fig. 1B). 그러나 고성28번은 표준량에서 별다른 영향을 받지 않았고, 64배 농도에서도 생육은 억제되었지만 식물체가 고사하지 않는 매우 높은 수준의 저항성을 나타내었다. Penoxsulam에 대한 GR50값은 남해58, 함안135 및 통영238번의 경우 HS (0.63 g a.i. ha-1)와 큰 차이가 없었으나, 고성28번은 80.2 g a.i. ha-1로 그 R/S ratio가 약 127.3배 더 높았다(Fig. 2A). 한편 flucetosulfuron에 대한 GR50값은 HS (0.87 g a.i. ha-1)에 비해 남해58번(0.47 g a.i. ha-1)은 큰 차이가 없었으나, 고성28번(234.5 g a.i. ha-1), 통영238번(15.5 g a.i. ha-1) 및 함안135번(37.8 g a.i. ha-1)은 높게 나타났으며 그 중에서도 고성28번의 R/S ratio는 약 269.5배로 현저하게 높은 경향이었다(Fig. 2B).
als 유전자의 염기서열 분석
ALS 저해형 제초제에 대한 저항성 잡초의 als 유전자는 F1 및 F3 primer 영역에서는 Ala122, Trp574, Ser653 및 Gly654에서(Riar et al., 2012), F2 primer 영역에서는 Pro197, Ala205, Asp376, Arg377에서 돌연변이가 발생하는 것으로 알려져 있다(Heap and Knight, 1982). 본 실험에서도 함안135 및 통영238번은 als 유전자의 Pro197이 Ser 및 Ala으로 각각 돌연변이된 것으로 나타났다(Table 2). 그런데 함안135 및 통영238번은 penoxsulam에 대해서는 감수성이었으나, flucetosulfuron에 대해서는 다소간의 저항성을 나타내었다. 이 사실은 올챙이고랭이의 경우 als 유전자의 Pro197의 위치에서 다른 아미노산으로의 돌연변이가 있는 경우 penoxsulam에 대해서는 여전히 감수성이나, flucetosulfuron에 대해서는 다소간의 저항성을 나타낼 수 있다는 것을 의미한다. 한편 고성28번 수집종은 als 유전자의 돌연변이가 발견되지 않았으나(Table 2), penoxsulam 및 flucetosulfuron에 대하여 매우 높은 저항성을 나타내었다(Fig. 1 and Fig. 2). 이 사실은 두 제초제에 대한 고성28번의 저항성이 als 유전자의 돌연변이에 의한 것이 아니고 NTSR에 의한 것임을 시사하였다.
ALS 활성에 대한 penoxsulam의 억제 효과
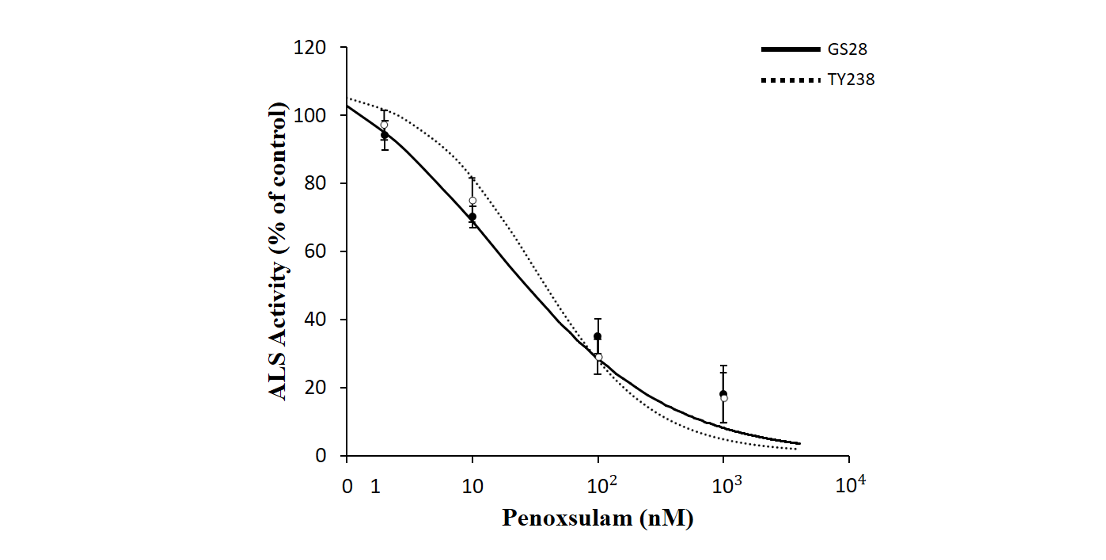
올챙이고랭이 수집종(고성28, 합천121 및 통영238번)의 in vitro ALS 활성에 대한 penoxsulam의 억제 효과를 조사한 결과, 생육실험에서 penoxsulam에 대해 강한 저항성을 나타낸 고성28번과 감수성인 합천121 및 통영238번 수집종들 간에 유의미한 차이는 없었다(Fig. 3). 이와 같은 결과는 고성28번의 저항성이 적어도 ALS 활성의 증가에 의한 결과는 아니라는 것을 시사한다.
Table 2. Amino acid sequence of Scirpus juncoides biotypes in the eight mutation sites of the als gene.
|
Flucetosulfuron 및 penoxsulam의 살초 효과에 대한 P450 inhibitor fenitrothion의 영향
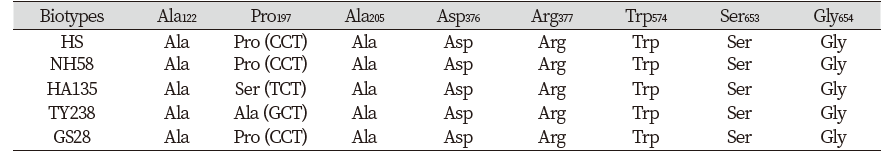
P450은 식물체 내의 제초제 대사에서 매우 중요한 역할을 하는 효소이다(Barrett, 1995). Fenitrothion과 같은 유기인계 살충제는 P450의 suicide subatrate로써 P450의 활성을 억제하여 세포 내로 유입된 제초제를 분해하지 못하게 한다(Berger and Sultatos, 1997). 위의 결과에서 고성28번 수집종의 ALS저해 제초제에 대한 고도의 저항성은 als 유전자의 돌연변이나 ALS 활성의 증가에 의한 것이 아니라는 사실이 밝혀졌다(Table 2; Fig. 3). 그런데 P450 inhibitor인 fenitrothion에 의해 ALS 저해제에 대한 고성28번의 저항성이 만약 감소된다면 그 원인은 P450에 의해 유래되었다고 할 수 있을 것이다. 그러한 가정 아래 고성28번 수집종에 fenitrothion을 선 처리한 후 penoxsulam 및 flucetosulfuron을 살포한 결과, 두 약제에 대한 고성28번 수집종의 저항성은 현저하게 감소하는 것으로 나타났다(Fig. 4). 지상부 건물중은 penoxsulam 단독 처리에 비해 penoxsulam+fenitrothion의 혼합 처리시 현저하게 감소되었으며(Fig. 5A), flucetosulfuron의 경우에도 단독처리에 비해 flucetosulfuron+fenitrothion의 혼합 처리시 건물중이 더 큰 폭으로 감소되었다(Fig. 5B). 이와 같은 현상은 고성28번 수집종에서 fenitrothion 처리에 의해 P450의 활성이 억제되며, 그에 따라 penoxsulam및 flucetosulfuron에 대한 비작용점 저항성이 원활하게 발휘되지 못한 결과에 기인하는 것으로 추정되었다. 따라서, 고성28번의 penoxsulam 및 flucetosulfuron에 대한 저항성은 비작용점 대사 효소인 P450 활성에 기인할 가능성이 있는 것으로 사료되었다. 추후 NTSR의 보다 정확한 원인 구명을 위해서 P450 및 GST와 같은 제초제의 대사에 관여하는 효소들의 활성을 조사할 필요성이 있는 것으로 판단되었다.
Fig. 4.Growth response of the GS28 biotype 14 days after penoxsulam (A) and flucetosulfuron (B) treatment. Fenitrothion was treated to the plants at 2,000 g a.i. ha-1 24 hours before penoxsulam and flucetosulfuron treatment. C: Control; 1: 30 g; 2: 60 g; 4: 120 g; 8: 240 g; 16: 480 g; 32: 960 g6;4: 1920 g a.i. ha-1.
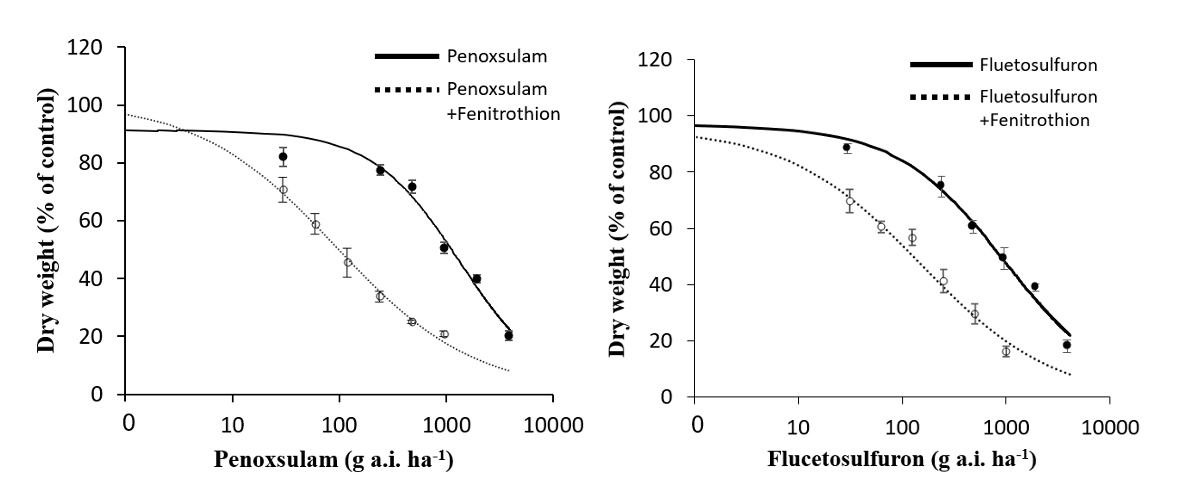
Fig. 5.Effects of fenitrothion and ALS inhibitors on the dry weight of GS28 biotype. Data were analyzed using the log-logistic equation. Vertical bars represent 95% confidence interval of the mean at each rate. Fenitrothion was treated to the plants at 2,000 g a.i. ha-1 24 hours before herbicide treatment.
요 약
본 연구는 경상남도 8개의 시군에서 수집한 20개의 올챙이고랭이 수집종의 ALS 저해 제초제에 대한 저항성 정도를 확인하고, 그 원인을 구명하기 위해 수행되었다. 여러 올챙이고랭이 수집종들 가운데 고성28번은 penoxsulam 및 flucetosulfuron에 대해 매우 높은 저항성을 나타냈다. als 유전자 염기서열 분석 결과 고성28번 수집종에서는 돌연변이가 발견되지 않았다. 또한, ALS의 in vitro 활성 측정 결과, 고성28번은 penoxsulam에 대해 감수성을 나타낸 통영238번과 큰 차이가 없었다. 한편 고성28번에 대하여 P450 inhibitor인 fenitrothion의 전처리 시 penoxsulam과 flucetosulfuron에 대한 감수성이 현저하게 증가하였다. 상기의 결과로부터 ALS 저해 제초제에 대한 고성28번의 저항성은 als의 돌연변이나 효소활성의 증가에 의한 것이 아니고, P450의 NTSR에 의한 것으로 사료되었다. 한편 flucetosulfuron에 대한 함안135 및 통영238번의 낮은 저항성은 als 유전자의 Pro197이 Ser 및 Ala으로 돌연변이된 것에 기인하는 것으로 판단되었다. 상기의 연구는 ALS저해형 제초제에 대한 올챙이고랭이의 비작용점 저항성과 관련된 최초의 보고이며, 올챙이고랭이의 제초제 저항성 관련 연구를 위한 중요한 참고자료로 활용될 수 있을 것이다.
주요어: 비작용점 저항성, 싸이토크롬 P-450 일산화효소, 올챙이고랭이, 점돌연변이, ALS 저해제
Acknowledgements
This study was carried out with the support of Research project in Rural Development Administration (Project No. PJ01245708), Republic of Korea.
Authors Information
Soo Yong Shim, Division of Applied Life Science (BK21 Plus), Gyeongsang National University, Master
Sung Hwan Choi, Department of Horticulture, Gyeongnam National University of Science and Technology, Professor
Jae Ho Kim, Department of Plant Medicine, Gyeongsang National University, Master student
Jung-Sung Chung, Department of Agricultural Plant Science, Gyeongsang National University, Professor
WeiQiang Jia, Department of Crop Science, Chungnam National University, Ph. D.
Kee Woong Park, Department of Crop Science, Chungnam National University, Professor
Jeung Joo Lee, Department of Plant Medicine, Gyeongsang National University, Professor