서언
우리나라 식물은 남북한을 합쳐서 4,000여 종이 된다. 이것은 변종과 품종 등을 모두 포함한 것이며, 학술적으로 의미있는 종만을 따진다면 3,000여 종 남짓이 된다(NIBR, 2023). 그중 10% 내외가 외국에서 들어온 외래식물이다(Kil and Kim, 2014). 외래식물을 포함한 우리 주변에서 서식하고 있는 식물은 다양한 용도로 사용되고 있다. 즉 식용, 사료용, 약용, 관상용, 사방용 등이 그것이다. 특히 정원, 공원, 식물원, 고속도로변, 도로 절개지 등에 사용하고자 다양한 종류의 식물을 외국으로부터 들여오고 있는데 이러한 관상식물의 도입은 외래식물의 주요한 이동경로로 인식되고 있다. 국내에 보고된 귀화식물 309종 중 106종(34.3%)이 관상용으로 활용되고 있다(Kil and Kim, 2014). Kim and Kil (2016)은 양미역취(Solidago altissima L.)는 1970년 이전에 우리나라에 도입된 이후 남부지역을 중심으로 급속히 확산되었다고 하였다.
양미역취는 북미 원산의 국화과 미역취속(Genus Solidago)에 속하는 여러해살이풀로 일반적으로 경지 주변, 길가, 주택지의 빈터, 교반된 땅, 하천부지, 제방, 묵힌 밭, 그리고 황무지 등에서 생육한다(Kim and Park, 2009; ME and NIE, 2021). 특히 전라남도 순천 등을 비롯한 남부지방에 널리 퍼져 있다(Park et al., 2011). 양미역취는 개체가 크고 고밀도로 생육하여 다른 식물이 들어설 수 있는 공간을 제한하고 타감물질을 생산하여 종 다양성을 억제하는 등의 문제를 유발시켜 환경부에서 생태계를 교란하는 식물로 2008년에 지정하였다(KLIC, 2023). 우리나라에서 미역취속으로는 미역취(Solidago virgaurea subsp. asiatica Kitam. ex Hara), 양미역취, 미국미역취(S. serotina Aiton) 등이 있는데 그 중 확산이 빠른 것 중의 하나가 양미역취이다(Kim and Park, 2009). 그러므로 우리나라 남부지역에서 다른 지역으로 확산 중인 양미역취의 분포와 형태, 생리·생태적 특성, 피해양상 및 관리방법 등을 제시하여 효율적으로 관리할 수 있는 기초자료를 제공하고자 한다.
양미역취의 분포와 확산
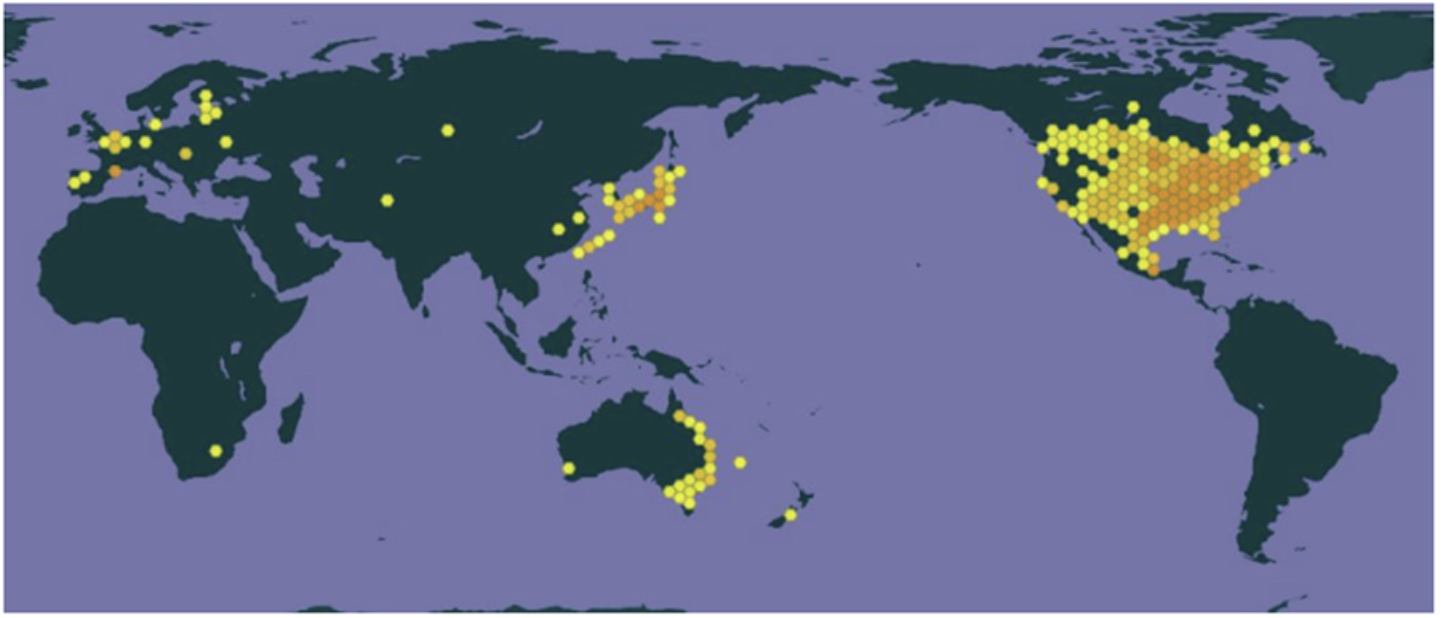
양미역취의 원산지는 미국 본토와 캐나다 인접 지역이다. 미국에서는 노스다코타부터 플로리다, 텍사스, 애리조나까지 발생한다. 캐나다에서는 노바스코샤에서 온타리오까지 발생하며, 경도 98° 동쪽 지역에 국한되어 있다. 양미역취는 유럽 이외에 호주, 일본, 뉴질랜드, 대만 및 시베리아에도 귀화되었다(Weber, 2000; Walck et al., 2001; Fig. 1). 북미지역에서 양미역취가 지리적으로 널리 퍼진 이유는 다른 미역취(S. shortii)보다 더 큰 키, 더 넓은 잎 면적 및 더 광범위한 클론 성장을 통해 더 경쟁적으로 확산하였기 때문이다. 또 양미역취는 종자 생산량이 더 많고, 토양 속에서 오랫동안 생존할 수 있는 능력이 높기 때문이다(Walck et al., 2008a).
양미역취 원산지인 미국 중부지역(12° N∼25° N)과 일본 발생지역(43° N∼26° N)에서 샘플링된 두 집단 간의 표현형 변이 패턴을 비교한 결과, 초장, 잎 수, 잎 길이, 잎 너비, 줄기 직경 및 기공 보호 세포 크기에 차이가 있었다(Etterson et al., 2008). 이는 양미역취가 다른 기후대로 발생하면 그 지역 조건에 맞게 진화한다는 것을 설명하고 있다.
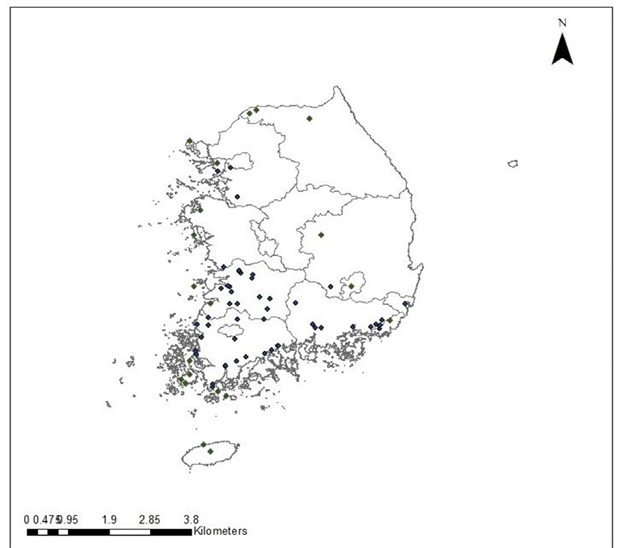
양미역취는 우리나라에는 1969년 전남 보성에서 처음 발견되었다(Kim and Kil, 2016; NIE, 2022; CABI, 2023). 양봉농가에서 밀원식물로 재배하던 중 자연생태계에 유출된 것으로 추정된다(NIE, 2022). 양미역취는 우리나라의 남부지방(Kim and Park, 2009) 뿐만 아니라 이미 여러 지역에서 발생하고 있다(Fig. 2). 태안해안국립공원(Lim et al., 2010), 영산강 하류(Kim et al., 2019), 무등산국립공원 담양 지구(Lee et al., 2021)에서 양미역취를 포함한 여러 생태계교란 식물이 발생하고 있다. 저자들이 확인한 바에 의하면, 부산광역시의 낙동강변에 위치한 여러 개의 생태공원(맥도생태공원, 삼락습지생태공원, 대저생태공원 등)에도 군락을 이루고 있었다. 또 하천 정비사업 이후에는 동진강과 만경강 일대에 대규모 군락이 형성되었다(ME and NIE, 2021).
우리나라 중부지방에는 현재까지 대규모로 발생한 곳은 없으나, 강원 철원까지 양미역취가 출현하고 캐나다와 시베리아에도 분포하는 것으로 보아 우리나라 전역에 발생할 가능성이 있다(ME and NIE, 2021). Park et al. (2020)은 우리나라에서 양미역취의 기후변화에 따라 SSP585 시나리오에 의해 확산을 예측한 결과, 현재 양미역취 생육에 적합한 서식지 면적이 16,255 km2 (대한민국의 16.2%)에서 44,551 km2 (44.4%)로 증가할 것이라고 하였다. 일반적으로 양미역취는 잘 관리된 농경지에는 발생하지 않는다. 그러나 일부 밭에서 발생하였다는 보고가 있다(Kim et al., 2020). 이는 휴경지일 가능성이 높다. 농작물을 재배하고 관리하는 밭은 매년 경운을 하여 다년생인 양미역취 발생이 쉽지 않기 때문이다.
일본은 우리나라보다 앞선 1900년에 침입·정착하였다(APASD, 2023; NIBR, 2023). 유럽에서 양미역취는 17~18세기에 장식용으로 쓰이기 위해 북미에서 도입되었다. 처음에는 식물원에서 재배되다가 매력적이고 키우기 쉬워 정원사들이 널리 사용하여 전 유럽으로 확산되었다. 1850년경 양미역취는 중부 유럽에서도 확인되었는데, 이는 인간에 의한 분산과 적합한 장소에서는 군집화되어 빠르게 확산되었기 때문이다. 현재 양미역취는 중부 유럽이 발생 중심지이지만, 스칸디나비아 남부에서 이탈리아 북부(위도 46˚~61˚)까지 존재한다(Weber, 2000). 벨기에가 양미역취를 처음 도입(침입)한 나라이다(Verloove et al., 2017).
형태적 특성
양미역취의 줄기는 높이 1∼2.5 m이고 전체에 연한 털과 길고 거친 털이 있다. 잎은 호생(互生, growing in alternation)하며, 촘촘히 달린다. 잎몸은 피침형(披針形, lanceolate)으로 양 끝이 뾰족하고 윗부분에 작은 톱니가 있다(Fig. 3A and 3B). 잎의 길이는 3∼10 ㎝, 폭은 3∼14 ㎜이다. 줄기 아래에 달리는 잎은 짧은 잎자루가 있으나, 위로 갈수록 잎자루는 거의 없다. 꽃은 9∼10월에 피며, 옆으로 펴지거나 아래를 향해 굽은 가지에 머리모양꽃 여러 개가 한쪽으로 치우쳐 달리며 원추꽃차례(圓錐花序, panicle)를 이룬다(Fig. 3C; Kim and Park, 2009; Park, 2009; NIBR, 2023). 하나의 양미역취는 큰 원추형 배열로 1,500개의 작은 노란색 꽃 머리를 생산할 수 있으나, 한 개체의 꽃가루가 같은 식물체의 암꽃 부분에 날라가 수분할 수 없다(ALA, 2023). 모인꽃싸개(總苞, involucre)는 원통형, 꽃싸개(總苞片, involucral scale)는 선형으로 3줄로 붙는다. 혀모양꽃(舌狀花, ligulate flower)은 암꽃이며, 암술머리 끝이 2갈래로 갈라지고 화관 밖으로 길게 나온다. 통모양꽃(筒狀花, tubular flower)은 양성이다. 열매는 수과(achene)이고, 관모(pappus)는 흰색이고 수과 길이의 3배다(Kim and Park, 2009; Park, 2009; NIBR, 2023).
양미역취의 외부 형태는 미국미역취와 비슷하다. 미국미역취는 7~8월에 개화하는 반면에, 양미역취는 9~10월에 개화한다. 양미역취 줄기에는 털이 많고 잎 가장자리에 톱니가 뚜렷한 반면에, 미국미역취는 줄기와 잎에 털이 거의 없다(ME and NIE, 2021).
생리·생태적 특성
발아특성
양미역취는 관모가 있는 종자와 신장력이 강력한 지하경으로 번식한다. 종자에서 발생한 개체는 먼저 잎과 뿌리의 생장에 중점을 두며, 그 다음에 줄기, 꽃 그리고 지하경의 생장으로 이어진다. 새로운 곳으로의 침입은 주로 종자로 한다(Kim and Park, 2009). 양미역취 종자는 예취하지 않은 상태에서는 연간 1평방미터당 49,000개, 예취 곳에서는 연간 1평방미터당 1,800개를 생산한다(Meyer and Schmid, 1999b). 토양에서 양미역취 종자의 생존율과 발아율은 주변 식생에 의한 많이 좌우된다. 식생이 안정되면 양미역취 종자의 발아는 매우 낮았지는데 150,000개의 종자 중 12개(0.008%)만이 유묘로 성장하였다. 그리고 양미역취 종자는 1꽃 당 약 20,000개를 생산하는데 이 중 80∼90%가 외부로 분산된다(Meyer and Schmid, 1999b).
양미역취 종자의 최적 발아온도는 30/15℃(주/야)이다(Kim et al., 2023). 미역취속 중 하나인 S. canadensis L.의 발아 적온이 25∼30℃라는 것과 유사하다(Douglas and Hoffman, 1999). 그리고 발생특성이 상이한 미역취속 3종(양미역취, S. nemoralis Aiton, S. shortii)의 종자를 비교한 결과, 좁은 지역에서 생육하는 S. shortii의 종자는 0.370 ㎎인 반면에, 광범위하게 퍼져있는 양미역취(0.070 ㎎)와 S. nemoralis (0.068 ㎎)의 종자는 상대적으로 작았다(Walck et al., 2008a). 또 양미역취와 S. nemoralis의 갓 숙성된 종자를 어두운 곳에서 방치하면 0~4% 발아한 반면에, 어두운 곳에서 12주 동안 저온 성층처리하면 0~28%로 발아율이 높았다(Walck et al., 2008a). 그리고 이들 미역취속 3종의 종자를 자연상태 온실의 흙 속에서 일정기간(4.3년) 매장하면 3종 모두 일부만 발아하였지만(21~60%), 빛이 있는 30/15°C(주/야) 조건에서 2주 동안 처리하면 75~100%까지 발아율이 증가하였다(Walck et al., 2008b).
생육특성
양미역취의 새로운 지하경의 형성은 초여름 무렵부터 시작되어 늦가을과 초겨울 동안에 새싹이 나와 로제트를 형성하는데 월동하는 동안에도 로제트의 수는 증가한다. 지하경은 지표 밑 5∼9 ㎝ 깊이의 토층에 대부분 분포한다. 양미역취의 지하경은 재생력이 강하여 깊이 30 ㎝ 깊이의 토층에서도 출아할 수 있다(Fig. 3D). 한 해 동안에 야외에서 양미역취의 지하경은 길이는 4.1 m, 생체중은 131.9 g, 그 지하경 수는 9.9개로 번식한다(Kim and Park, 2009).
양미역취의 새로운 지하경의 형성은 초여름 무렵부터 시작되어 늦가을과 초겨울 동안에 새싹이 나와 로제트를 형성하는데 월동하는 동안에도 로제트의 수는 증가한다. 지하경은 지표 밑 5∼9 ㎝ 깊이의 토층에 대부분 분포한다. 양미역취의 지하경은 재생력이 강하여 깊이 30 ㎝ 깊이의 토층에서도 출아할 수 있다(Fig. 3D). 한 해 동안에 야외에서 양미역취의 지하경은 길이는 4.1 m, 생체중은 131.9 g, 그 지하경 수는 9.9개로 번식한다(Kim and Park, 2009).
위해성 및 피해
관리방안
타감작용
양미역취가 침입 외래종으로 성공할 수 있는 전략은 지하경 덩어리(클론)의 확장과 경쟁자의 생육을 억제시키는 타감작용이 일어나는 대규모 지하 뿌리줄기 시스템이다(Robert et al., 2010). 양미역취의 뿌리에서는 terpenes, flavonoids, polyacetylene, phenols 등과 같은 allelochemicals을 분비하는데 이 물질들은 양미역취의 추출물, 에센셜 오일 및 근권 토양에서도 확인되었다(Sawabe et al., 1999). 확인된 양미역취의 타감물질 중 cis-dehydromatricaria ester (cis-DME)가 주변 식생의 성장 억제 활성 등과 같은 타감작용에 관여한다(Kim and Park, 2009; Kato-Noguchi and Kato, 2022; Nishidono and Tanaka, 2022; APASD, 2023). Gam et al. (2022)은 양미역취 뿌리 분말과 흙을 혼합한 in vitro seed bioassay한 결과, 목초 두 종(Trifolium repens L., Festuca arundinacea von Schreber)의 성장을 억제하는 것을 확인하였다.
양미역취에서 추출한 폴리아세틸렌 화합물인 cis-DME에 대한 타감작용을 서로 다른 토양조건(sandy loam, light clay)에서 확인한 결과, cis-DME의 식물 독성 활동은 토양의 흡착 및 분해 활동을 통해 영향을 받는 토양수 내 농도에 따라 달라진다. 그런데 잠정적으로 양미역취에서 방출된 cis-DME는 자연 생태계의 대부분의 토양에서 경쟁식물에 대한 타감작용 활성을 거의 일으키지 않는다는 하여 상반된 의견도 있다(Kobayashi et al., 2004). 또 양미역취 체내에는 cis-DME가 고농도로 함유(지하부의 경우 390 ㎎ ㎏-1)되어 있음에도 식물체내에서 물을 매개로 하는 용탈은 거의 없다. 이는 물의 화학적 성질이 극성이 낮으며 물에 잘 용해되지 않는 특성 때문이라고 하였다. 따라서 양미역취가 생육했던 뒷자리의 토양 중에는 cis-DME의 존재량은 6 ppm으로 비교적 적은 양이라는 보고도 있다(Kim and Park, 2009).
다른 피해
미역취속에는 세계적으로 100∼120종이 있는데 우리나라에는 미국미역취, 울릉미역취[Solidago virgaurea subsp. giga ntea (Nakai) Kitam.], 양미역취 등 6종이 생육한다. 미역취속은 8∼10월에 노란색 꽃이 피며, 주로 충매화이나 많은 양의 꽃가루가 바람에 날려 알레르기성 꽃가루병의 원인이 된다고 하였다(Hong, 2015). 그러나 양미역취는 꽃가루 알레르기와는 무관하다(ME and NIE, 2021)는 상반된 견해도 있다. 이것은 양미역취 개화시기가 돼지풀과 유사하기 때문에 일어난 혼란으로 사료된다.
양미역취는 초식동물에 대한 방어 수단으로 cysteine, serine과 같은 프로테아제 억제제(protease inhibitors)를 생산한다. 이 프로테아제 억제제는 초식동물의 소화계통에 부정적인 영향을 미쳐 섭식를 기피하는 등 효과적인 저항 수단이 될 수 있다. 이러한 억제제는 개체군마다, 포식자의 많고 적음에 따라 생산되는 정도가 다르다(ALA, 2023). 실제 양미역취에 함유된 프로테아제 억제제로 인해 사슴(Cervus nippon Temminck)이 양미역취를 뜯어먹으면 소화불량이 발생하여 싫어한다(TWF, 2023).
이용
양미역취는 원산지인 북미지역에서는 다양하게 이용되고 있다(UTP, 2023). 먼저, 양미역취의 어린잎과 꽃을 이용하여 차(tea)로 마시면 위장병이 치료될 수 있다. 다음은 양미역취 전체를 방부제(antiseptic), 지혈제(haemostatic), 연고제(salve) 및 지혈제(styptic)로 이용될 수 있고, 꽃으로 만든 습포제(poultice)는 궤양(ulcers)과 화상(burns) 치료에, 축축하게 으깬 뿌리는 종기(boils) 치료에 사용된다. 그리고 잎에 함유된 라텍스는 잠재적으로 좋은 고무의 공급원(고무함량 6.34%)이 될 수 있고, 겨자색, 오렌지색, 갈색을 내는 염료는 식물 전체에서 얻을 수 있다. 그리고 양미역취를 정원에 재배할 경우 무당벌레(Harmonia axyridis Pallas), 풀잠자리(Chrysopa intima MacLachlan), 꽃등에(Chalcosyrphus atra Curran) 등과 같은 다양한 유익한 곤충을 유인하여 해충을 방제하는 데 도움이 된다(UTP, 2023). 그리고 양미역취의 꽃은 양봉가의 밀원용으로 이용되나 채밀량 등에서는 알려진 바 없다(Kim and Park, 2009).
양미역취는 식물 정화 능력이 있어 중금속으로 오염된 지역의 토양을 정화 및 제거하는데 이용할 가능성이 있다(Lee, 2020). 그리고 양미역취의 꽃에는 다른 침입 외래식물(서양금혼초, Hypochaerus radicata L.)보다 항산화 능력이 높아 항산화제 개발에 이용할 수 있다. 이같이 양미역취의 꽃에 대한 활용도가 높아지면 꽃 채집량이 늘어나 양미역취의 발생 및 확산이 억제될 수 있다(Lee, 2020).
예방적 관리
하천변에 생육하는 양미역취의 꽃가루는 바람을 이용해 하류 방향으로 수백 미터까지 번져 나가므로 조기 확산방지를 위해 초기 생육단계에서 제거하는 것이 바람직한 관리방법이다(ME and NIE, 2021).
경종적 관리
양미역경취는 농경지에 발생하는 경우가 드물어 경종적 관리방안은 전무하다.
물리적 관리
양미역취를 물리적으로 적절하게 관리 또는 제거하는 방법으로는 예취(mowing), 경운(soil rotation), 대체식물 식재 등이 있다. Weber (2000)는 1회 예취할 때 10% 감소하던 양미역취의 피복도가 2번 예취하면 60%까지 감소되며, 예취하고 경운하면 94% 감소된다고 하였다. Meyer and Schmid (1999a; 1999b)는 5년간 규칙적으로 양미역취를 예취하면 종자와 새싹의 생산을 감소시켜 이들 개체군이 확산되는 것을 방지할 수 있는데 그 예취시기는 늦여름이 좋다고 하였다. 즉 기존 개체군의 종자 공급을 줄여 새로운 장소의 식민지화를 방지할 수 있다는 것이다. Park et al. (2011)은 순천시에 넓게 퍼진 양미역취를 결실기 이전에 밑둥치를 제거한 후 주변 갈대밭 환경과 조화되는 억새 등의 자생식물 식재를 통한 생육 억제 등의 관리방안을 제시하였다. 양미역취는 예취 횟수에 따라 생장량의 유의적 감소되어 발생을 줄일 수 있다(Lee, 2020)는 보고와 같다. 그리고 Rim et al. (2023)도 예취가 양미역취를 친환경적으로 관리할 수 있는 방법이라고 하였다.
국립생태원에서도 양미역취는 땅속뿌리로 번식하므로 뿌리째 제거하는 것이 효과적이며, 뿌리를 제거할 때는 표토 교란을 최소화하고 반경 50 cm 이내 잔여 뿌리가 있는지 확인하고 모두 제거하여야 한다고 하였다(NIE, 2022). 제거시기는 개화기 이전 식별이 가능한 5∼8월에 집중적으로 제거하고 이듬해 발생하는 어린 개체들은 5월 전후에 뿌리째 제거하는 것이 효과적이다(NIE, 2022).
그러나 양미역취 제거시 지나치게 표토를 교란하면 다른 외래식물의 침입이 용이하므로 생육조건에 적합한 대체식물을 식재하는 방안이 검토되어야 한다(ME and NIE, 2021). 양미역취가 우점한 지역에서 양미역취를 제거한 후 대체식물로 밭벼를 재배하는 예비시험이 진행되었다. 이때 대체식물로 밭벼를 선정한 이유는 넓은 범위에 적용할 수 있게 구하기 쉽고, 값이 저렴한 작물 중에서 비교적 물관리가 쉽기 때문이다. 경운 후 대체식물인 밭벼를 파종한 결과, 파종량에 따라 양미역취의 발생을 억제하여 확산방지책의 일환으로 그 가능성이 확인되었다(ME and KEITI, 2022). 향후에는 대체식물로 밭벼를 재배하였을 경우 수반되는 다른 문제점이 없는지 확인이 필요하고, 밭벼이외 다른 대체작물을 선발하는 연구가 필요하다.
일본 지바현의 보소반도(Boso Peninsula) 해안에서 염수 분무(salt spray)가 양미역취 생육에 미치는 영향을 조사한 결과, 내륙 지역의 양미역취 유묘는 건전하게 생육하는 반면에 해변에서 발아한 양미역취 유묘는 95%이상 죽었다. 이런 결과에서 간헐적으로 바다에서 불어오는 염수 분무가 해안의 양미역취를 제거하는 가장 중요한 환경 요인 중 하나이다(Yura, 2018). 이런 결과를 실제 부산광역시 낙동강변의 대저생태공원에 발생하는 양미역취를 대상으로 염수(바닷물)를 처리하였다(2022년 10월, ME and KEITI, 2022). 그 결과 염수(바닷물)의 살포량에 따라 시듦 현상과 함께 잎끝이 말라가는 증상이 관찰되었다. 염수(바닷물) 처리가 토양의 전기전도도(electrical conductivity, EC) 변화와 이듬해 양미역취 최아 및 종자발아에 미치는 영향을 확인한 후 실용상 이용이 가능하다면 양미역취 확산 억제를 위한 하나의 방법으로 적용될 수 있을 것이다.
화학적 관리
화학적 관리는 제초제를 이용하여 양미역취의 발생과 확산을 억제하는 것이다. 양미역취는 종자와 지하경으로 번식하지만, 주로 지하경으로 발생되는 개체가 확산이 빠르다. 그러므로 지하경까지 제초성분이 흡수 이행되어 식물체 전체를 고사시키는 것이 중요하다. 양미역취에 대한 화학적 방제에는 경엽처리용 제초제 4종(벤타존 액제, 글리포세이트이소프로필아민 액제, 트리클로피르티이에이 액제, 디캄바 액제)을 대상으로 온실조건에서 시험하였다(ME and KEITI, 2022). 약제처리 30일 후(각각 기준량 살포), 트리클로피르티이에이 액제 > 글리포세이트이소프로필아민 액제 > 디캄바 액제 > 벤타존 액제 순으로 방제효과를 보였다. 양미역취 군락에 글리포세이트이소프로필아민 액제를 기준량(300 ㎖ 10a-1)으로 경엽처리한 결과, 30일까지 100% 방제되어 화학적 관리 가능성을 확인하였다(ME and KEITI, 2022). 그러나 제초제 처리에 대한 부정적인 시각이 상존하고 있어 실제 사용에는 제한적이다.
생물학적 관리
양미역취의 생물학적 방제원(agent)이 개발되어 활용된 사례는 지금까지 보고되지 않았다. 원산지에서는 몇몇 미역취 속에 대한 협식성 곤충에 의한 가해들은 보고되었다(Cappccinoo, 2000). 하지만 외래식물로 도입된 유럽에서는 초식성 동물에 의한 피해는 적으나 달팽이(Acusta despecta sieboldiana Pfeiffer)와 작은 설치류(Rodentia)에 의한 줄기와 잎의 피해들이 나타났다(Podroužková et al., 2015; Shaw et al., 2018).
스위스에서는 18종의 양미역취 섭식 곤충을 발견하였으나 대부분이 광식성으로 나타났다(Jobin et al., 1996; Weber, 2000). 우리나라 양미역취의 가해 곤충과 병에 대해서는 해바라기방패벌레[Corythucha marmorata (Uhler) (Hemiptera: Tingidae)]와 흰가루병[Podosphaera ieucotricha (Ell .et. Ev.) Salmon]이 보고된 바 있다(Kim and Kil, 2014; Hong et al., 2016).
양미역취에 대한 생물방제원으로서 토착 병원균과 곤충을 이용하는 몇몇 연구들이 보고되었다. 식물과 곤충간의 상호작용을 이용하는 연구 중의 하나로 Helms et al. (2012)은 양미역취에서 발산하는 냄새에 민감하게 반응하는 Eurosta solidaginis Fitch의 암수에 따라 양미역취를 가해하는 정도가 다르다고 하였다. 또한 중국에서는 미역취속의 하나인 S. canadensis를 기계적으로 제어(절단 및 괭이질)한 후 토착 병원균인 Sclerotium rolfsii SC64를 접종하여 S. canadensis를 방제하는 연구도 있다(Tang et al., 2013). 향후 우리나라의 생물학적 방제의 도입을 위해서는 국내 발생 양미역취의 가해 곤충과 병에 대한 지속적인 조사와 함께 국내 미역취속 자생식물에 대한 기주 특이성 시험 등을 통한 방제원 선발 연구가 필요하다.
종합관리방안 및 고찰
Park et al. (2011)은 주요 서식지별 특성을 시・군 읍지역, 국립공원지역 등 6개 지역으로 구분하고 각 분포지역의 생태적 특성을 비교한 후 귀화식물 관리방안을 제시하였다. 즉 해당 지방자치단체는 분포하는 귀화식물을 주기적으로 파악하고, 직접 제거하는 물리적 방법을 이용하거나 휴경지 등의 집단 분포지를 중심으로 자생식물을 식재하여 관리방안을 수립하는 것이 바람직하다고 하였다. 그리고 Kim et al. (2019)의 양미역취 관리방안을 환경부의 현장관리 매뉴얼과 비교하면서 현장적용 관리방안을 제시하였다. 현장적용 관리방안은 ➀ 교란식물의 실태를 조사하여 관리대장을 마련하는 것, ➁ 인력에 의한 제초작업을 실시하고, ➂ 대규모로 발생한 경우는 장비를 동원하여 토양 깊이까지 제거하면서 뿌리 제거 후 복원계획을 수립하고, ➃ 복원할 수 있는 자생식물을 이식하는 것이다. 이 때 제거 작업은 관리하고자 하는 식물이 개화 후 종자 결실 전(8월)에 집중적으로 이루어져야 한다. 또 Lee et al. (2021)은 양미역취를 비롯한 생태계교란 식물의 장기적인 관리방안을 4가지를 제시하였다. 첫째는 생태계교란 식물에 대한 모니터링 및 관리체계를 구축하고 생육 초기에 물리적으로 제거하는 것이고, 두 번째는 대시민 홍보 활성화 및 분기별 시민, 민간단체, 군(軍)부대 제거행사 참여를 활성화하는 것이고, 세 번째는 악조건에서도 잘 생육하는 억새 등 대체식물 식재이고, 네 번째는 지역사회 영세 및 청년 업체에서 청정 국립공원에서 생산된 생태계교란 식물을 활용할 수 있는 산업을 육성하는 것이라고 하였다.
따라서 양미역취를 포함한 생태계교란 식물을 종합적으로 관리하는 방안은 발생지역 및 발생정도에 따라 다르게 적용되어야 한다. 첫번째로는 양미역취가 도로변이나 제방 등 비농경지에 발생하는 경우이다. 여기에 발생된 양미역취는 개화 후 종자가 여러 이동수단에 의해 다른 곳으로 확산이 빨리 진행될 수 있으므로 여러 번 예취하여 개화를 억제하여야 한다. 경우에 따라서는 이행성 제초제를 살포하여 방제할 수 있다. 두 번째는 하천변 공원 등과 같이 하천을 끼고 발생하는 경우이다. 이런 곳은 도시민들이 쉽게 접근할 수 있는 곳으로 양미역취 등과 같은 생태계교란 식물의 발생 및 관리방법 등에 대한 홍보를 병행하면서 효율적으로 관리하여야 한다. 즉, 지역주민 또는 단체를 대상으로 양미역취 등의 생태계교란 식물의 식별, 제거방법 등을 전문가들의 교육을 병행하여 경각심을 고취하고 공동으로 제거작업을 하는 것이다. 이때 제거방법으로는 예취가 있다. 다만, 양미역취는 손으로 제거하는 것이 쉽지 않기 때문에 예초기를 이용하는 것은 전문가들이 수행하여야 한다. 예취 후에는 경운하고 대체작물(밭벼, 갈대, 억새 등)을 식재하여 발생을 최소화시키는 방법이다. 마지막으로 대규모 군락지에는 그 관리방안이 거의 없다. 넓은 면적에 제초제를 살포할 수는 없지만 제한적으로 이행성 경엽처리형 제초제를 살포하는 방법도 고려될 수 있다. 제초제를 살포할 때에는 도시민 뿐만 아니라 시민단체 등과 협의되어야 한다. 또 경우에 따라서는 염수(바닷물)을 처리하는 방법도 있다.
요약
양미역취는 북미지방이 원산지인 국화과 여러해살이풀로 우리나라에서는 타감물질을 분비하여 종 다양성을 억제하는 등의 문제로 2008년에 생태계교란 식물로 지정되어 관리하고 있다. 양미역취는 일반적으로 경지 주변, 길가, 묵힌 밭, 제방 그리고 황무지 등에서 생육한다. 양미역취는 전 세계적으로는 원산지인 북미에는 널리 퍼져 있고, 유럽, 아시아 및 호주에 귀화되었다. 우리나라에서는 순천, 김제, 부산 등 남부지방에서 점차 중부지방으로 확산되고 있다. 양미역취는 관모가 있는 종자와 신장력이 강력한 지하경으로 번식한다. 새로운 곳으로의 침입은 주로 종자로 하고, 지하경 형성은 초여름 무렵부터 시작되어 늦가을과 초겨울 동안에 새싹이 나와 로제트를 형성하여 월동한다. 양미역취 지하경의 재생력은 강력하여 깊이 30 ㎝ 깊이의 토층에서도 출아할 수 있다. 양미역취가 분비하는 성분 중 cis-dehydromatricaria ester가 주변 식생의 성장 억제 등과 같은 타감작용에 관여한다. 양미역취는 주로 도로변, 황무지 등에서 발생하여 경종적인 관리방법은 거의 없다. 예취나 경운 등의 물리적 방법으로 관리할 수는 있으나 굉장히 제한적이다. 양미역취는 트리클로피르티이에이 액제나 글리포세이트이소프로필아민 액제 등의 이행성 제초제를 생육 중에 살포하여 방제할 수 있다.
Acknowledgement
This study was supported by joint research project from the Ministry of Environment, Republic of Korea (Project number: 2021002270004).
Authors Information
In-Yong Lee, https://orcid.org/0000-0001-7151-7048
Seung-Hwan Kim, Hankyong National University, Senior Researcher
Yong-Ho Lee, Hankyong National University, Senior Researcher; OJeong Resilience Institute, Korea University, Researcher
Sun-Hee Hong, https://orcid.org/0000-0001-7581-0604