서 론
하천, 저수지, 농경지, 수조(water container) 등에서의 미세조류 대발생(microalgae blooms)은 생태계, 인축 안전성, 경제활동 등에 많은 위협이 되고 있다. 특히 수생태계에 존재하는 원핵 광합성 생물인 2,000여종 이상의 남조류(bule-green algae, cyanobacteria) 중에는 독성물질(cyanotoxins)을 생산·분비하여 많은 문제를 야기시키는 약 40여종의 유해 남조류가 전세계적으로 분포하고 있다(Hester and Harrison, 2011; Mutoti et al., 2022). 이들 중 우리나라 담수조건에서는 microcystins라는 간독성(hepatotoxicity) 물질을 생산하는 Microcystis, Anabaena (Dolichospermum), Aphanizomenon, Oscillatoria (Planktothrix) 등이 주로 발생하지만 가장 문제가 되는 것은 Microcystis이다(Park, 2007).
Microcystis는 주로 간독성을 일으키는 microcystins (MCs)라는 독성물질을 생산하고 있는 바, 이의 특징을 간단히 살펴보면 microcystins는 자연환경에 가장 많이 퍼져있는 시아노톡신(cyanotoxin)으로서 현재 246여종이 동정되었고 이중 microcystin-leucine arginine (MC-LR)이 가장 독성이 높다고 한다(Rastogi et al., 2015; Melaram et al., 2022; Weralupitiya et al., 2022). MCs는 수중 동물 및 식물에 농축될 수 있고, 식물의 생장·생리·형태에 영향을 미치며, 오염된 음용수나 식품의 섭취를 통해 또는 독성 남조류의 흡입 및 접촉에 의해 상당히 저농도에서도 사람 건강을 해칠 수 있다(Jia et al., 2018; Campos et al., 2021; Zhang et al., 2021; Mutoti et al., 2022, Weralupitiya et al., 2022). 세계보건기구(WHO)는 식수내 MC-LR 하루 섭취 허용량을 1 ppb (㎍ L-1) 이하로 규정하고 있다(Melaram et al., 2022). 그리고 MC-LR는 구조적 안전성이 높아 300° C 정도의 고온과 sunlight에도 안정한 편이며, 중성 pH에서의 가수분해나 산화도 잘 안되는 경향이어서 수체에서 약 2-3개월, 건조된 상태에서는 5-6개월동안 잔류가능하다고 한다(Ressom et al., 1994; Antoniou et al., 2005; Massey and Yang, 2020). MCs로 인한 실제 피해사례는 해외 여러나라에서 이미 보고되었지만 가장 심각했던 것은 1988년과 1996년 브라질에서 MCs로 인해 각각 88명, 47명이 사망한 사례가 알려져 있다(Jochimsen et al., 1998; Kuiper-Goodman et al., 1999). 그리고 식물에 미치는 시아노톡신(cyanotoxins)의 부정적 효과에 대해서 많은 조사결과가 있는 바, 여러 작물종 중에서도 특히 잎이 무성한 채소류에서 독소 흡수가 용이하면서 높은 약해를 나타낸다고 한다(Xiang et al., 2019; Melaram et al., 2022; Weralupitiya et al., 2022). 한가지 예로서 벼의 경우엔 0.5 ppm 농도에서도 뿌리 생장 억제, 뿌리에서의 항산화시스템 붕괴와 지질과산화 유발 등의 약해를 보이는 것으로 알려져 있다(Cao et al., 2018). 또한 시아노톡신은 물고기, 새우, 상추, 벼, 토마토, 고추 등 사안에 따라 다양한 농도로 축적되고 있음이 보고되고 있는 바, 물고기의 경우 kg당 71.6 μg, 새우의 경우에는 g당 15.2 μg 정도 MCs가 축적된다고 보고하였다(Mutoti et al., 2022).
한편, 국내에서는 직접적인 피해사례가 아직 보고되지 않았지만, 최근 산업발전과 함께 기후변화로 인해 하천녹조(남조류 대발생) 문제가 더욱 심해지면서 하천수에서의 독소 검출 뿐만 아니라 담수생물에서의 독소축적(toxin bioaccumulation)도 보고되고 있으며(Kim et al., 1999; Kim et al., 2022), 공식 검증은 미실시된 상태이지만 하천녹조로 오염된 물을 농경지의 관개수로 공급했을 때 여러 가지 채소류 뿐만 아니라 일부 벼로부터 수확한 쌀(현미) 등에서도 MCs가 검출되었다는 보도자료(연합뉴스 2022년 2월 8일, 오마이뉴스 2022년 3월 22일)가 있는 상황이다. 그 일부 사례를 살펴보면, 남조류가 발생한 낙동강 물로 5일간 상추를 재배한 결과, 상추 1kg당 67.9 μg의 MCs가 축적되었으며 금강 하류 부근에서 재배된 쌀과 낙동강 부근에서 수확한 무, 배추에서도 1kg당 1-5 μg 수준의 MCs가 검출되었다고 하였다. 아울러 가뭄시 하천수를 관개한 농작물에서의 독성물질 축적과 더불어 하천녹조가 심한 주변지역에서는 에어로졸 상태의 남조류 세포 및 MCs와 함께 ß-N-methylamino-L-alanine (BMAA)라는 독소도 검출된다고 하는데(환경운동연합 2022년 9월 21일 기자회견 자료, CBS노컷뉴스 9월 24일자 보도자료, 연합뉴스 2023년 8월 6일 보도자료) 이러한 경향은 이미 해외에서도 여러 사례가 보고되고 있으며 피해 가능성도 제기되고 있다(Codd et al., 1999; Backer et al., 2010; Schaefer et al., 2020; Olson et al., 2020; Breidenbach et al., 2022; Labohá et al., 2023; Shi et al., 2023). 이는 단순히 먹거리 뿐만 아니라 친수활동 및 농작업 활동에도 문제가 될 수 있음을 뜻한다.
시아노톡신과 시아노박테리아를 저감시키는 전략으로 크게 3가지 즉 물리적, 화학적, 생물학적 방법이 검토되고 있는데(Rastogi et al., 2015; Balaji-Prasath et al., 2022) 경제성 및 사용 편리성 등으로 화학적 방법, 즉 응집제, algicide, herbicide 등의 살조 화합물을 사용하는 방법(Jančula and Maršálek, 2011; Matthijs et al., 2016)에 많은 관심을 두고 연구되어 오고 있다. 특히 Microcystis와 같은 유해 남조류를 잘 방제하는 화합물들을 천연소재로부터 탐색하거나(Shao et al., 2013; Kwak et al., 2016; Kim and Kim, 2018; Zhu et al., 2021) 신규로 합성된 유기화합물을 개발하고 있는데(You et al., 2017; Park et al., 2023; Wang et al., 2023; Huang et al., 2023), 주로 우수활성물질의 도출에만 주안점을 두고 있는 반면에 비표적생물에 대해서는 안전하면서 유해 남조류를 선택적으로 방제하는 물질의 탐색과 개발(Kim et al., 2022) 연구는 활발하지 못한 상황이다. 또한 기존 제초제를 가지고서 남조류를 포함한 여러 미세조류에 대한 활성정도를 비교조사한 결과들이 다수 보고되고 있지만 주로 화합물 독성평가 차원에서의 해외연구가 대부분이고(Phlips et al., 1992; Fairchild et al., 1998; Michel et al., 2004; Nagai et al., 2016; Nagai, 2019; Ueda and Nagai, 2021), 국내에서는 이러한 연구 특히 방제차원에서 여러 미세조류들에 대한 각종 제초제들의 살조반응 비교 연구가 전혀 시도된 바 없다.그리고 현재 국내 녹조 관리 현황을 대략적으로 살펴볼 때, 하천에서의 녹조관리의 경우 물리적 방제의 기술적, 경제적 한계로 인해 최근엔 화학적 방제에도 노력을 기울여 2023년 5월 기준으로 14개의 조류제거물질이 국립환경과학원에 등록된 상태이다. 한편 농경지의 경우는 농작물 생장에 지장을 주는 조류(algae)를 포괄적으로 방제하는 것에만 관심을 가져 작물보호지침서에 2022년 4월 기준으로 20여 품목의 논조류 및 이끼 방제제가 등록되어 있지만, 수생태계 미세조류 군집 변동에 미치는 영향과 생태 및 국민건강 입장에서의 유해 남조류 선택적 방제에 관련한 시험결과는 거의 전무한 실정이다. 따라서 국내 녹조관리방안이 앞으로 더욱 체계적으로 수립될 필요성이 있는 바, 그 동안에는 주로 하천에서의 녹조관리에 집중해 왔다면 앞으로는 농경지에서의 유해녹조관리까지도 확대해서 검토되어야 할 것이다. 즉, 앞으로는 농경지와 그 주변지역에서도 유해 남조류를 선택적으로 제어할 수 있는 방안을 적극적으로 강구하여, 논에서 뿐만 아니라 하천으로 유입되는 농업배출수내의 남조류 세포밀도를 최소화시켜야 할 것이다.
따라서 본 연구에서는 유해 남조류의 선택적 저감기술 수립에 필요한 국내 기초자료를 획득하기 위하여, 농경지에서 사용되는 23가지 작용기작의 제초제 56종들에 대해서 국내에서 수집한 남조류 Microcystis aeruginosa (Ma)와 좀개구리밥 Lemna paucicostata (Lempa)을 대상으로 생육저해활성 정도와 특성을 비교조사해 보았다.재료 및 방법
시험생물
본 시험에 공시된 생물종은 담수생물자원은행(Freshwater Bioresources Culture Collection, FBCC)에서 분양받은 남조류 Microcystis aeruginosa A68 (Ma-F), 생물자원센터(Korean Collection for Type Cultures, KCTC)에서 분양받은 남조류 Microcystis aeruginosa AG60752 (Ma-K)과 좀개구리밥 Lemna paucicostata PC3034 (Lempa) 이었다. 좀개구리밥은 일정 조건의 생육실(온도 25℃, 광주기 14시간, 광도 45-55 µmol m-2s-1)에서 1x mDM 배지(Kim and Kim, 2020)에 계대배양중인 것을, Microcystis aeruginosa (Ma)는 동일 생육실(온도 25℃, 광주기 14시간, 광도 20-30 µmol m-2s-1)에서 BG11 배지 (pH 7.1)를 사용하여 계대배양중인 것을 사용하였다.
시험화합물과 시험용액 조제
제초제 작용기작 분류의 23가지에 속하는 56개 제초제 원제(technical grade)를 선별하여 시험 화합물로 사용하였다(Table 1 참조). 시험에 적용된 작용점 23가지는 acetyl Co-A carboxylase (ACCase, 1), acetolactate synthase (ALS, 2), microtuble assembly (3), auxin 교란작용(4), photosystem II (PS II, 5와 6), enolpyruvyl shikimate phosphate synthase (EPSPS, 9), glutamine synthetase (GS, 10), phytoene desaturase (PDS, 12), 1-deoxy-D-xylulose 5-phosphate synthase (DXS, 13), protoporphyrinogen IX oxidase (PPO, 14), very long chain fatty acid synthesis (VLCFAS, 15), dihydropteroate synthase (DPS, 18), auxin transport (19), photosystem I (PS I, 22), microtuble organization (23), uncoupler (24), 4-hydroxyphenylpyruvate dioxygenase (HPPD, 27), cellulose 생합성 저해(CBI, 29), fatty acid thioesterase (FAT, 30), serine-threonine protein phosphatase (31), solanesyl diphospahte synthase (SDS, 32), lycopene cyclase (34), unknown (0) 이었다. 여기서 괄호안의 숫자는 WSSA/HRAC 코드번호이다. 시험용액 조제는 기본적으로 2.0% Tween 20이 포함된 dimethyl sulfoxide (DMSO) 용매에 시험약제를 녹여 여러 농도의 stock solution을 조제한 다음, Ma의 경우 기본배지 20 mL에 40 µL씩, Lempa의 경우 기본배지 30 mL에 60 µL씩 주입하여 조제하였다.
Ma에 대한 살조활성(algicidal activity) 평가
기본적으로 살조활성 평가는 부피 75mL cell culture flask (SPL 70325, SPL Life Sciences, Pocheonsi, Gyeonggido, Korea)에 20mL의 시험용액을 넣고 3반복으로 실시하였으며 시험기간 동안 시험용액을 교체해주지 않는 지수식(static)으로 실험하였다. 사전 준비한 BG11 멸균배지에 계대배양중인 Ma-K 또는 Ma-F를 소량 접종하고 화합물당 4농도 (0.04, 0.4, 4, 40 μM 또는 0.4, 4, 40, 400 μM)의 시험화합물을 처리한 다음, 생육실(25±1℃ 항온, 14h 광주기, 20-30 µmol m-2s-1)에서 10일 동안 배양하였다. 배양이 종료되었을 때, 먼저 생육저해정도를 0-100% 등급표를 이용하여 달관조사한 다음(0: 무방제, 100: 100% 방제), UV/VIS spectrophotometer (DU800, Beckman Coulter, Brea, USA)를 이용하여 in vivo chlorophyll 흡광도(A680-A780 nm)를 조사하였다. 각 화합물의 미세조류에 대한 생육저해 활성은 무처리구에 대한 억제정도(inhibition %)로 환산하여 나타내었다.
Lempa에 대한 약해(생육억제활성) 평가
기본 배양액(1x mDM)에 여러 농도의 시험용액을 조제한 다음, 90mL 투명플라스틱컵(직경: 상 52mm - 하 36mm, 높이 60mm, Sangjicup, Cheongju-si, South Korea)에 30mL씩 분주하였다. 그 후 계대배양중인 Lempa 중에서 3.9-4.1 frond 짜리 5개를 선별하여 각각의 시험용액에 접종한 후 생육실(25℃ 항온, 14 hr 명조건, 형광등 45-55 µmol m-2s-1)에 옮겨 6일간 배양하였다. 먼저 생육저해정도를 0-100% 등급표(0: 무방제, 100: 100% 방제)를 이용하여 달관조사한 후, 엽상체가 0.5mm 이상 큰 것을 기준으로 Lemna 엽상체 갯수를 조사하였다. 그 후 티슈 타올로 좀개구리밥 표면의 물기를 가능한 한 완벽히 제거한 다음 생체중을 측정하였다. 생체중 조사가 끝난 시료는 즉시 10 mL methanol (순도 99.8%, Samchun Pure Chemical, Korea)이 담긴 falcon tube에 침지하여 실온 암조건에서 overnight 시키면서 광합성 색소를 추출하였다. 색소추출 용액에 대해 UV/VIS spectrophotometer (DU800, Beckman Coulter, Brea, USA)를 이용하여 470 nm, 652.4 nm, 665.2 nm에서의 흡광도를 조사한 다음, Lichtenthaler (1987) 방법에 따라 엽록소 및 카로티노이드 함량을 정량하였다. 각 화합물의 Lempa에 대한 생육저해 활성은 무처리구에 대한 억제정도(inhibition %)로 환산하여 나타내었다.
결과 및 고찰
여러 가지 작용기작에 속하는 제초제들을 대상으로 Ma의 두가지 생태형과 Lempa를 가지고 0.04 ~ 40 μM 처리농도 범위에서의 생장 반응을 조사한 결과는 표 1에서와 같았다. 각 처리농도별로 생장억제 정도를 6가지로 구분하여 별의 개수에 따라 0-9.9% (-), 10-19.9% (*), 20-39.9% (**), 40-59.9% (***), 60-79.9% (****), 80-100% 저해도(*****)로 나타내었다. 본 연구의 실험농도범위에서 활성 자체가 발현되지 못한 것은 pelargonic acid으로서 이는 보다 더 높은 농도 처리가 요구되었고, 기타 화합물은 정도차이는 있지만 모두 활성을 나타내었다.
Table 1
Growth inhibition responses of Microcystis aeruginosa and Lemna paucicostata against herbicides of various modes of action.
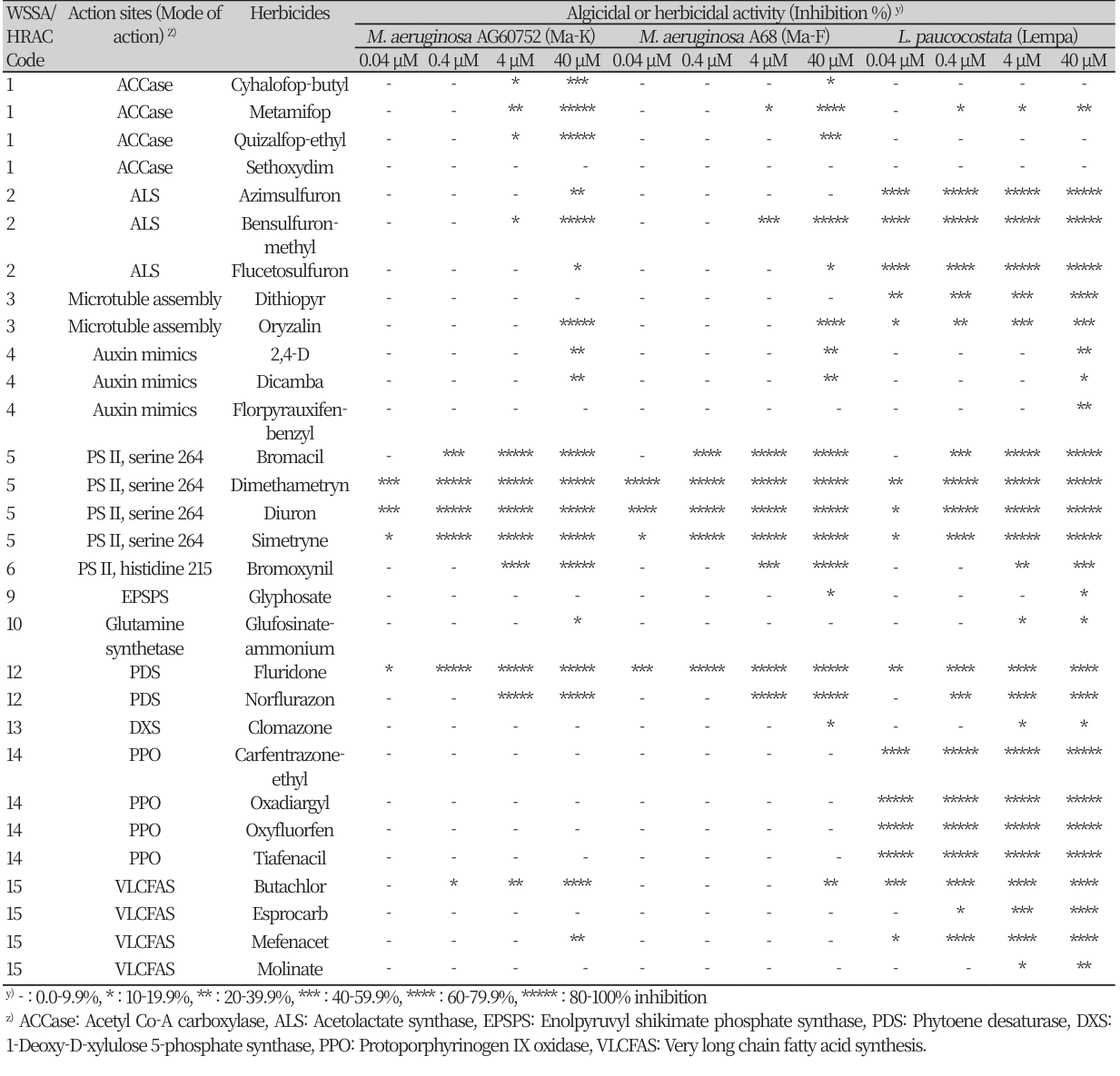
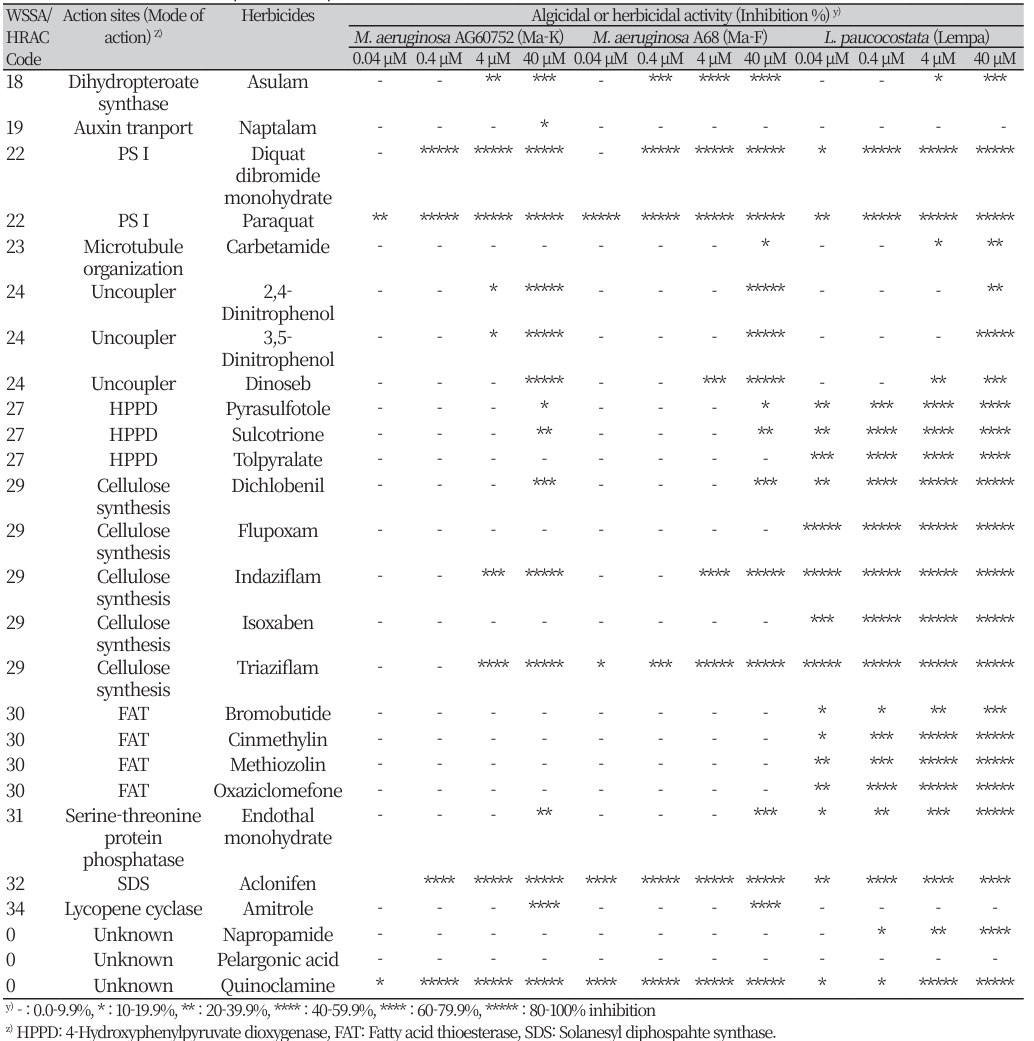
Table 1
Growth inhibition responses of Microcystis aeruginosa and Lemna paucicostata against herbicides of various modes of action. (continued)
공시된 화합물들의 작용기작별 반응유형을 두 생물재료 간의 반응차이(선택성) 및 활성정도를 기준으로 대략적으로 구분해 보았을 때 표 2와 같이 크게 세 그룹으로 나눌 수 있었다.
Table 2
Grouping of mode of action (MOA) according to the response patterns in the growth inhibitions of Microcystis aeruginosa (Ma) and Lemna paucicostata (Lempa) against various herbicides.
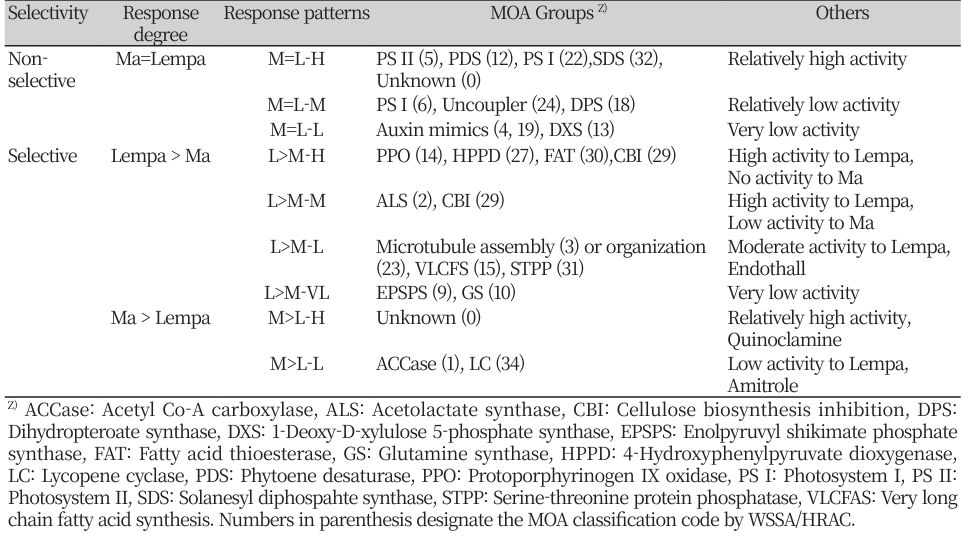
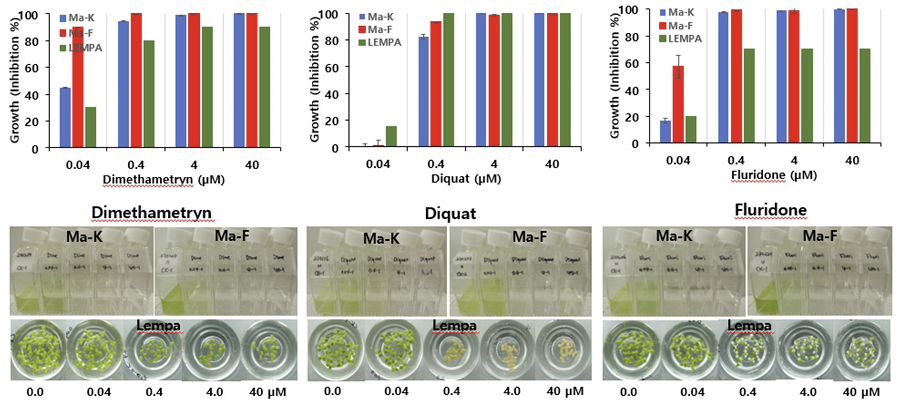
첫째는 Ma와 Lempa간의 반응차이가 거의 없어 비선택성을 보이는 그룹으로서 상대적으로 활성이 높은 것(M=L-H), 중간 정도의 것(M=L-M), 매우 낮은 것(M=L-L)으로 나누어 보았을 때(Table 2), M=L-H에는 PS II (5), PDS (12), PS I (22), SDS 저해제(32)가 이에 속하였다. 여기에서 괄호안의 숫자는 WSSA/HRAC의 작용기작 분류코드를 나타낸다. M=L-M에는 PS I (6), Uncoupler (24), DPS 저해제(18)가, M=L-L에는 Auxin 교란물질(4, 19) 및 DXS 저해제(13)가 이에 속하는 경향을 보였다. 전반적으로 광합성전자전달저해와 카로티노이드 생합성 저해에 관련된 화합물들은 대부분 두종 모두에 대해 높은 저해활성을 나타내는 경향이었다(Nagai et al., 2016). 그러나 오옥신 교란물질은 두 종 모두에 대해 매우 낮은 활성을 보였다(Michel et al., 2004; Ueda and Nagai, 2021). 이들 그룹에 속하는 대표적인 제초제 반응사례를 살펴보면(Fig. 1), PS II 저해제(5)인 dimethametryn의 경우 Lempa와 Ma 모두에 대해 강한 저해활성을 보여 0.04 μM에서는 80% 이상의 저해를, 0.4 μM에서는 30-80% 범위의 활성을 나타내었으며 Ma중에서도 Ma-K보다 Ma-F가 약간 더 민감한 반응을 나타내는 경향이었다. PS I 저해제(22)인 diquat의 경우 Lempa와 Ma 모두에 대해 강한 저해활성을 보여 0.4 μM에서는 80% 이상의 저해를, 0.4 μM에서는 0-20% 범위의 활성을 나타내었다. 한편 PDS 저해제(12)인 fluridone의 경우 전반적으로 dimethametryn과 유사한 반응을 나타내었다(Fig. 1)
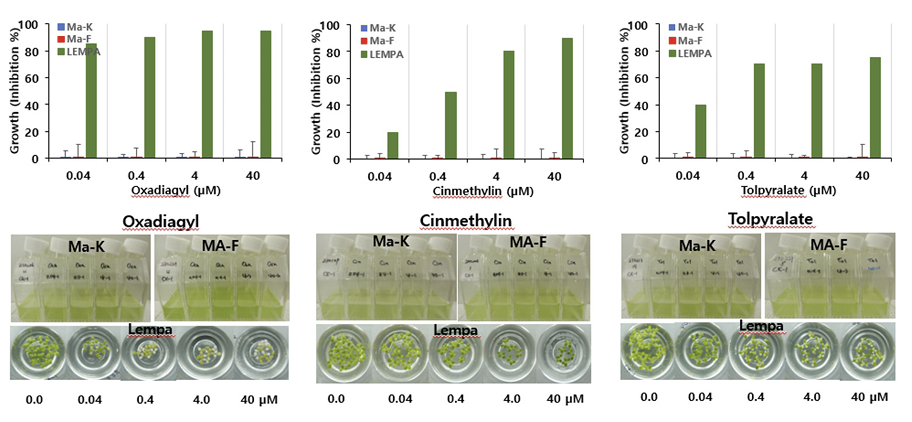
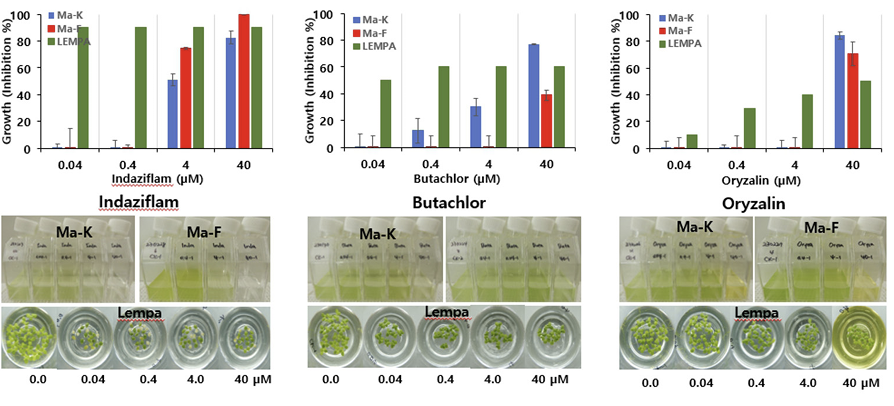
둘째는 Ma와 Lempa간의 반응차이가 있어 어느 정도 선택성을 보이는 그룹으로서 Lempa가 Ma보다 생장저해정도가 높은 반응(민감한 반응)을 나타내는 경우이다(Table 2). 네 그룹으로 구별할 수가 있는 바, Lempa에 대한 제초활성은 매우 높은 편이지만 Ma에 대해서는 전혀 활성을 나타내지 못하는 경우로서(L >M-H) PPO 저해제(14), HPPD 저해제(27), FAT 저해제(30), Cellulose 생합성 저해제(29) 일부(isoxaben, flupoxam)가 이에 속하였다. Lempa에 대한 제초활성은 높은 편이지만 Ma에 대해서는 낮은 활성을 보이는 경우로서(L >M-M) ALS (2), Cellulose 생합성 저해제(29) 일부가 이에 속하였다. Lempa에 대한 제초활성은 중간정도이면서 Ma에 대해서는 낮은 활성을 보이는 경우로서(L >M-L) Microtuble assembly 저해제(3), VLCFAS 저해제(15), endothal monohydrate 등이 이에 해당하였다. 한편 Lempa에 대한 제초활성도 상대적으로 낮았지만 Ma에 대해서는 더 낮은 활성을 보여 선택성 정도가 낮은 것은(L >M-VL) GS 저해제(10)와 EPSPS (9) 저해제가 이에 속하는 경향이었다. 전반적으로 볼 때, Lempa에 대한 제초활성이 우수한 화합물일지라도 Ma에 대한 살조활성은 거의 없거나 만족스런 수준을 나타내지 못하는 특징을 보였다. 이들 그룹에 속하는 대표적인 제초제 반응사례를 살펴보면(Fig. 2, Fig. 3), PPO 저해제(14)인 oxadiagyl의 경우 Lempa에 대해서는 0.04 μM에서 80% 이상의 강한 저해활성을 나타내지만 Ma에 대해서는 40 μM 처리에서도 전혀 저해활성이 없었다. FAT 저해제(30)인 cinmethylin과 HPPD 저해제(20)인 tolpyralate는 Lempa에 대해서 oxadiagyl보다 낮은 저해활성을 보여 0.04 μM에서 20-40% 정도 저해하였지만 Ma에 대해서는 40 μM 처리에서도 전혀 저해활성을 나타내지 못했다(Fig. 2). Cellulose 생합성 저해제(29)인 indaziflam의 경우, Lempa에 대해 0.04 μM에서 90% 정도 강한 저해활성을 가지며 Ma에 대해서는 0.4 μM에서 활성이 없었고 4 μ M 에서는 50-80%의 저해활성을 보였다(Fig. 3). 한편 VLCFAS 저해제(15)에 속하는 butachlor의 경우, Lempa에 대해 0.04 μM 이상에서 50% 이상의 저해활성을 가지는 반면에 Ma에 대해서는 4 μM 이상에서 0-30% 이상의 선택 활성을 보였고 Ma-K가 Ma-F보다 보다 민감한 반응을 나타내었다(Fig. 3). 아울러 Microtuble assembly 저해제(3)에 속하는 oryzalin의 경우는 Lempa에 대해 0.04 μM부터 저해활성이 나타나 40 μM에서는 약 50% 저해활성을 가졌으나 Ma에 대해서는 4 μM 까지 전혀 활성이 없다가 40 μM에서 75-80% 저해 활성을 보였다(Fig. 3).
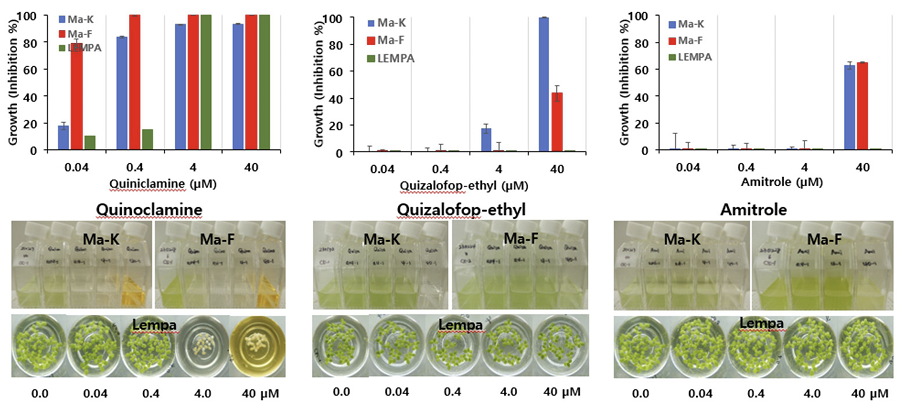
셋째는 Ma와 Lempa간의 반응차이가 있어 어느 정도 선택성을 보이는 그룹으로서 Ma가 Lempa보다 생장저해정도가 높은 반응(민감한 반응)을 나타내는 경우이다. 두 그룹으로 구별할 수가 있었는 바, Lempa에 대한 제초활성도 높은 편이지만 Ma에 대해서는 보다 높은 활성을 나타내는 경우로서(M >L-H) 작용기작이 아직 밝혀지지 않은 quinoclamine이 이에 속하였다. 한편 Lempa에 대한 제초활성은 거의 없지만 Ma에 대해서는 비교적 고농도(40 μM)에서 중간정도의 활성을 나타내는 경우로서(M >L-M) ACCase 저해제(1)와 lycopene cyclase 저해제(34)인 amitrole이 이에 속하였다. 이들 그룹에 속하는 대표적인 제초제 반응사례를 살펴보면(Fig. 4), 아직 작용점이 밝혀지지 않은(0) quinoclamine의 경우, Lempa에 대해 0.04~0.4 μM에서는 10% 내외의 낮은 활성을 보이다가 4.0 μM 이상에서는 완전히 고사시켰다. 반면에 Ma-F에 대해서는 0.04 μM 이상에서 80% 이상의 저해활성을 보였으며 Ma-K는 0.04, 0.4 μM 처리시 각각 20, 80% 정도의 저해활성을 나타내어 Ma-F보다 약간 둔감한 경향을 보였다. 한편 ACCase 저해제(1)인 quizalofop-ethyl과 lycopene cyclase 저해제(34)인 amitrole의 경우, Lempa에 대해서는 40 μM에서도 저해활성이 없었지만 Ma에 대해서는 40-100%의 저해활성을 나타내는 특징을 보였다(Fig. 4).
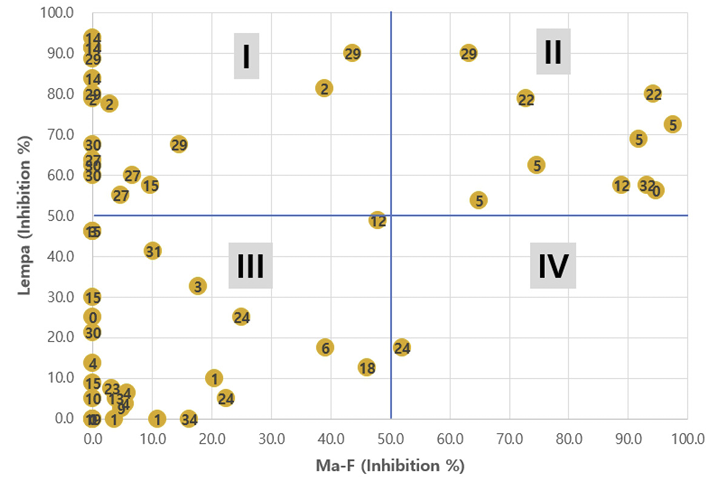
본 연구의 실험결과를 토대로 Lempa와 Ma의 저해반응 상대비교를 위해, 화합물별로 4개 처리농도의 활성을 평균한 다음, Ma에 대한 활성을 X축, Lempa에 대한 활성을 Y축으로 하여 상호반응 지점을 표시해 보았다. Ma-K와 Lempa에 대한 활성비교 결과(Fig. 5), I 사분면에 속하는(높은 활성, Lempa > Ma 반응) WSSA/HRAC 작용기작 분류코드는 2, 14, 19, 27, 29, 30 등이었고, II 사분면에 속하는(높은 활성, Lempa = Ma 반응) 그룹은 5, 12, 22, 0 등이었으며, III 사분면에 속하는(낮은 활성, Lempa = Ma 반응) 그룹은 1, 4, 15, 0, 19, 24 등이었다. 반면에 IV 사분면에 속하는(높은 활성, Ma > Lempa 반응) 그룹은 전혀 없었다. Ma-F와 Lempa에 대한 활성비교 결과에서도 같은 경향을 보였다(Fig. 6). 이들의 결과는 현재 사용중인 제초제들 중에는 Lemna에 대해 비교적 안전하면서 Ma를 선택적으로 잘 방제하는 약제가 거의 없음을 나타내는 것으로서, 향후 생태환경을 보다 적극적으로 보호하면서 문제되는 남조류 Microcystis를 효과적으로 제어하는 화합물의 탐색과 개발도 필요하다고 여겨진다.
Fig. 5
Comparison of Microcystis aeruginosa AG60752 (Ma-K) vs Lemna paucicostata (Lempa) in the averaged values of growth inhibition percentages obtained after treatment with 4 concentrations (0.04, 0.4, 4, and 40 μM) of 56 herbicides. Numbers in circles desicate the herbicide mode of action group codes classified by WSSA/HRAC.
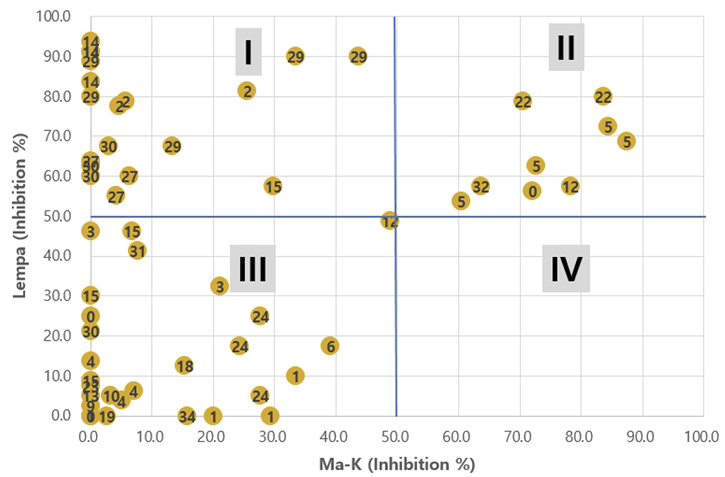
Fig. 6
Comparison of Microcystis aeruginosa A68 (Ma-F) vs Lemna paucicostata (Lempa) in the averaged values of growth inhibition percentages obtained after treatment with 4 concentrations (0.04, 0.4, 4, and 40 μM) of 56 herbicides. Numbers in circles designate the herbicide mode of action group codes classified by WSSA/HRAC.
그동안 농경지에서의 미세조류 방제는 부차적인 문제에 불과하였다. 즉 논에 사용되는 많은 제초제들이 어느 정도 조류(algae)를 방제하는 능력이 있었기 때문이다. 그러나 기후변화, 농업생태환경의 보호, 보다 안전한 농산물 생산, 저농약 사용 등의 이슈가 부각되면서 상황이 많이 변화하고 있다. 첫 번째 이슈로는 전세계적으로 산업성장 및 기후변화로 인해 유해 남조류 발생이 증대되고 있다는 것이다(Huisman et al., 2018; Igwaran et al., 2024). 우리나라 경우도 기후가 아열대성으로 변화되면서 잡초뿐만 아니라 미세조류의 대발생도 증대되고 있고 때로는 가뭄이 심하여 하천수를 농업용수로 대체시켜야 할 경우가 자주 발생할 수도 있을 것이다. 특히 국내 하천의 녹조발생(남조류 증식)이 심한 상태에서는 남조로 오염된 관개수로 인해 논밭에서의 남조류 seed 증대, 농작물 체내로의 남조독소 축적 염려, 농작업자의 안전 등의 문제가 복합적으로 동시에 발생할 수 있다. 둘째는 농업생태환경을 최대한 보호하면서 안전농산물을 지속적으로 생산해야 한다는 이슈이다. 즉 향후 제초제는 비표적 생물(물벼룩, 어류, 꿀벌, 지렁이 등)에는 상대적으로 안전하면서 타겟 잡초만을 방제하고, 더 나아가서는 식물간에도 환경에 중요한 역할을 하는 식물은 살리고 문제되는 유해식물은 선택적으로 제어하는 고선택성의 약제가 활용되어야 한다(예, 개구리밥과 식물에 안전하면서 기타 문제잡초만을 방제하는 화합물 또는 유용 녹조류는 살리되 유해 남조류를 방제하는 약제 등).
이러한 관점에서 본 연구에서는 먼저 국내 하천녹조에 가장 문제가 되고 있는 남조류 Microcystis aeruginosa 종에 대해 여러 가지 작용기작의 제초제들이 어떠한 반응정도와 특성을 가지는지를 종합적으로 살펴보고, 아울러 좀개구리밥과의 반응을 상대비교한 결과 크게 세가지로 요약될 수 있었다. (1) 엽록체의 생존 에너지 형성경로에 직·간접 작용점을 가지는 화합물군은 Ma를 잘 방제하기도 하지만 Lempa에 대해서도 심한 약해를 유발하였다. (2) 제초제로서 활성이 좋다고 알려진 작용기작 즉 ALS, PPO, HPPD, FAT 저해제와 CBI 화합물들은 상대적으로 Ma를 잘 방제하지 못하는 특징을 보였다. 따라서 이들의 무분별한 지속사용은 미세조류 군집분포에 있어서 녹조류보다는 남조류의 생태적 우위를 유발시켜 오히려 Ma 대발생 문제를 촉진시킬 수도 있을 것 같았다. 한편 보고에 의하면 clethodim, glyphosate, quizalofop-ethyl, glufosinate 등의 제초제는 특정농도에서 Ma의 증식을 오히려 촉진시킴과 동시에 체내 독소(microcystines) 생산도 증진시킨다고 하였다(Zhang et al., 2016; Zhang et al., 2017; Brêda-Alves et al., 2020; Wang et al., 2021; Yu et al., 2021). 즉 특정 제초제의 경우 아직까지 알려지지않은 기작을 통해 Ma의 생장을 자극하거나 또는 화합물 자체가 영양분으로 사용되어 오히려 Ma가 증식되는 부정적 결과가 야기될 가능성을 염두해 두어야 하겠다. 이에 대해서는 향후 더 많은 연구가 국내에서도 이루어질 필요성이 있겠다. (3) Lempa에 안전하면서 Ma를 비교적 저농도에서 유효하게 선택적으로 방제할 수 있는 화합물 군은 본 연구에서 확인되지 않았다. 즉, 공시화합물 중 quinoclamine은 Ma에 대해 상대적으로 높은 활성을 보였지만 Lempa에 대한 약해도 높아 선택성 폭이 좁다는 단점을 가졌다. 한편 quizalofop-ethyl과 amitrole도 다른 화합물과 비교했을 때 상대적으로 Ma를 잘 죽이기는 하지만 처리농도 자체가 높다는 문제가 있어, 실제적으로 Ma만을 저농도에서 만족스럽게 방제할 수 있는 화합물은 본 연구에서 발견되지 않았다. 따라서 향후 여러 소스로부터(Shao et al., 2013; Rastogi et al., 2015; Kwak et al., 2016; You et al., 2017; Kim and Kim, 2018; Zhu et al., 2021; Park et al., 2023; Wang et al., 2023; Huang et al., 2023) Ma를 보다 선택적으로 방제하는 우수 화합물의 선발 또는 신규 개발과 이들을 활용한 유해 남조류의 합리적 관리방안에 대한 연구가 보다 심도있게 진행될 필요성이 있다고 판단된다.
요 약
본 연구에서는 국내 하천녹조에 가장 문제가 되고 있는 남조류 Microcystis aeruginosa (Ma) 종을 대상으로 23가지 작용기작의 56개 제초제들이 어떠한 살조반응 정도를 나타내는지 살펴보고, 아울러 좀개구리밥(Lempa)과의 반응을 상대비교해 보았다. 그 결과, (1) 엽록체의 생존 에너지 형성경로에 직·간접 작용점을 가지는 화합물군은[PS II (5), PS I (22), PDS (12), SDS (32), DPS (18)] Ma를 잘 방제하기도 하지만 Lempa에 대해서도 심한 약해를 유발하였다. (2) Lempa가 Ma보다 생장저해정도가 높은 반응의 경우로서, PPO (14), HPPD (27), FAT 저해제(30), CBI (29) 일부(isoxaben, flupoxam)는 Lempa에 대한 저해활성이 매우 높았지만 Ma에 대한 저해활성은 거의 없었다. CBI (29)의 일부, ALS (2), Microtuble assembly (3), VLCFAS (15), GS (10), EPSPS (9) 저해제들과 endothal monohydrate 등은 Lempa보다 Ma에 대해서 상대적으로 더 낮은 저해활성을 보였다. (3) Ma가 Lempa보다 생장저해정도가 높은 반응을 나타내는 경우로서 quinoclamine은 Ma에 대해서 높은 저해활성을 나타내지만 Lempa에 대한 약해도 높아 선택성 폭이 낮았고, ACCase 저해제(1) 일부와 amitrole은 Lempa에 대한 저해활성은 거의 없었지만 Ma에 대해서는 비교적 고농도(40 μM)에서 중간정도의 활성을 나타내었다. 이들의 결과를 종합해 볼 때, 제초활성이 우수하여 활용도가 높은 작용기작 즉 ALS, PPO, HPPD, FAT 저해제와 CBI 화합물들은 상대적으로 Ma를 잘 방제하지 못하는 특징을 보여 이들의 무분별한 지속사용은 Ma 증식에 우호적인 환경을 제공할 수도 있을 것 같았다. 한편 Lempa에 안전하면서 Ma를 비교적 저농도에서 유효하게 선택적으로 방제할 수 있는 화합물 군은 본 연구에서 확인되지 않았기 때문에 향후 Ma의 선택적 방제를 위한 우수 화합물 개발과 이를 이용한 합리적 관리방안 연구가 더욱 필요할 것으로 판단되었다.