서 론
식물의 백색은 하얀꽃(white flower)에서처럼 보통 유전적 원인에 의하여 태생적으로 나타나는 경우가 대부분이지만, 정상 조건에서 녹색으로 생장할 수 있는 식물체가 특정 화합물 처리 또는 환경조건에 의해 광합성색소가 파괴되거나 생성되지 못해서 식물조직(특히 새롭게 발달·생육하는 분열부 조직)의 백화(whitening, bleaching)가 유도되기도 한다.
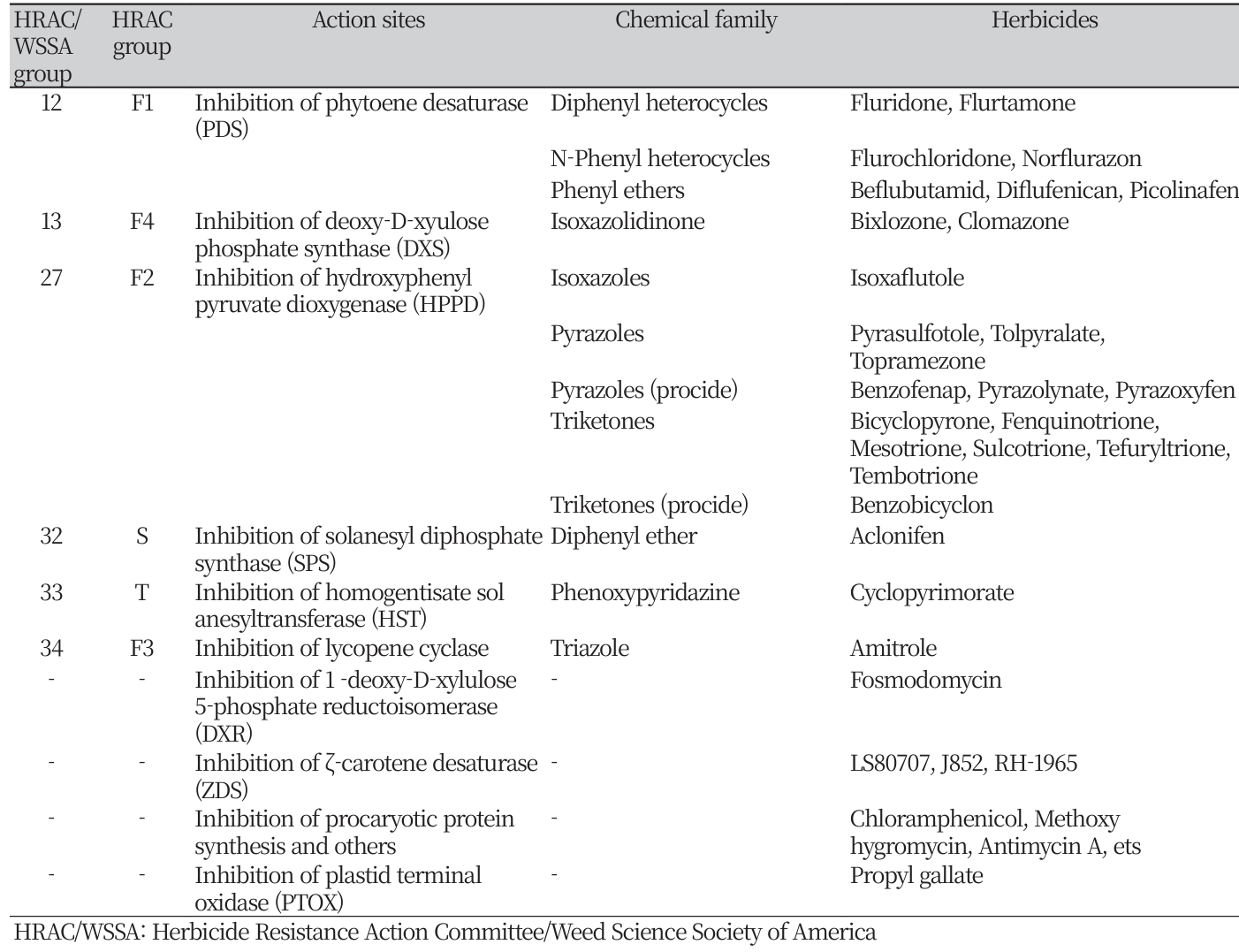
특정 화합물에 의해 식물체가 백화(whitening)되는 현상은 제초제 개발과정에서 자주 관찰되는데, 이에 속하는 화합물 그룹은 전체 개발 제초제 중에서 큰 비중을 차지하고 있다. 현재까지 백화유도 상업용제초제에 국한하여 연구보고된 작용점(action site)을 분류하면 총 8가지이지만 (Table 1), 연구중에 있는 것 까지 포함하면 적어도 10가지 이상은 되는 것 같다. 본 총설에서는 과거에 보고된 제초제 작용기작 리뷰(Kim et al., 1999b) 이후로 식물백화를 유도시키는 여러가지 화합물의 종류, 이들의 작용 생리 및 특성에 관한 최신 연구내용을 취합하여 요약해 보고자 한다.
Table 1
Classification by the modes of action of compounds inducing a bleaching (whitening) of plants.
식물 백화현상 발현의 생리학적 이해
식물 백화현상을 잘 이해하려면 먼저 식물 엽록체의 구조와 광합성 시스템 발달 및 작동에 대한 전반적인 이해가 필요하다.엽록체(chloroplast) 구조와 기능
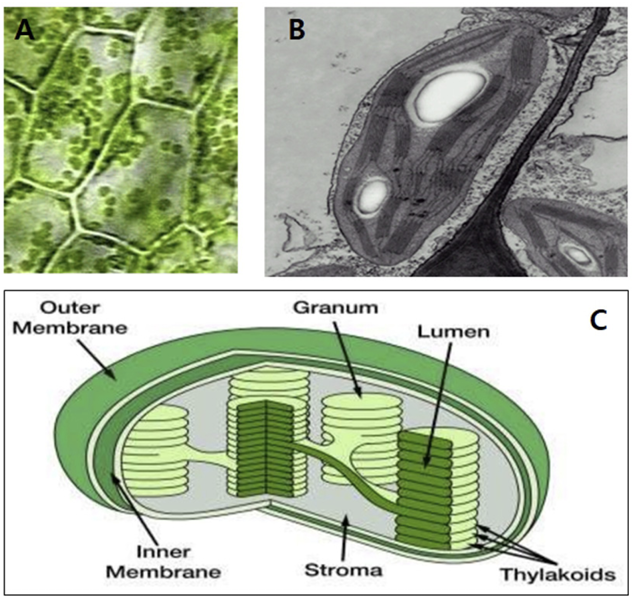
식물 색소체(plastid)의 한가지 유형인 엽록체는 보통 렌즈 모양의 녹색을 띠며 식물 세포내에 수십개(보통 50-60개)가 존재하고 대략 그 크기는 길이 3-10 μm, 두께 1-3 μm 정도이다(Fig. 1). 엽록체는 전색소체(proplastid)로부터 발달되는데 광이 없을 때는 틸라코이드막(thylakoid membrane)을 제대로 갖추지 못하고 prolamellar body가 많은 황색체(etioplast)로 존재하다가 광을 받으면 틸라코이드막이 발달하면서 엽록체로 성장하고 아울러 이들은 자체 분열과정을 통해 여러개로 증식한다. 엽록체는 적어도 3개의 막 시스템(membrane system), 즉 외막(outer membrane), 내막(inner membrane), 틸라코이드막으로 알려진 internal membrane system으로 구성되어있다. 내막과 틸라코이드막 사이의 액체상태 공간을 stroma라고 하며 틸라코이드막이 동전모양으로 축적된 부위를 grana라고 한다. 이들 틸라코이드막은 서로 연결된 상태이고 이렇게 해서 생긴 내부의 빈 공간이 lumen이다(Kirchhoff, 2019)(Fig. 1). Stroma에는 광합성 암반응 관련 효소 및 기타 효소, 전분, 엽록체 DNA, 리보솜(ribosome) 등이 존재한다. 주로 인지질과 당지질로 이루어진 틸라코이드막에는 oxygenevolving complex, photosystem I (PS I), photosystem II (PS II), plastoquinone (PQ), cytochrome (Cyt) b6f, ATP synthase 등과 같은 광계(photosystem) 구성요소들이 막과 결합되어 있으며 아울러 광합성 색소(photosynthetic pigments) 또는 tocopherol과 같은 소수성 분자들도 함께 내재한다.엽록체는 식물세포내에서 빛의 방향과 양에 따라 역동적으로 움직이면서 광합성을 수행하여 에너지를 생성할 뿐만 아니라 당 및 전분, 아미노산, 지방산, 광합성색소, nucleotides (purine, pyrimidine), isoprenoids, nitrite 또는 sulfate의 환원, alkaloids, vitamins, 호르몬 전구체 등 식물체에 필요한 각종 대사산물을 생합성한다(Kirchhoff, 2019). 엽록체는 평균 150 Kb 정도의 유전체를 가지고 있고 자가분열을 하며 자체 내에 rRNA, tRNA 유전자 및 대부분 광합성 기능과 관련된 100150개의 유전자를 가지고 있다. 그렇지만 각종 대사산물을 생성하는데 관련된 많은 효소들은 핵에 암호화되어 있으며 세포질에서 번역된 후 엽록체로 이동하여 대사작용에 관여한다. 따라서 엽록체는 독립적으로 활동하는 것이 아니라 핵과 긴밀히 정보를 상호교환하면서 세포의 기능을 유지시킨다고 이해되어야 한다(Allen and Forsberg, 2001; Albertsson, 2001).
광합성 시스템
엽록체의 가장 대표적인 기능은 광합성으로서, 광합성 색소에 의해 흡수된 빛에너지가 광합성 전자전달계를 통해 화학에너지(NADPH, ATP)로 전환되는 명반응(light reaction)과 생성된 화학에너지를 이용하여 이산화탄소를 탄수화물로 고정시키는 암반응(dark reaction)으로 나눌 수 있다. 식물백화유도는 명반응과 관련이 높기 때문에 명반응에 대해서만 간략히 서술한다.
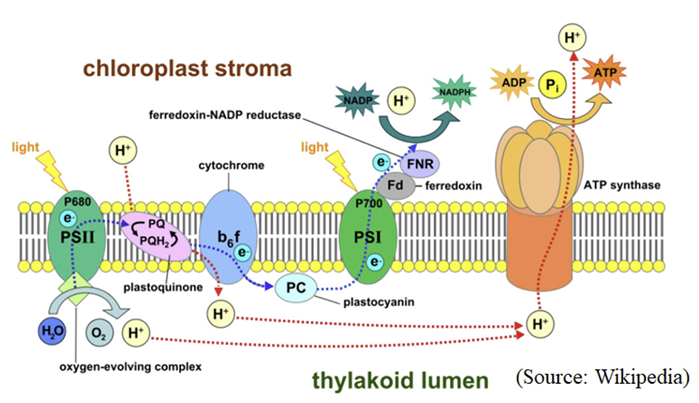
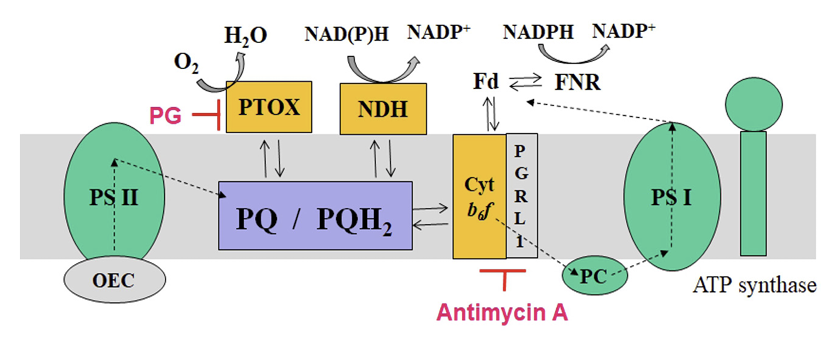
광합성 전자전달계는 크게 4개의 단백질군 (PS II complex, Cyt b6f complex, PS I complex, ATP synthase)의 협력작용에 의해 기능한다. PS II의 light harvesting complex (LHC) protein에 존재하는 chlorophylls 및 carotenoids가 광을 흡수하여 그 에너지를 반응중심(P680+)에 전하고 이로 인하여 여기된 P680은 전자를 PQ에 전달한다. 전자방출로 인해 불안정하게된 반응중심은 oxygen-evolving complex에서 물분해에 의해 생성된 전자를 받아 안정화된다. 한편 여기된 P680로부터 2개의 전자를 받은 PQ는 stroma로부터 2개의 수소 이온(H+)을 받아 plastoquinol (PQH2)로 환원된다. 이후 PQH2은 Cyt b6f 복합체를 통해 수용성 전자 운반체인 plastocyanin (PC)으로 전자를 전달한다. 그리하여 궁극적으로 두 개의 수소 이온(H+)이 틸라코이드 내부(lumen)로 운반되게 된다. 이어서 PC의 전자는 PS I complex로 전달되고 이후 빛에너지를 받아 ferredoxin에 전자가 전달된다. 환원된 ferredoxin은 stroma내의 수소이온(H+)을 이용하여 NADP+를 NADPH2로 환원시키는데 기여한다. 그리고 이상의 광합성전자전달계가 작동되면 두가지 원인, 즉 oxygen-evolving complex에서의 물분해와 PQ pool의 작용에 의해 lumen 측에 양성자(H+)가 축적되어 수소 이온의 전기화학적 기울기가 형성된다. 이렇게 형성된 전기화학적 기울기는 ATP synthase complex를 활성화시켜 ADP와 Pi로부터 ATP를 생성시킨다(Kim et al., 1999a; Malkin and Niyogi, 2000; Wikipedia, 2021) (Fig. 2)
이상과 같은 광합성 전자전달계가 정상적으로 기능을 수행하기 위해서는 광합성계 구성물질이 생합성되고 이들이 정상적으로 틸라코이드 막에 집합(assembly)되어야 한다. 이에는 핵 유전자 발현과 엽록체 유전자 발현의 복잡한 상호 조절작용에 의해 이루어지는데 이러한 광계 구성물질의 집합과 해체(disassembly)는 주변 환경, 식물의 생장상태 등에 따라 역동적으로 일어난다. 특히 주목할 만한 것은 광합성 색소분자나 PQ pool의 산화환원상태, 전자전달 과정중에 생성된 활성산소종 등도 핵 또는 엽록체 유전자 발현에 적극적인 영향을 미치고 있다는 사실이다(Trebst and Depka, 1997; Allen and Forsberg, 2001; Albertsson, 2001; Kirchhoff, 2019).
엽록체내 광보호 시스템
식물 광합성은 산소가 풍부한 대기조건에서 광 및 온도에 의존하여 일어나는 화학반응이기 때문에 자체적으로 활성산소가 손쉽게 발생될 수밖에 없다. 따라서 광량이 적정 수준 이상으로 높거나 저온 또는 과잉의 산소조건 등에서는 광합성 구성성분이 파괴될 뿐만 아니라 더 나아가 막과산화로 진전되어 엽록체 및 세포기능이 저하되거나 파괴될 수 있다. 그렇기 때문에 식물은 이를 대비하여 광합성 효율을 안정적이면서 최대화시키기 위해 여러 가지 안전장치를 갖추어 운용한다. 주요 안전장치로서는 (1) 과잉의 빛에너지를 열로 분산시키는 기능(non-photochemical quenching, NPQ), (2) 생성된 활성산소종의 효소적 또는 비효소적 소거, (3) 대체 전자전달과정(cyclic electron transport, pseudo-cyclic electron f low, chlororespiration and water-water cycle)의 운용, (4) 광흡수 안테나 크기의 조절 등이 있다(Horton et al., 2005; Guidi et al., 2017; Pinnola and Bassi, 2018).
NPQ에 기여하는 기작으로서 2가지가 알려져 있는데 첫째는 xanthophyll cycle로서, violaxanthin (Vio) / antheraxanthin (Ant) / zeaxanthin (Zea) 색소의 상호반응을 통해 singlet Chl state의 에너지가 분산되는 과정이다(Demmig-Adams and Adams III, 1992; Havaux and Niyogi, 1999; Ruban et al., 2007; Jahns and Holzwarth, 2012). 둘째는 lutein (Lut) / neoxanthin의 역할로서 이들 색소분자가 triplet Chl state로부터 에너지를 받아 열로 분산시키거나 main light-harvesting complex (LHC II)의 미세한 구조변형을 일으켜 반응장소로의 산소 접근을 막는 기능을 한다(Mozzo et al., 2000; Ruban et al., 2007; Jahns and Holzwarth, 2012).
한편 광합성 전자전달과정 동안 생성되는 여러 가지 활성산소종(singlet oxygen, triplet oxygen, superoxide radical, hydroxyl radical, hydrogen peroxide 등)의 비효소적 소거에 기능하는 지용성 항산화 물질로서는 carotenoids, tocopherols 및 PQ, 수용성 항산화 물질로서 ascorbic acid와 glutathiones 등이, 항산화 효소로서는 superoxide dismutase, glutathione reductase, ascorbate peroxidase, monodehydro reductase, dehydro ascorbate reductase, catalase 등이 엽록체 내에서 서로 잘 연계되어 소거 역할을 한다(Guidi et al., 2017). 이들 중 활성산소종에 대한 Cars의 물리화학적 소거기능을 보다 구체적으로 살펴보면, PS II와 PS I의 core complex에 위치한 β-carotene은 Chl triplet와 singlet oxygen을 소거시키며(Cazzaniga et al., 2012) lutein도 마찬가지이다. Neoxanthin은 superoxide anion을 소거시킨다(Dall’Osto et. al., 2007). 이외에 Cars는 틸라코이드막의 구조와 유동성에도 영향을 미쳐 막의 안정화를 유도하여 막과산화를 방지하는 기능을 보유하고 있다고 한다(Domonkos et al., 2013). 아울러 PQ 또는 PQH2 자체, PQ로부터 파생된 plastochromanol-8은 liposomes에서 지질과산화를 tocopherol만큼이나 억제한다고 한다(Nowicka et al., 2013). PQ-9는 singlet oxygen을 소거함에 있어서 환원형 PQ-9가 산화된 PQ-9보다 우수하며, 아울러 환원형 PQ-9는 superoxide와 hydrogen peroxide도 소거한다(Kruk et al., 2003; Khorobrykh and Tyystjärvi, 2018). 따라서 PQ-9은 PS II center에 결합된 carotene 분자의 작용을 보조하면서 광합성과정상에서 생성된 활성산소종을 방어함에 있어서 최전선에 위치해 있는 것 같다고 한다(Ksas et al., 2018; Havaux, 2020).
식물 백화유도 기작
일반적으로 식물의 하얀 조직은 주로 꽃잎 또는 뿌리에서 관찰되는데 이는 세포내에 가시광선 흡수 물질이 없는 색소체(백색체)만이 발달되어 있기 때문이다. 그러나 보통의 식물 잎·줄기 등에서는 분화 조직세포내의 proplastid가 황색체(etioplast) 및 엽록체로 발달되면서 광합성 색소가 생성되어 녹황색 또는 녹색 등을 띤다. 그런데 이러한 정상식물일지라도 어떤 원인에 의해 엽록체가 잘 발달되지 못하고 광합성 색소가 소실되어 식물조직이 하얗게 변화되는 소위 백화현상이 나타날 수 있다. 이러한 식물백화는 유전적 결함, 화학물질 처리, 환경 요인 등에 의해 나타날 수 있으나 본 논문에서는 화학물질 처리에 의해 발현되는 백화에 대해서만 기술하고자 한다.
식물백화는 궁극적으로 광합성 색소 미생성 또는 소실에 의해서 나타나는 것이다. 물론 엽록체와 관계없이 액포에서 주로 자색을 발현하는 안토시아닌 색소가 활발히 생성되지 않은 식물조직을 전제로 하였을 때의 이야기이다. 따라서 단순하게 생각해 볼 때, 식물의 백화는 Chls와 Cars 생합성 저해물질들을 함께 처리한 경우에 유도될 수 있다. 즉, Chls 생합성 과정만 저해하면 Cars 색소 발현때문에 황색 또는 적색의 식물조직이 나타날 수 있고, 반대로 Cars 생합성만을 저해시키면 미약하나마 녹색을 띠는 조직이 발달될 수 있기 때문이다. 그런데 실제는 적어도 두가지 조건이 충족되어야, 즉 틸라코이드막이 어느 정도 정상적으로 유지된 채, 막내에 유입된 광합성전자전달계 단백질 복합체 및 광합성 색소의 소실이 일어났을 때에 백화현상이 나타난다. 따라서 이미 발달된 조직보다는 분화되어 발달되기 시작하는 세포조직, 즉 발아되어 어린 식물이 성장할 때나 또는 생장점 부위에서 새롭게 발육성장하는 조직에서 여러가지 원인에(색소생합성 저해, PQ 및 tocoperol 생합성 저해, 활성산소종 소거기능의 효소 저해 등) 의해 광합성전자전달계 파괴/광합성색소 소실이 일어날 때 백화현상이 쉽게 유도된다. 이렇게 하여 백화가 일단 일어나면(틸라코이드막 막과산화가 낮은 상태에서 광합성 색소가 소실되고 광합성전자전달계가 파괴되면) 엽록체로부터의 활성산소 생성능력이 현저히 감소되기 때문에 이후의 강광조건에서도 조직이 비교적 건전한 상태로 하얗게 남아있게 된다. 이들 백화조직은 종자 또는 주변 조직으로부터 영양이 지속적으로 공급될 경우 한동안 생존하거나 일부 성장하기도 한다(Kim et al., 2004b). 따라서 식물재료, 처리부위 및 처리시기, 처리후 생장환경의 조절 등을 통해 백화정도가 다른 여러 식물체 또는 조직이 만들어질 수 있다(Fig. 3). 그러면 왜 이미 발달된 조직에서는 백화가 일어나지 못할까? 그 이유는 성숙잎에서 광합성전자전달계가 활발히 작동되고있는 상황에서는 화합물 처리에 따른 다음의 두가지 생리반응으로 나타나기 때문인 것 같다. 첫째는 화합물 처리에 의해 갑자기 대량발생된 활성산소의 강한 산화작용으로 인해 색소파괴(탈색)와 함께 세포자체가 괴사되어 소위 burning effect가 나타나기 때문에 백색이 아닌 회갈색을 띤다. 다른 한 결과로서는 식물 자체가 보유하고있는 항산화시스템(antioxidant system)의 적극적인 방어작용으로 인해 정상에 가까운 상태로 유지되기 때문이다.
식물의 백화를 유도시키는 여러 가지 화학물질의 작용생리와 특성
식물 백화를 유도시키는 제초활성물질에 대한 보고는 1950년대부터 인 것 같다(Kraehmer et al., 2014). 현재까지 백화유도 상업용제초제에 국한하여 연구보고된 작용점(action site)을 분류하면 총 8가지가 알려져 있지만(Table 1), 연구중에 있는 것 까지 포함하면 적어도 10가지 이상이 되는 것으로 파악되며 이에 대해 관련 화합물, 작용생리 및 특징들에 대해서 작용점 위주로 요약하고자 한다.
Plastid isoprenoid biosynthesis 저해제
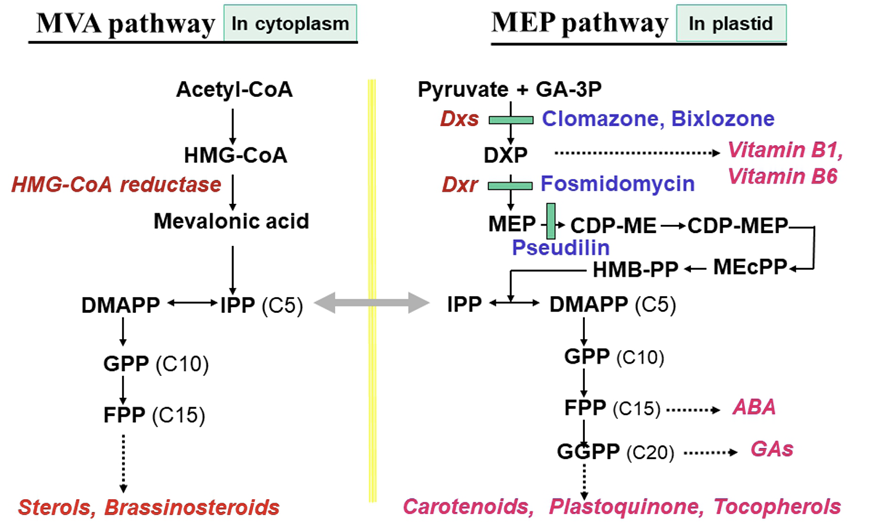
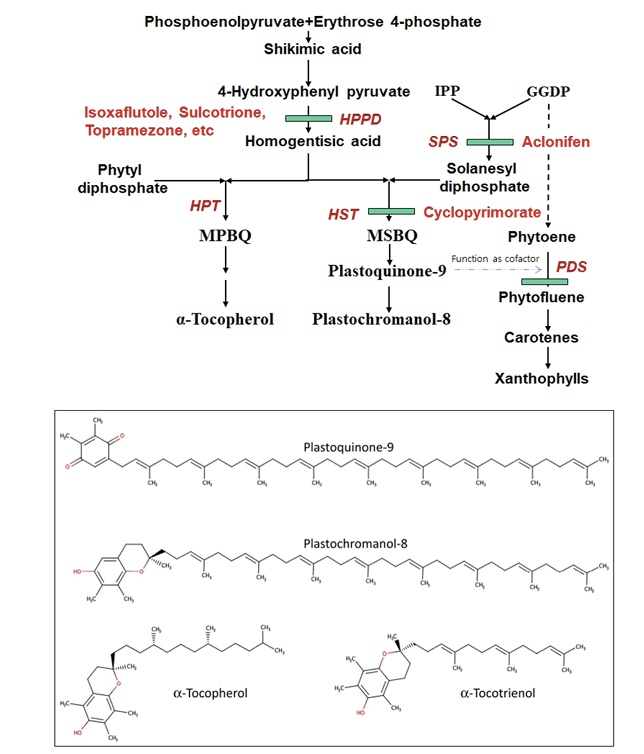
Isoprenoids에 속하는 carotenoids, phytol, tocopherol, quinones 등은 분자내에 prenyl 그룹을 함유하는 물질로서 생물계에서 매우 중요한 생리적 역할을 수행하고 있다. 이들 prenyl 그룹은 isoprene 전구체인 isopentenyl pyrophosphate (IPP) 또는 dimethylallyl pyrophosphate (DMAPP)의 축중합에 의해 생성되는데, 식물계에서의 IPP 생합성 과정은 두개의 다른 경로가 존재하는 것으로 알려지고 있다. 하나는 세포질에서 acetyl-CoA을 출발물질로 하여 생성되는 mevalonate pathway (MVA pathway)와 다른 하나는 엽록체에서 pyruvate와 glyceraldehyde 3-phosphate (GAP)을 출발물질로 하여 IPP를 만드는 2C-methyl-D-erythritol 4-phosphate (MEP) pathway (non-mevalonate pathway)이다. 이중에서 MEP pathway를 보다 상세히 설명하면 pyruvate이 GAP와 결합하여 DXP synthase (DXS)에 의해 1-deoxy-D-xylulose 5-phosphate (DXP)가 생성된다. 이후 DXP는 DXP reductoisomerase (DXR or IspC)에 의해 MEP가 생성되고 MEP는 CDP-ME, CDP-MEP, MEcPP, HMB-PP를 거쳐 IPP 또는 DMAPP가 생성된다(Banerjee and Sharkey, 2014). 이후 IPP 또는 DMAPP는 여러 단계의 축중합을 통해 carotenoids, phytol, tocopherol, quinones, ABA, GA 등의 생합성 기질로서 기여한다(Fig. 4).
IPP 또는 DMAPP 생합성 과정상에서, MEP pathway 초기단계의 효소작용을 저해하는 백화유도 제초제가 보고되고 있다. 첫째는 1-deoxy-D-xylulose 5-phosphate synthase (DXS) 저해제로서 대표적인 화합물은 clomazone과 bixlozone 이다. Clomazone은 1980년대 중반에 합성되었으며 그 자체는 proherbicide라서 식물체에 흡수된 후 5-keto형으로 대사된 후(EINaggar et al., 1992) 5-keto clomazone이 DXS를 저해한다(Mueller et al., 2000; Ferhatoglu and Barrett, 2006). 이후 2020년경엔 clomazone과 동일 계열 화합물인 bixlozone이 밀/보리/카놀라용 토양처리 제초제로서 출시되었다. 둘째는 MEP pathway 초기단계의 두번째 효소인 DXR (IspC) 작용을 저해하는 화합물들이다. 대표적인 화합물로서 제초제로 상용화되지는 않았으나 항말라리아제로 개발된 fosmidomycin이 있다(Schwender et al., 1999; Phaosiri and Proteau, 2004; Ferhatoglu and Barrett, 2006) (Fig. 4). 최근에 Wu et al. (2023)은 fosmidomycin 유도체를 합성하여 fosmidomycin보다 제초활성이 우수한 10g라고 하는 화합물을 개발하였다고 보고하고 있다. 셋째는 MEP pathway 초기단계의 세번째 효소인 4-diphosphocytidyl-2C-methyl-D-erythritol(CDP-ME) synthase (IspD) 작용을 저해하는 화합물이다. 이는 MEP로부터 CDP-ME가 생성되는데 관여하는 단계의 효소로서 항말라리아 및 제초제의 중요한 타겟으로 인정되어 pseudilin, phenyliosxazole, phenylpyrazole, aminobenzothiazole 등의 화합물이 소개되었으며(Schwab et al., 2017; Witschel et al., 2013; Wang et al., 2020), 최근엔 신규 시아노박테리아 방제제로서 본 효소를 저해하는 bromo-N-phenyl-5-ohydroxyphenylpyrazole-3-carboxyamides 성분이 새롭게 보고되었다(Wang et al., 2023).
Carotenoid biosynthesis 저해제
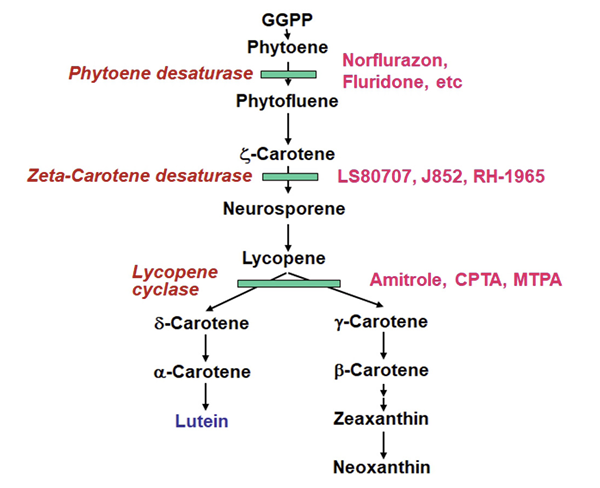
Carotenoid 분자는 엽록체에서 생합성 되는데 초기 생합성 기질은 IPP와 DMAPP로서 이들이 결합하여 탄소수가 10개인 geranyl pyrophosphate (GPP), GPP에 다시 IPP가 중합되어 탄소수가 15개인 farnesyl pyrophosphate (FPP)가 생성되며, FPP에 다시 IPP가 중합되어 탄소수가 20개인 geranyl geranyl pyrophosphate (GGPP)가 생성된다. 이후 phytoene synthase에 의해 2분자의 GGPP가 축중합되어 탄소수가 40개인 phytoene이 만들어진다. 이어서 phytoene은 phytoene desaturase (PDS)에 의해 2회의 불포화 반응(desaturation)으로 zeta-carotene이 생성되며 다시 zeta-carotene desaturase (ZDS)에 의해 2번의 불포화 반응으로 lycopene이 생합성된다. Lycopene은 cyclase의 작용으로 α–carotene 또는 β–carotene이 생성되고, 이어 이들 carotenes는 여러 효소의 hydroxylation 및 epoxidation 작용을 통해 분자내에 산소를 가진 xanthophylls 분자가 만들어진다. 한편 xanthophylls는 epoxycarotenoid dioxygenase에 의해 ABA로 전환되기도 한다 (Fig. 5).
Cars는 광합성 화학반응에 필요한 광에너지를 흡수할 뿐만 아니라 활성산소종을 소거하거나 막과산화를 방지하는 항산화 역할을 수행하기 때문에 이들 생합성 과정이 억제되었을 때에는 식물생존에 매우 심각한 결과가 초래될 수 밖에 없다.
Phytoene desaturase (PDS) 저해제
1970년대 초반 각종 화합물이 개발되고 이들이 PDS를 저해하는 것 같다는 간접적인 보고가 1978년에 발표된 이후(Bartels and Watson, 1978), PDS가 norflurazon의 제1차 작용점이라는 사실이 1989년 보고되었다(Sandmann et al., 1989), PDS는 카로티노이드 생합성저해제의 대표적인 작용점으로서 norflurazon, fluridone, flurtamone 등이 PDS를 비경쟁적으로 저해(non-competitive inhibition)한다(Sandmann et al., 1996). 90년대 후반들어 PDS를 저해하는 새로운 화합물(pyrazolylpyrimidine 계)이 듀퐁회사에서 개발되어 소개되었는 바 이는 diflufenican에 비해 약 10배 이상의 활성을 가져 5-15 g ha-1 수준에서도 제초활성을 나타낸다. 이어 beflubutamid가 2004년에 출시되었는데 이의 작용점이 PDS로 보고되었다 (Takamura et al., 1999). 최근엔 보다 새로운 구조의 PDS 저해제 개발이 가능하도록 PDS 단백질 구조분석과 제초제 결합 위치 해석 및 반응화학을 연구하고 있는데 PDS 활성위치로의 norflurazon 결합이 PQ과 비슷한 것 같다고 하였다(Brausemann et al., 2017).
PDS가 저해되면 phytoene 또는 phytofluene이 축적되고 체내의 carotenes 및 xanthophylls의 함량은 현저히 감소한다(Böger, 1996). 이미 발육된 잎조직에 화합물을 처리할 경우, 약제처리후 2일째에 광합성전자전달이 현저히 감소되기 시작하며 이어서 엽록소 파괴와 잎의 괴사가 동반되었다(Kim et al., 1999a). 이는 엽록체 틸라코이드막 내 광합성계의 카로티노이드 성분(β-carotene 또는 lutein) 감소로 인하여 항산화 기능이 저하되어 photosystem이 분해됨과 동시에 photosystem assembly가 제대로 이루어지지 않아 결국 전자전달계로부터 활성산소가 많이 발생하기 때문이다. 광도가 증가할수록 제초활성이 강하게 발현되는 이유도 이 때문일 것 같다. 한편 새롭게 분화되기 시작하는 잎에서는 이와는 다른 기작으로 활성이 발현되는 것 같다. 즉 Cars 함량 감소는 정상적 광합성계를 가지는 엽록체로의 발달을 불가능케 한다(Depka et al., 1998; Bolychevtseva et al., 1995). 따라서 잎이 발육되기 시작할 때부터 백화되어 성장하게 되며 이와 같이 백화된 조직에서는 광합성자체가 일어날 수 없기 때문에 활성산소의 발생도 거의 일어나지 않거나 현저히 약해질 것이다. 실제 백화잎은 강광조건에서도 생각보다 상당히 오랫동안 생존함은 이를 반증해주는 것이다. 따라서 이 경우는 엽록체에서의 항산화물질 감소로 인한 산화적스트레스로 죽는다기보다는 오히려 광합성 불능으로 인한 탄수화물 부족에 의해 죽음에 이르게 된다고 여겨진다(Kim et al., 2001; Kim et al., 2004b). 이와 같은 이유 때문에 전체적인 제초증상은 분열조직을 중심으로 백화가 유기되며 발달된 잎이 위조 및 괴사되는 것이 특징이다. 내성식물 또는 저농도 처리에서는 엽맥이 백화되기도 하는데 이는 처리된 제초제가 물관부 이동을 주로 하기 때문이다.
ζ-carotene desaturase (ZDS) 저해제
ZDS 저해제 발견은 1985년대 이후부터 이루어졌으나 PDS 저해제보다 적게 보고되고 있고, 현재 이를 작용점으로하는 상업용 제초제는 없는 형편이다. ZDS를 주요 작용점을 하는 기존 화합물들은 LS 80707 (Sandmann et al., 1985, Chollet et al., 1990), J852 (Simkin et al., 2000, Breitenbach et al., 2002), RH-1965 (Burdge, 2000)등이 있다. 한편 ZDS 돌연변이주들(예, zds 와 ale1 mutant)이 알비노 증상과 더불어 생육저해가 동반된다고 하는 것으로 보아(Breitenbach et al., 2002) 추후 신규 백화유도 화합물 발굴을 위한 작용점의 하나가 될 수 있다고 여겨진다.
Lycopene cyclase 저해제
상업용 제초제들중 1950년대 중반에 개발된 amitrole이 lycopene cyclase를 주로 저해하며(Grumbach and Britton, 1983; Barry and Pallett, 1990; Agnolucci et al., 1996), lycopene β-cyclase 유전자가 과발현된 담배는 amitrole과 amitrol proherbicide인 hydroxytriazoleopyrimidines에 대해 저항성을 나타내었다는 결과를 얻어(Clough et al., 2016) amitrole 작용점이 lycopene cyclase임을 확증하였다. 한편, 상업용 제초제로 널리 사용되고 있지는 않지만 nicotine, 2-(4-chlorophenylthio)triethylamine (CPTA), N,N-diethyl-N-[2-(4-methylphenoxy)ethyl]amine (MTPA) 등(Schnurr et al., 1998)과 N,N-diethyl-N-(2-undecynyl)amine (NDUA) (Fedtke et al., 2001)이 neurosporene으로부터 β-carotene을 촉매하는 lycopene cyclase를 저해하는 것으로 보고되었다. 이들은 처리시 lycopene이 축적되면서 α–caroene 함량은 낮아지는 특징을 가진다. 생리적으로 볼 때 Cars 생합성 과정의 비교적 후단계를 저해하기 때문에 백화발현 정도가 뚜렷하지 못하거나 또는 상대적으로 낮은 살초작용을 보일 수도 있다.
Plastquinone (PQ) 생합성저해제
식물에서 PQ는 광합성전자전달계의 전자운반체로서 중요한 역할을 할 뿐만 아니라 Cars 생합성과정의 불포화 반응(desaturation reaction)을 포함한 각종 대사과정의 산화환원제로서 작용한다(Havaux, 2020). 즉 PQ pool의 산화환원(redox) 상태는 chlorophylls, carotenoids, Vitamin K, plastochromanol, hydrogen peroxide 등과 같은 대사물질 생합성, STN7 kinase나 Lhcb1과 같은 유전자의 발현, 광적응 과정 등과 연계되어 조절역할을 한다. 그리고 PQ 자체는 식물의 활성산소종을 소거하거나 지질과산화(lipid peroxidation)를 경감시키는 강력한 항산화제 기능을 갖고 있어서, PSII에 있는 β–carotene과 thylakoid lipid phase에 있는 tocopherols의 광보호(photoprotection) 기능을 보강해준다(Liu and Lu, 2016; Havaux, 2020). 따라서 이러한 다양한 기능의 PQ가 생합성되지 않거나 기능 이상이 생기면 활성산소 발생, 막과산화, 광합성계 붕괴와 같은 과정으로 빠른 죽음에 이르게 된다(Sekino, 2002; Kim et al., 2002).
한편 tocopherol 또는 tocotrienol은 식물에서 매우 높은 항산화작용을 가지는 것으로 알려지고 있는데 흥미롭게도 PQ와 tocopherol/tocotrienol의 생합성은 prenyl group이 결합되기 이전의 초기단계과정을 공유하고 있다(Fig. 6). 즉 shikimic acid pathway를 거쳐 형성된 tyrosine은 tyrosine amino transferase (TAT)에 의해 hydroxyphenylpyruvate (HPP)로 전환되고 이는 p-hydroxyphenylpyruvate dioxygenase (HPPD) 효소에 의해 산화되어 homogentisic acid (HGA)가 되는데 PQ, tocopherol 및 tocotrienol은 HGA를 공통의 기질로 하여 생합성 된다(Havaux, 2020).
PQ는 HGA와 solanesyl diphosphate가 homogentisate solanesyl transferase (HST) 효소에 의해 결합되어 생성된 2,3-dimethyl-6-solanesyl-1,4-benzoquinol (MSBQ)로부터 생합성이 진행된다. 여기에서 C45 solanesyl diphosphate은 GGDP (C20)에 5분자의 IPP가 solanesyl diphosphate synthase (SPS)에 의해 축중합(condensation)되어 생성된 것이다(Fig. 6).
한편 tocopherol류는 HGA와 phytyl diphosphate가 homogentisate phytyl transferase (HPT) 효소에 의해 결합되어 생성된 2-methyl-6-phytyl-1,4-benzoquinol (MPBQ)로부터 생합성이 진행된다. 여기에서 phytyl diphosphate은 GGDP로부터 GGDP reductase에 의해 생성되거나, phytol로부터 phytol kinase와 phytyl phosphate kinase의 작용으로 생성된다(Fig. 6). 그리고 tocotrienol류는 HGA와 GGDP가 homogentisate geranylgeranyl transferase (HGGT) 효소에 의해 결합되어 생성된 2-methyl6-geranylgeranyl benzoquinone (MGGBQ)로부터 생합성이 진행된다. 따라서 이들 과정은 식물체의 생명유지와 직접적인 관계가 있다고 생각되며, 생합성 초기단계에 이상이 생기면 PQ와 tocopherol 생성량이 변화되어 생리작용에 있어서 보다 큰 장해가 일어나게 된다.
4-Hydroxyphenylpyruvate dioxygenase (HPPD ) 저해제
HPPD 저해제는 백화유도 화합물 중에서 가장 활발히 연구 개발되고 있는 부문이다. 이들의 개발 역사를 보면, 1975년에 pyrazolate계 화합물로서 pyrazolynate가 처음으로 소개되었고, triketone류는 1985년에 sulcotrione이, isoxazole류 화합물은 1998년에 isoxaflutole이 소개된 이후 30-40년동안 매우 다양한 구조의 화합물류가 개발되었고 (Table 1, Kraehmer et al., 2014; Ndikuryayo et al., 2017), 최근에도 새로운 구조의 HPPD 저해제로서 bipyrazone (Wang et al., 2020), fenquinotrione (Yamamoto et al., 2021), triketone-quinoxaline 유도체 (Zeng et al., 2022) 등이 소개될 정도로 그 다양성이 확장되고 있다. 한가지 흥미로운 사실은 HPPD 저해제들 중에서는 다른 작용기작 그룹 화합물들에 비해 많은 수의 proherbicide가 보고되고 있다는 것이다. Isoxazole계 proherbicide는 식물체에 흡수된 후 diketonitrile로 전환되어 작용하고, pyrazole계 proherbicide는 hydroxypyrazole (예, destosyl pyrazolate)로 전환되며, benzobicyclon은 식물체에 흡수된 후 활성형인 benzobicyclon hydrolysate로 전환되어 제초작용을 나타낸다고 한다.
한편 천연물에서도 HPPD 저해제가 발굴되었는데 manuka (Leptospermum scoparium) 식물에서 분리한 leptospermone, bottlebrush (Callistemon spp.) 식물 유래의 leptospermone에서 파생된 nitisinone (NTBC), 지의류 식물인 Alectoria sarmentosa에서 분리한 usnic acid, Pinus 및 Eucalyptus 등의 여러 식물에서 분리한 pinocembrin 등이 이에 속한다. (Dayan et al., 2007; Santucci et al., 2017)
Triketone류가 HPPD를 저해한다는 사실은, 이들을 식물체에 처리시 tyrosine 수준이 현저히 증가하는 대신에 PQ 농도가 저하된다는 발견과 함께 밝혀지게 되었으며 (Lee et al., 1997), pyrazolate계 화합물도 동일하게 HPPD를 저해한다는 사실이 Matsumoto et al. (2006)과 Grossmann and Ehrhardt (2007) 등에 의하여 보고되었다. 이후 여러 생물체에서 HPPD 단백질이 분리되어 그 결정구조가 밝혀지고 있으며 저해물질의 작용위치 및 저해기작이 구명되면서 현재는 단백질과 저해화합물의 결합원리를 통해 새로운 구조의 HPPD 저해제를 in silico 수준에서 개발하고 있는 상황이다(Ndikuryayo et al., 2017; Santucci et al., 2017; Lin et al., 2019; Zeng et al., 2022).
PQ는 전자운반체로서 역할 이외에 PD의 cofactor로도 작용하기 때문에(Mayer et al., 1990; Norris et al., 1995) PQ 형성이 감소되면 광합성전자전달계가 장해를 받음(Kim et al., 1999a)과 동시에 PD활성도 낮아져 유색 카로티노이드가 만들어지지 못하게 된다. 그 결과 카로티노이드생합성 저해기작에서 언급된 바와 같은 과정으로 분열조직에서는 백화현상이 나타나고 발육된 조직에서는 잎의 괴사가 동반되는데 특히 발육된 조직에서는 PQ 및 카로티노이드 감소로 인한 광합성 전자전달저해가 살초기작에 더욱 크게 기여한다고 한다(Kim et al., 2002). 한편 tocopherol은 특히 엽록체막에서 강한 항산화제 역할을 가짐으로 HPPD 저해로 인해 이의 형성이 억제되면 엽록체의 엽록소 소실 및 틸라코이드막 파괴가 더욱 촉진될 것이다.
Homogentisate solanesyl transferase (HST) 저해제
HST는 PQ-9 생합성에 있어서 HPPD 다음 단계의 효소로서 HGA에 solanesyl diphosphate를 전이시켜 2,3-dimethyl-6solanesyl-1,4-benzoquinol (MSBQ)를 생합성하는 역할을 한다. 따라서 HST가 저해되면 HGA의 축적과 함께 PQ 수준이 감소되지만(Shino et al., 2018) HPPD저해에서와 같은 tocopherol 억제는 관찰되지 않을 것이다. HST 저해제로서 haloxydine이 2010년 처음으로 알려졌지만 아직 상업화되지 못했고, 현재 상업용 제초제중에서 HST를 작용점으로 하는 화합물로서는 cyclopyrimorate이 보고되고 있다(Shino et al., 2018). Cyclopyrimorate은 proherbicide로서 식물체에 처리되면 활성형인 des-morpholinocarbonyl cyclopyrimorate (DMC)로 대사되어 HST를 저해한다(Shino et al., 2018).
Solanesyl diphospahte synthase (SPS) 저해제
탄소 45개를 가진 solanesyl diphosphate은 GGDP (C20)에 5분자의 IPP가 SPS에 의해 축중합(condensation)되어 생성된 것이다. 그동안 이를 저해하는 화합물은 알려지지 않았지만 최근 Kahlau et al. (2020)의 보고에 의해 aclonifen이 이를 저해함이 구명되었다. 일반적으로 diphenylether계 화합물은 protoporphyrinogen IX oxidase를 저해하여 burning effect 증상을 초래하지만 독특하게도 1983년에 출시된 aclonifen은 phytoene을 축적시키면서 식물백화를 유도하여(Kilinc et al., 2009) 그 작용기작에 대해 궁금증을 안겨 왔었다.
기타
지금까지는 작용점이 분명하게 구명된 화합물과 이들의 작용점을 기술하였다. 그러나 실제 식물백화를 유도시키지만 아직까지 작용점이 불분명하며 상업화되지 않은 몇몇 화합물이 보고되고 있다.
Chloramphenicol은 세균 내 50S 리보솜에 결합하여(특히 23S rRNA의 A2451 및 A2452 잔기에 결합함) tRNA의 아미노 말단과 50S 리보솜 소단위 수용체 부위의 결합을 방해하여 펩티드 전이효소와 아미노산 기질 간의 상호작용이 일어나지 못하게 하고, 펩티드 결합 형성(protein elongation)을 저해하여 세균의 단백질 합성을 억제하는 항생제로 보고되어있다(Wikipedia, 2021). 식물에 처리될 경우 chlorampenicol은 세균에서와 같은 기작으로 엽록체내 광합성계 구성 단백질의 형성 또는 재생을 억제하여(Mulo et al., 2003; Chow et al., 2005) 틸라코이드막내 광계 형성을 저해하거나 와해시키고 이로 인해 활성산소 발생이 증가되며 이로 인해 광합성 색소가 파괴되어 백화가 유도되는 것으로 추정된다. 이와 더불어 chlorampenicol이 광계 I에서 전자를 직접 받거나(Okada et al., 1991) 또는 광계 II에서 전자를 받아(Rehman et al., 2016) 주변 산소에 전달함으로서 superoxide 생성을 유도하여 광피해(photodamage)를 증진시킨다는 실험결과들도 보고되고 있다.
한편 Streptomyces 균주로부터 분리동정한 methoxyhygromycin도 온실조건 토양처리시 식물생장억제와 함께 백화를 유도시키면서 잡초를 죽이는 제초활성을 나타내었다(Lee et al., 2003). 아직 백화유도의 정확한 기작이 실험적 근거로 밝혀지지는 않았지만 chloramphenicol 관련 연구보고를 검토해 볼 때 유사한 작용기작을 가질 것으로 추정된다. 왜냐하면 methoxyhygromycin은 hygromycin A와 매우 유사한 화학구조를 갖고 있으며, hygromycin A는 chloramphenicol과 비슷하게 ribosomal peptidyl transferase를 억제하여 단백질 생합성을 억제하는 항생제 효과를 가지는 것으로 보고되었다(Guerrero and Modolell, 1980; Hayashi et al., 1997; Kaminishi et al., 2015). 따라서 추가적인 작용으로서 chloramphenicol에서처럼 엽록체 틸라코이드막에서의 광합성계에 영향을 미쳐 전자전달계 구성 단백질 복합체 형성을 저해할 뿐만 아니라 superoxide와 같은 활성산소 생성을 촉진시켜 백화를 유도시킬 가능성이 높을 것 같다.
Antimycin A는 cytochrome c reductase의 Qi에 결합하여 ubiquinol을 ubiquinone으로 산화시키는 과정(산화적 인산화 과정)을 저해하는 호흡저해제로 알려져 왔다. 이로 인해 미토콘드리아에서의 ATP 생합성이 저해되고 아울러 활성산소 superoxide가 발생된다. 이와 유사한 반응이 광합성전자전달계에서도 일어나 순환적 전자전달이(ferredoxin quinone reductase pathway) 억제됨이 발견되었다. 즉 틸라코이드막에서의 PQ pool의 기능을 직·간접적으로 방해하고(Taira et al., 2013; Grabsztunowicz et al., 2019) 활성산소를 발생시켜 광합성색소를 파괴, 식물의 백화를 유도시키는 것 같다.
Propyl gallate는 plastid terminal oxidase (PTOX) 저해활성이 있고(Einall and Shariati, 2012; Grabsztunowicz et al., 2019), PTOX 기능에 이상이 있으면 식물의 백화가 유도됨이 확인되고 있다(Carol et al., 1999; Carol and Kuntz, 2001). 상기 언급된 바와 같이 PTOX는 PQ pool의 산화환원에 관여되면서 chloro-respiration에 기능하는 효소로서 광합성전자전달계의 PQ 작용과정과 연계되어 있고 아울러 PDS 효소는 PTOX에 의한 PQ-9 oxidation을 요구하고 있기 때문에(Carol et al., 1999) PTOX 기능 손실에 의해서 carotenoid 생합성 저해와 광산화 피해가 함께 일어나 백화가 유도되는 것 같다(Foudree et al., 2012). 이에 대한 직접적인 증거로서 PTOX가 결여된 애기장대 돌연변이체(immutans)를 분석해 본 결과(Carol et al., 1999; Foudree et al., 2012), PTOX에 의한 PQ-9 재산화가 일어나지 못해 PDS가 기능하지 못하였고 이로 인해 carotenogenesis가 억제되어 결국 광합성 색소 결핍으로 백화부위가 발생하는 것으로 여겨졌다. 따라서 PTOX 저해제도 백화유도 화합물의 한가지 작용점이 될 수 있을 것으로 추정되지만 아직까지 이를 작용점으로 하는 화합물 개발 연구는 거의 진행되지 않았다(Fig. 7).
식물 백화유도 화합물의 작용기작 기초 연구법
이상에서 살펴본 바와 같이, 식물 백화를 유도하는 화합물은 수십가지가 알려져 있고 그 구조가 상당히 다양하며 이들의 작용점은 적어도 10가지 이상으로 나눌 수 있다. 따라서 미지의 화합물을 식물체에 처리하였을 때 백화 증상이 나타날 경우, 해당 화합물이 대략 어느 그룹에 속하며 작용점이 신규인지의 여부를 신속히 판단하는 것은 신규 제초제 개발 과정에 있어서 매우 중요하다. 특히 보다 저비용으로 이를 해결하기 위해서는 먼저 in vivo 생물검정법을 통해 간이 구별을 수행하고, 이어서 생화학적 또는 분자생물학적 방법을 동원하는 점진적 연구방법을 통해 작용점을 구명해 가는 것이 바람직 할 것이다. 본 장에서는 이러한 접근법을 통해 작용기작 연구를 수행하는데 있어서 도움이 될 수 있는 연구내용들을 간략히 기술한다.
In vivo 생물검정법
식물체 조직 또는 기관을 재료로 하여 비교적 간단한 실험과정을 거쳐 작용기작을 대략 구별할 수 있는 몇 가지 방법을 소개하고자 한다.
첫째는 오이 자엽검정법(Cucumber cotyledon assay)으로서 황화오이자엽에 약제를 처리한 후 1일동안 암배양하고 이어 약광에서 4시간 동안 광조사 한 다음, 암배양 동안의 protochlorophyll(ide) 함량과 광조사 초기의 엽록소 증가 여부를 조사함으로서 세가지 유형의 화합물, 즉 DXS 저해제(예, clomazone), PDS 저해제(예, norflurazon), HPPD 저해제(예, sulcotrione)를 비교적 손쉽게 구별할 수 있다(Kim et al., 2000). 이 때 HPPD 저해제는 광합성 색소의 Chls/Cars 함량비율이 무처리구와 비슷하지만, PDS 저해제는 Cars 함량이 상대적으로 더 감소시켜 Chls/Cars 함량비율이 높아지게 되므로 이들 차이로도 구별할 수 있다고 하였다(Kim et al., 2002).
둘째는 벼 유묘검정법 (Rice seedling assay)으로서, 1.0 mM HPPA가 함유된 또는 함유되지 않은 제초제 시험용액에 각각 최아된 볍씨를 치상하여 7-8일간 키운 다음, 신초길이와 광합성 색소함량을 조사하여 DXS, PDS, HPPD 저해제를 비교적 손쉽게 구별할 수 있다(Kim et al., 1997). 여기에서 PDS 및 HPPD 저해제를 발아전에 처리하였을 때 벼의 유묘가 무처리보다 신장이 촉진되는 것은, GGPP 축적으로 인한 GA 생합성 증진과 xanthophylls 생성 억제로 인한 ABA 생합성의 감소 때문일 것으로 추정되었다(Stegink and Vaughn, 1988; Böger, 1996; Kim et al., 1997).
셋째는 엽록소형광 분석을 통해서 얻어진 값들(PSII quantum yield, Quenching analysis)과 제초활성-quantum yield와의 상관성 분석 병행을 통해 여러 작용기작의 제초제 그룹을 작용유형별로 대략 분별할 수 있다(Kim et al., 1999a; Kim et al., 2002; Kim et al., 2004a). 이 때 기질, 저해제, 기타 성분의 차등 공급(Einall and Shariati, 2012; Taira et al., 2013) 또는 nonphotochemical quenching의 시간별 변화과정 분석(qE, qZ, qH, qI) 등을 통해 (Jahns and Holzwarth, 2012; Pinnola and Bassi, 2018) 좀 더 다양한 작용점 유형의 구별이 가능하다.
기이 외에 식물체 조직이나 엽록체 기관에 약제를 처리한 후 색소를 추출하여 대사물질의 증감 변화를 조사함으로써 차이를 구별해 내기도 한다(Sandmann et al., 1985; Burdge, 2000; Fedtke et al., 2001; Ferhatoglu and Barrett, 2006). 예를 들면, HPLC를 이용하여 PQ와 homogentisic acid (HGA) 함량 증감차이 분석을 통해 HPPD 저해제인 mesotrione과 달리 cyclopyrimorate가 HST 저해제임을 구별하였다(Shino et al., 2018).
생화학적(효소 수준) 또는 분자생물학적 검정
식물체로부터 효소를 직접 추출하거나 작용점 유전자를 클로닝하여 이를 대장균에 과대발현시켜 대량의 효소를 얻은 다음 이를 활용하여 화합물의 억제반응을 조사하는 방법(Breitenbach et al., 2002; Ndikuryayo et al., 2017; Shino et al., 2018), aclonifen의 작용점이 SPS라는 사실을 확증한 것처럼 애기장대 RNAseq dataset를 활용하여 특정 작용점을 발굴하는 방법(Kahlau et al., 2020), 저항성 유전자를 제조하여 담배 또는 애기장대에 발현시킨 다음 저해제와의 반응패턴을 분석하는 방법(Clough et al., 2016) 등이 현재 작용점 구명에 주로 동원되는 방법이라 할 수 있겠다.
결 론
엽록체내의 광합성 과정은 산소가 풍부한 조건에서 빛을 이용하여 화학에너지를 만드는 과정으로서 주변 환경 변화와 식물 자신의 생육에 필요한 요구조건에 맞춰 효율적으로 작동되어야 하기 때문에 시스템 보호와 기능유지를 위해 매우 복잡하고 정교하게 운용되도록 지어진 일종의 기계설비(machinery)이다. 그리고 광전자의 이동 또는 반응 속도가 PS II에서의 피코초(picosecond, 10-12 s), PQH2 ~ Cyt b6f 단계에서의 밀리초(milliseconds, 10-3 s), Rubisco에서의 초(seconds, 10-1 s) 단위로 진행되는 매우 역동적인 과정을 갖고 있다(Pinnola and Bassi, 2018). 따라서 과잉의 빛에너지 또는 여러 가지 활성산소가 필수불가결하게 발생될 수밖에 없고 그렇기 때문에 이를 대처하기 위한 광보호기작(photoprotection mechanisms)도 잘 발달시켰다. 그렇지만 이러한 속성의 시스템(설비)는 어느 한 기능이 손상되었을 때 연쇄적 반응으로 모든 것이 무너질 수 있다는 단점을 가지고 있다. 식물백화 유도도 그중의 한 결과이며 제초제 작용의 주요 타겟이 되는 것도 이 때문일 것이다.
특히 식물백화를 유도시키는 화합물의 제초작용 파급력을 생각해 볼 때, 우리가 보다 주목해야 할 부문은 광합성계 내에서의 PQ pool인 것 같다. PQ-9은 광합성에 필수적인 전자전달체(electron carrier)이다. 이는 엽록체에서 틸라코이드막, plastoglobules, 엽록체막 등에 존재하며 그의 분포정도는 여러 조절효소(regulatory enzymes)에 의해 드마틱하게 변화된다. PQ pool의 산화환원(redox) 상태는 광적응, 대사물질 생합성 및 유전자 발현 등과 같은 여러 생리기능과 대사과정에 연계되어 작동되면서 조절역할을 한다. 그리고 PQ 자체는 식물의 활성산소종을 소거하거나 지질과산화(lipid peroxidation)를 경감시키는 강력한 항산화제 기능도 갖고 있어서, Cars과 tocopherols의 광보호(photoprotection) 기능을 보강해준다(Liu and Lu, 2016; Havaux, 2020). 따라서 이러한 다양한 기능을 가진 PQ가 어떤 효소들의 장애에 의해 생합성되지 않거나 또는 기능 이상이 생기면 활성산소 발생, 막과산화, 광합성계 붕괴와 같은 과정을 통해 빨리 죽음에 이르게 될 것이다. 단순히 카로티노이드 생합성 저해작용을 가지는 제초제들은(DXS, PDS 저해제 등) 발아 및 생육초기 단계에 처리되어야 제초활성이 잘 발현되지만 PQ 생합성을 직접적으로 저해하는 제초제는(HPPD 저해제) 발아 및 생육초기 단계뿐만 아니라 생육중기 처리에서도 제초효과가 잘 발현되는 것은 이를 반증해 준다.
최근 PQ pool 기능, PQ 산화에 관여하는 PTOX, PQ 환원에 관여하는 ferredoxin-NADPH dehydrogenase complex의 이해가 높아지고 있다(Grabsztunowicz et al., 2019). 그리고 틸라코이드막과 plastoglobules간의 PQ 교환조절(PQ 항상성 유지)에 기능하는 인자들 중의 하나라고 여겨지는 proton gradient reduction 6 (PGR6, ABC1K1 kinase)가 발견되었는데(Pralon et al., 2019) 이는 PQ-9분자를 plastoglobules로부터 틸라코이드막으로 이동하는데 기여하는 것 같다. 한편 이와 반대 기능을 하는 ABC1K3 kinase도 보고되고 있다. 아직까지 제한된 연구결과들만 제시되었지만 PQ는 환경변화에 적극적으로 대처하기 위해 위치 이동을 활발하게 하는 것으로 파악되고 있다(Havaux, 2020). 따라서 PQ 생합성의 저해와 함께 PQ pool과 관련된 여러 인자들의 화학적 조절은(Grabsztunowicz et al., 2019) 백화유도 제초제의 효능증진은 물론 신규 유형의 백화유도 제초제(bleaching herbicide) 개발에 있어서 새로운 방향이 될 수 있을 것으로 여겨진다. 결론적으로, 현재 상당히 많은 여러 가지의 백화유도 화합물이 개발되었지만 추가적으로 새로운 작용점이 도출될 가능성이 있을 뿐만 아니라 proherbicide를 포함하여 이를 저해하는 관련 화합물의 다양성도 보다 확장될 수 있을 것으로 판단된다.
요 약
엽록체에서 일어나는 광합성시스템은 산소가 풍부한 조건에서 빛을 이용하여 화학에너지를 만들기 때문에 과잉의 빛에너지 또는 여러 가지 활성산소가 필수불가결하게 발생될 수밖에 없고 따라서 이를 대처하기 위한 광보호기작(photoprotection mechanisms)도 잘 발달시켜 매우 복잡하고 정교하게 운용되도록 설계된 일종의 기계설비(machinery)라 할 수 있다. 그렇지만 이는 어느 한 기능이 손상되었을 때 연쇄적 반응으로 모든 것이 무너질 수 있다는 단점도 가지고 있을 것인 바, 식물백화 유도도 그중의 한 결과이며 제초제 작용의 주요 타겟이 되는 것도 이 때문일 것이다. 특정 화합물에 의해 식물이 백화(whitening)되는 현상은 틸라코이드막이 어느 정도 정상적으로 유지된 채, 막내에 유입된 광합성전자전달계 단백질 복합체와 광합성색소가 소실될 때 나타난다. 따라서 이미 발달된 조직보다는 분화되어 발달되기 시작하는 세포조직, 즉 발아되어 어린 식물이 성장할 때나 생장점 부위에서 새롭게 발육성장하는 조직에서 백화현상이 쉽게 유도된다. 현재까지 상업용 제초제에 국한하여 이러한 기능을 가진 작용점(action site)을 분류하면 총 8가지 이지만, 연구중에 있는 것까지 포함하면 적어도 10가지 이상이 되는 것 같다. 본 총설에서는 이들 작용점을 중심으로 백화유도화합물의 종류, 작용 생리 및 특성에 관한 최신 연구내용을 취합하여 요약하였다. 그리고 광합성시스템의 최신 연구진전, 특히 PQ pool의 기능과 역할을 검토해 볼 때, 새로운 작용점이 추가적으로 도출될 가능성이 있을 뿐만 아니라 proherbicide를 포함하여 이를 저해하는 관련 화합물의 다양성도 보다 확장될 수 있을 것으로 전망된다.