서 론
전세계적으로 적조(red tide)는 물론 해양 녹조 대발생(green tide)이 해양생태계에 큰 위협이 되고 있다. Green tide는 맨 처음 1905년에 보고되었으나 2000년대부터 사회적으로 문제가 되기 시작하였는데 이는 Ulva 속, Enteromorpha 속, Chaetomorpha 속, Cladophora 속, Percursaria 속, Rhizoclonium 속, Ulvaria 속, 기타 녹조류가 이상 증식으로 대발생(bloom)되는 현상으로서(Zhang et al., 2013) 지역마다 다르지만 현재 가장 큰 영향을 끼치는 종은 Ulva 속(갈파래 류)의 해조(seaweed)인 것으로 알려지고 있다. 갈파래가 가장 큰 규모로 발생된 사례는 2008년 8월 중국 Quingdao 해안가의 600 km2에서 Ulva 속 식물이 100만톤 가량 대발생 됨으로 인해 올림픽 개최에 심각한 피해를 주었으며(제거비용으로 US $ 100 million 이상 소요) 그 이후에도 황해지역에 꾸준히 발생하면서 생태계를 악화시키고 있다(Li et al., 2014; Hu et al., 2017). 우리나라에서도 서해안(2009년 7월, 2012년 5월), 동해안(경포호수, 2011년 6월), 제주해안에 대발생하여 사회적으로 문제가 되는 사실이 보도되어 왔으며 특히 제주도의 동부해안은 매년 상습적으로 대발생하여 해수욕장 사용에 지장을 초래할 뿐만 아니라 부패로 인한 악취발생 및 주변 생태계 오염, 일부 마을 어장의 갯녹음화 등의 산업적 피해를 유발시키고 있다. 특히 우리나라에 있어서 녹조에 의한 해안오염의 주범은 연안지역의 기수(brackish water)에서 잘 자라며 번식 및 생육이 왕성한 Ulva 속 식물 [구멍갈파래(구학명 Ulva pertusa, 신학명 Ulva australis), 큰갈파래(Ulva ohnoi), 가시파래(Ulva prolifera), 참갈파래(Ulva lactuca), 잎파래(Ulva linza) 등] 이다. 이러한 현상은 그대로 방치될 경우 점차 아열대-열대화 되어가는 우리나라 기후 변화로 인해 더욱 악화될 것으로 판단된다. 왜냐하면 연구보고에 의하면 지금보다 대기중의 CO2가 높아지고 해수의 온도가 상승되었을 때 Ulva prolifera 및 Ulva lactuca 의 생장율이 증가되었고(Xu and Gao, 2012; Olischläger et al., 2013), 해양산성화 조건에서 Ulva linza 및 대발생(bloom)을 야기시키는 두 거대조류의 생장이 촉진되었으며(Liu et al., 2014; Young and Gobler, 2016), 향후 기후변화는 부영양화 조건에서 Ulva rigida에 의한 green tide를 더욱 심각하게 유도하는 것으로 조사되었기 때문이다(Gao et al., 2017).
따라서 갈파래 대발생을 방지하고자 전세계적으로 많은 노력을 기울이고 있으며 크게 두가지 방향으로 접근하고 있다. 즉 갈파래 발생상황 모니터링 및 발생원인을 조사하고, 발생을 최소화 시키기 위한 여러가지 방안을 연구하는 방향과 다른 하나는 대발생되었을 때 이를 신속히 수거하여 이를 자원화 시킴으로서(Lee et al., 2011; Alves et al., 2013) 대발생 문제를 간접적으로 경감시키는 연구방향이다. 전자의 경우에는 갈파래 발생 모니터링, 발생의 생리․생태 등의 기초연구는 어느정도 보고되고 있지만, 실제 갈파래 발생을 경감시키기 위한 주목할만한 연구사례는 거의 없는 상황이다. 즉 중국에서는 황해에서 매년 겪게되는 Ulva 대발생 상황에 대해 조사가 진행 중이며(Hu et al., 2017) 원인 규명에 대해서도 연구 중이나(Lin et al., 2011; Luo et al., 2012; Huo et al., 2014; Liu et al., 2015) 갈파래의 급속 증식 능력(Gao et al., 2010; Zhang et al., 2013), 영양분 유입 및 환경영향에 관련한 언급만 있을 뿐(Luo et al., 2012; Liu et al., 2013; Li et al., 2016; Zhang et al., 2017), 아직 발생경감 대책 수립에 대해서는 미약한 상황이다. 일본에서는 Ulva 증식억제 기술중의 하나로서 몇 시간 동안 저염도 상태에서 공기에 30-40% 노출시키면 다른 생물종 생육의 영향없이 갈파래를 현저하게 경감시킬 수 있다는 보고가 있다(Yamochi, 2013). 한편 우리나라에서는 위성영상감지를 통해 대발생 상황을 모니터링할 수 있으며 생리, 생태와 원인분석에 대한 연구가 일부 진행되고 있지만(Choi and Kim, 2005; Choi et al., 2010; Kang and Kim, 2016; Kang and Nam, 2016) 경감기술개발에 대해서는 거의 연구되고 있지 못한 실정이다.
따라서 본 연구에서는 구멍갈파래 사멸에 미치는 여러 물리화학적 요인들의 영향 정도를 조사하여 향후 갈파래 대발생 경감기술 확립을 위한 기초자료를 얻고자 제반 실험을 수행하였다.
재료 및 방법
시험생물의 계대배양 및 엽상체 절편 제조
전남 거제도 해안에서 수집한 구멍갈파래를 실내 계대배양을 통해 적응시킨 성체(엽상체)를 사용하였다. 즉, 표면적 0.1 m2의 리빙박스에 인공해수 5 L를 주입하고 채집한 구멍갈파래를 넣은 다음, 수온 15±1.0°C, 광주기 14시간, 광도는 50-500 µmol m-2 s-1의 생육실에 배양하였으며 2주마다 주기적으로 배지(인공해수)를 교체해 주었다. 인공해수는 수돗물로 조제하였으며 이의 조성은 Instant Ocean Sea Salt 35.93 g L-1 (United Pet Group, Inc. Cincinnati, OH 45255), KNO3 100 mg L-1, K2HPO4 20 mg L-1, Sodium bicarbonate 100 mg L-1 이었고 pH는 8.1, 염도는 2.6-2.7% 이었다.
계대배양중인 구멍갈파래 엽상체를 현미경 관찰한 다음, 포자 유도 가능성이 낮은 엽상체를 골라 이로부터 직경 4 mm의 엽상체 절편(thallus disc)을 적출한 후 sodium bicarbonate 100 ppm이 함유된 f/2 배지(이하 f/2+SBC 100 ppm라 함) 에 담고 20°C 항온, 14시간 광주기, 광도 조건의 생육실에 2일 이상 적응시킨 것을 아래의 제반 실험을 위한 실험재료로 사용하였다.
순수(mili-Q water)내 침지처리에서의 구멍갈파래 생존력
역삼투시스템(Milli-Q Water System, Millipore, USA)으로 제조된 순수에 엽상체 절편을 침지하여 20°C 항온, 14시간 광주기, 50-100 µmol m-2 s-1 광도 조건의 생육실에 0-8 hr 두었다. 침지시간 경과별로 절편 10개씩 3반복 취하여 f/2+SBC 100 ppm 배지 20 mL가 담겨진 125 mL 삼각플라스크에 접종하였다. 이를 동일조건의 생육실에 1주일 두어 사멸여부, 생체중 및 건물중을 조사하였다. 통계분석은 ANOVA (P=0.05)를 이용하여 실시하였다.
건조처리에서의 구멍갈파래 생존력
건조는 세가지 조건에서(20°C 실내 약광, 30°C 열풍건조, 40°C 열풍건조) 실시하였다. 엽상체 절편 10개를 취해 paper towel로 물기를 제거한 다음 생체중을 측정한 후, 이를 배양배지로 습윤 시킨 paper towel에 고루 펼쳐 놓고 200분 동안 건조처리 하였다. 건조처리 시간 경과별로 10개 절편의 생체중을 다시 측정한 후 이를 f/2+SBC 100 ppm 배지 20 mL가 담겨진 125 mL 삼각플라스크에 접종하였다. 이를 20°C 항온, 14시간 광주기, 50-100 µmol m-2 s-1 광도 조건의 생육실에 1주일 두어 탈색 및 고사 여부를 조사하였다.
온도처리에서의 구멍갈파래 생존력
35°C 이하 온도처리 실험의 경우, 엽상체 절편 10개를 f/2+SBC 100 ppm 배지 50 mL가 담겨진 125 mL 삼각플라스크에 3반복 접종하였다. 알루미늄 호일로 마개를 한 후 4가지 항온(20°C, 25°C, 30°C, 35°C), 14시간 광주기, 50-100 µmol m-2 s-1 광도 조건의 생육실에 1주일 두어 생육, 탈색, 고사 정도를 통해 무처리 대비 피해율(injury %)을 달관조사한 다음, 3반복의 평균과 표준편차로 실험결과를 나타내었다. 한편 40°C 이상 온도처리 실험의 경우는 f/2+SBC 100 ppm 배지 100 mL가 담겨진 250 mL 비이커를 수조에 담궈 각각 40°C, 45°C, 50°C, 55°C, 60°C가 되도록 유지시켰다. 엽상체 절편 10개를 거즈에 모아서 각각의 온도에 0.1초-10분 침지하고 즉시 꺼내어 미리 준비해 둔 차가운 동일 배지에 식힌 다음, 이를 f/2+SBC 100 ppm 배지 50 mL가 담겨진 125 mL 삼각플라스크에 3반복 접종하였다. 알루미늄 호일로 마개를 한 후 20°C 항온, 14시간 광주기, 50-100 µmol m-2 s-1 광도 조건의 생육실에 1주일 두고 탈색 및 고사 정도를 달관조사하였다. 실험결과는 각각의 온도에서 50-60%, 90-95% 방제되는데 요구되는 처리시간을 구하여 나타내었다.
배양액 pH 차이에 따른 구멍갈파래 생존력
기본배지(f/2+SBC 100 ppm)에 1 N HCl 또는 1N KOH를 적당량씩 추가하여 pH가 4-10인 용액을 조제하였다. 조제된 여러 pH의 배양액 100 mL를 250 mL 삼각플라스크에 분주한 후, 엽상체 절편 10개를 3반복 접종하였다. 이를 20°C 항온조건, 14시간 광주기, 50-100 µmol m-2 s-1 광도 조건의 생육실에 10일 배양한 후 절편의 크기, 생체중, 건물중, 탈색 및 고사 정도 등을 조사하여 3반복의 평균과 표준편차로 실험결과를 나타내었다.
여러가지 화합물 처리에서의 구멍갈파래 생존력
시험화합물은 8종의 제초제(aclonifen, diquat, diuron, endothal, fluridone, indaziflam, mefenacet, paraquat)와 copper chloride, hydrogen peroxide, menadione sodium bisulfite, nonanoic acid, N-vanillylnonanamide, peracetic acid, sodium chlorite, sodium hypochlorite, sodium percarbonate (H2O2 20-30%)을 포함하여 모두 17종의 화합물을 공시하였다. 기본배지(f/2+SBC 100 ppm)를 이용하여 여러가지 농도의 시험용액을 조제한 다음, 50 mL 유리관병에 10 mL 분주한 후 여기에 사전에 준비한 엽상체 절편 5개씩을 접종하였다. 이를 20°C 항온, 14시간 광주기, 50-100 µmol m-2 s-1 광도 조건의 생육실에 10일 두고 탈색, 생장 및 고사 정도를 달관조사하였다. 그 후 화합물 처리농도에 따른 생장반응식을 통해 40-60%, >90% 저해 농도를 각각 구하여 화합물의 구멍갈파래에 대한 생육저해활성을 나타내었다.
결과 및 고찰
순수(pure water)내 침지처리에서의 구멍갈파래 생존력
구멍갈파래 절편을 무기염이 없는 순수에 단시간 침지처리하였을 때 생육이 저해되거나 또는 고사되는지를 알아보고자 실험한 결과, 8시간 침지처리에서도 생육억제 현상이 전혀 나타나지 않았다(Table 1). 그러나 별도 실험에서 1.0-1.5% 수준의 저염화 조건에 약 7일 배양했을 때에는 구멍갈파래 포자 유출이 약 70% 경감되는 효과를 나타내었기 때문에(데이터 제시 생략) 비교적 장기간의 저염화 처리는 Ulva 발생경감 방안중의 하나로서 고려해 볼 수 있을 것이다. Ulva 속 식물은 상대적으로 폭넓은 염도조건에 내성을 보이지만(Silva et al., 2008) 저염도(1-2%)와 pH 7 내외에서는 영양생장을, 고염도(4%)와 pH 8 내외의 조건에서는 생장량이 현저히 떨어지면서 생식생장(생식세포 형성 및 포자 유출)이 높아지는 것으로 보고되고 있다(Lin et al., 2011).
건조처리에서의 구멍갈파래 생존력
구멍갈파래는 수생식물로서 연안에서 부착 또는 부유 서식하고 있어 조간대에는 공기에 노출되는 경우가 많고 이때의 건조정도가 생육 및 고사정도에 크게 영향을 줄 수 있을 것이다. 따라서 구멍갈파래의 고사에 미치는 건조처리 특징을 알아보기 위하여 실험한 결과는 다음과 같았다.
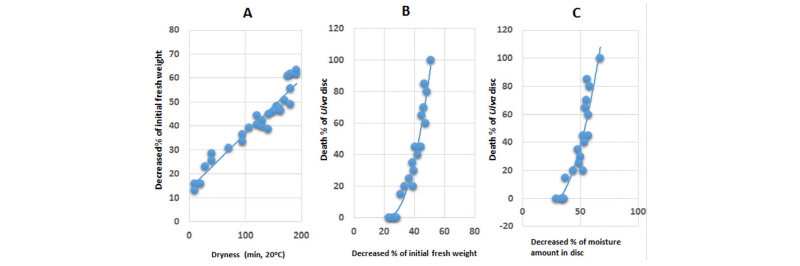
20°C 실내 약광에서의 건조처리
20°C 약광에서 건조시킬 경우, 건조처리 시간별 생체중 감소정도는 Fig. 1A와 같았다. 초기생체중의 50%까지 건조되는 데는 약 2.5시간 걸렸으며 3시간 건조처리에서 외관상 거의 완전히 말랐다. 생체중 감소가 30%쯤 되었을 때 10% 내외의 피해가 발생되기 시작하였으며(Fig. 1B), 절편 조직이 90% 이상 고사되는 시점은 건조처리를 136-157분 하였을 때인 초기 생체중이 45-50% 감소되었을 때(Fig. 1B) 또는 보유하고 있는 수분함량이 65-70% 감소되었을 때 이었다(Fig. 1C). 한편 건조처리를 보다 빨리 진행시켰을 때에는(생체중 50% 감소시키는데 약 1시간 소요) 생체중 감소가 30% 정도였을 때에도 피해가 60% 내외로 나타나 건조를 신속히 함에 따라 고사가 보다 용이함을 보여주었다(데이타 미제시).
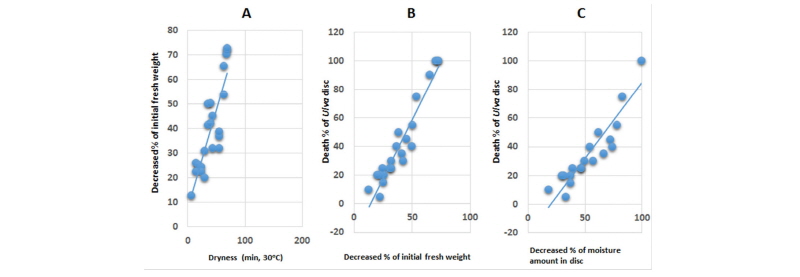
30°C 및 40°C 암조건에서의 열풍 건조처리
30°C 암조건에서 열풍건조시킬 경우 건조처리 시간별 생체중 감소정도는 Fig. 2와 같았다. 초기생체중의 50%로 건조되는 데는 약 53분 걸렸으며 70분 건조처리에서 외관상 거의 완전히 말랐다. 생체중 감소가 20%쯤 되었을 때 10% 내외의 피해가 발생되기 시작하였으며(Fig. 2A), 절편 조직이 90% 이상 고사되는 시점은 건조처리를 76.8분 하였을 때인 초기 생체중이 68.8% 감소되었을 때(Fig. 2B) 또는 보유하고 있는 수분함량이 90% 정도 감소되었을 때 이었다(Fig. 2C).
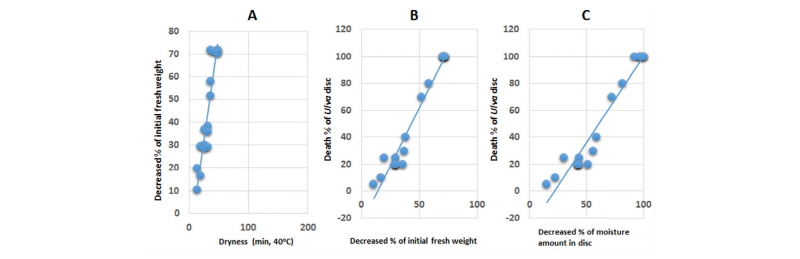
한편 40°C 암조건에서 열풍건조시킬 경우 건조처리 시간별 생체중 감소정도는 Fig. 3과 같았다. 초기생체중의 50%로 건조되는 데는 약 35분 걸렸으며 45-50분 건조처리에서 외관상 거의 완전히 말랐다(Fig. 3A). 생체중 감소가 20%쯤 되었을 때 10% 내외의 피해가 발생되기 시작하였으며(Fig. 3B), 절편 조직이 90% 이상 고사되는 시점은 건조처리를 43.8분 하였을 때인 초기 생체중이 66.5% 감소되었을 때(Fig. 3B) 또는 보유하고 있는 수분함량이 92% 정도 감소되었을 때(Fig. 3C) 이었다. 이들의 결과를 볼 때 암조건에서 열풍건조하면 처리 온도에 관계없이 거의 비슷한 수분함량 감소에서 피해 정도가 동일하게 나타남을 알 수 있었다. 다만 온도가 증가하면 건조속도가 빠르기 때문에 보다 짧은 처리시간에 피해가 나타났다. 이는 앞의 20°C 약광조건에서의 건조처리 결과(건조처리 속도가 높으면 보다 낮은 수분함량 감소에서 피해가 나타났음)와는 상이한 경향인데 이는 광과 밀접한 관련이 있는 것으로 추측된다.
이상의 건조처리 실험결과를 종합해 볼 때, 구멍갈파래가 지표에 1-2시간 노출되어 초기 생체중의 40-50% 이상이 감소되면 심각한 생육 장해가 일어날 수 있는 것으로 보여졌고, 자연조건에서의 썰물시간은 이에 충분한 정도가 될 수 있으므로 향후 갈파래 밀도조절에 동원될 수 있는 유용한 수단중의 하나가 될 수 있을 것 같았다. Yamochi (2013)는 몇 시간 동안 저염도 상태에서 공기에 30-40% 노출시키면 다른 생물종 생육의 영향없이 갈파래를 현저하게 경감시킬 수 있었다고 하였다.
온도처리에서의 구멍갈파래 생존력
35°C 이하에서의 온도처리 효과
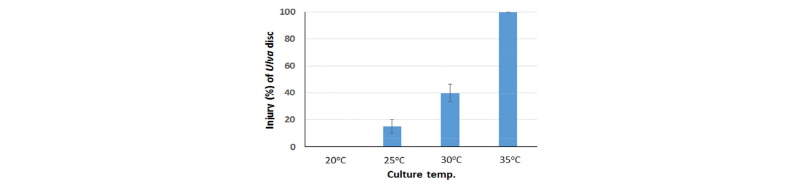
구멍갈파래 엽상체 절편을 각 온도별로 배양하였을 때, 35°C 배양구에서는 배양개시 1일만에 95% 이상 고사되었다. 배양 2일째에는 30°C의 경우도 탈색이 어느 정도 진전된 모습이었으나 20°C와 25°C는 정상 상태였다. 배양 7일째 생육상태를 조사한 결과 Fig. 4에서와 같이 20°C에서는 정상이었으나 25°C, 30°C, 35°C 온도에서는 각각 15%, 40%, 100%의 생육장해가 관찰되었다.
40°C 이상에서의 온도처리 효과
구멍갈파래는 40°C 이상 온도처리시 매우 짧은 처리시간 내에 사멸되는 특징을 보였다. 55°C 이상에서는 0.2초 처리에서도 완전 고사되었으며, 40°C, 45°C, 50°C 처리에서 엽절편이 90-95% 고사되는 처리시간은 각각 10분, 30초, 1초 이었다. 한편 50-60% 생육저해를 유발하는 처리시간은 각각 4분, 20초, 0.2초 미만이었다(Table 2). 따라서 50°C 이상의 물은 구멍갈파래의 신속사멸에 유용하게 사용될 수 있을 것 같고, 최근의 순간온수 제조 및 살수기술은 이를 가능케 할 것으로 여겨졌다.
Table 2. Effect of soaking treatment in high temperature medium on the death of thallus disc excised from Ulva
australis.
|
배양액 pH 차이에 따른 구멍갈파래 생존력
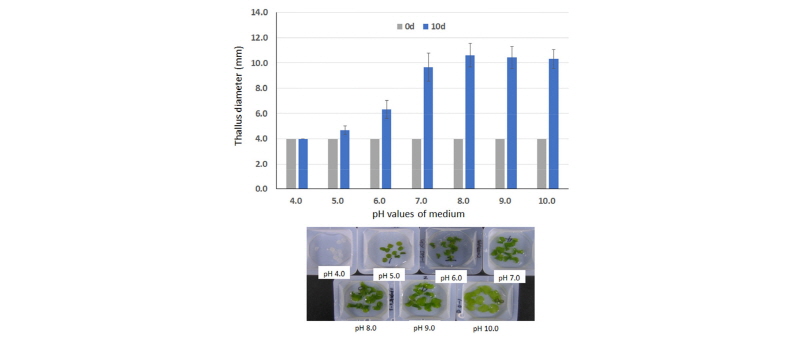
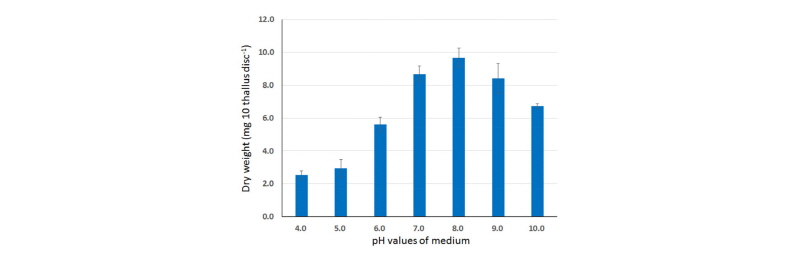
구멍갈파래의 생존에 미치는 배양액 pH 범위를 알아보기 위하여 실험한 결과, pH 7-9 범위에서는 아무런 장해가 관찰되지 않았으나 pH 6 이하에서는 절편의 생장억제가 심하게 일어났으며 pH 4에서는 절편의 생장이 정지된 상태로 탈색고사되었다(Fig. 5, Fig. 6). 한편 pH 10에서는 절편 크기 생장의 억제는 관찰되지 않았지만(Fig. 5), 70% 정도의 탈색과 함께(Fig. 5) 건물중 저해가 관찰되었으며 산성조건에서 보다는 억제정도가 상대적으로 낮은 경향을 보였다(Fig. 6). 이는 구멍갈파래가 산성조건보다는 알카리 조건에서 상대적으로 높은 내성을 보여주고 있으며(Lin et al., 2011; Cornwall et al., 2012), 생장을 신속히 억제시키기 위한 방안으로서 pH를 낮추는 방법도 고려해 볼 수 있을 것 같았다. Gao et al. (2016)도 Ulva conglobata가 pH 6.0 이하에서 상당히 민감한 생육억제반응을 보인다고 하였다.
여러가지 화합물 처리에서의 구멍갈파래 생존력
여러가지 화합물에 대한 구멍갈파래의 살초반응을 조사한 결과는 Table 3과 같다. 저농도(5 ppm 이하)에서 양호한 효과를 나타내는 화합물은 copper chloride, diuron, indaziflam, mefenacet, menadione sodium bisulfite 등이었다. 한편 보다 신속하게 살초반응을 나타내는 화합물은 hydrogen peroxide, sodium hypochloride, sodium percarbonate와 같은 산화제 들이었다.
갈파래는 자연계에서 7가지 정도의 다양한 번식전략을 갖추고 있고, 무엇보다 생장과 증식이 매우 빠른 식물로 알려져 있다(Lin et al., 2008; Zhang et al., 2013). 그리고 폭넓은 범위의 염도에 대한 내성을 가지지만 상대적으로 기수(brackish seawater)에서 영양번식이 왕성한 특성이 있으므로(Silva et al. 2008; Ding et al., 2009; Lin et al., 2011) 영양분 함량이 높은 담수가 유입되는 해안, 해류 정체수역, 제주도의 경우엔 양어장 폐수 배출지역 및 용천수가 나오는 곳 등에서 대량발생이 된다(Fig. 7). 또한 모래 및 바위, 해양 구조물 등에 부착되어 생장할 수 있지만 분리된 개체 자체는 부유하면서 성장할 수도 있기 때문에(Ding et al., 2009) 해류를 따라 대량으로 이동 확산되기도 한다. Zhang et al. (2013)에 의하면 1 cm2 크기의 엽상체에서 2-6백만개의 포자, 1 g 생체중의 엽상체에서 약 20억개(2×109개)의 유묘가 발생될 수 있으며, 2-3주의 빠른 life cycle을 가지고 있다고 한다. 따라서 갈파래는 환경만 좋으면 대량 발생할 잠재력을 항상 가지고 있고, 특히 큰 엽상체가 잘게 파편화 되었을 때 작은 조각에서(4 mm 크기 이하) 대량의 소포자(spore)가 급속발생하여 증식하는 특징이 있었다(Gao et al., 2010). 그리고 대량 발생으로 한번 오염되었던 지역은 잔류 개체(엽상체) 및 포자들로 인해 이후 상습적으로 대량 발생하게 되고, 이에 발생한 개체들은 해류를 따라 다른 지역으로 이동하여 또 다른 오염을 초래시킨다. 따라서, 갈파래 대량 발생 경감을 위해서는 원천적으로 부영양화 조건을 만들지 않는 것이 가장 바람직하겠지만 이를 지속적으로 관리하기에는 매우 어려운 상황이기 때문에, 보다 현실적 접근 방법으로서는 국지적일지라도 구멍갈파래의 발생밀도를 줄이거나, 생장을 억제시키며, 대량 발생되었을 때 이를 신속히 수거하되 잔존 엽상체로부터의 포자 대량 유출을 효율적으로 차단하는 처리 방안이 무엇보다 필요하다. 예를 들면, Ulva prolifera 배우체 발아를 위한 기질로서 플라스틱 재질이 가장 양호하였고 고무 재질이 가장 불량하였기 때문에 향후 갈파래 대발생의 초기 단계 억제책으로서 고무재질의 구조체를 이용하거나(Geng et al., 2015), 실리콘계 방오제(silicone anti-fouling agents를 도포하는 것도(Li et al., 2017) 하나의 방안이 될 수 있다.
그런데 갈파래 주요 오염지는 방류수 주변 해안가 또는 해수욕장 주변이며 썰물일 때 상당히 많은 지역이 수시간 노출된 상태에 있게 된다(Fig. 7). 따라서 이 시기에 갈파래를 방제할 수 있도록 한다면 보다 적극적으로 갈파래의 발생밀도를 줄 일 수 있을 것이다. 본 연구에서는 갈파래의 물리적 방제기술 개발을 위해 먼저 구멍갈파래가 어떤 환경조건에 취약한지를 알아보고자 순수(pure water), 건조, 온도, pH 처리에 따른 여러가지 생장반응을 조사한 결과, 온도에 가장 민감한 반응을 보여(Fig. 4, Table 2) 40-50°C 온수를 이용하면 생장억제를 제어할 수 있는 방안이 도출될 수 있을 것이다. 그리고 건조에 대해서도 초기 생체중의 40-50% 이상이 감소되면 심각한 생육 장해가 일어났기 때문에(Fig. 1) 비교적 민감한 반응을 보인다고 생각되었으나 현실적인 측면에서는 건조제어가 제한적이고 어려울 것으로 판단된다. 한편 저염화 처리 역시 포자방출 억제 등의 부분적 효과는 있겠지만 신속한 제어에는 거의 효과가 없을 것으로 보였다.
한편 보다 경제적으로 갈파래 대발생을 제어하려면 화학적 방법도 활용되어야 할 것이다. 본 연구에서는 pH 방법의 가능성을 검토하였으며 아울러 수중처리에 이용되고 있는 제초제 및 생화학제와 수질정화에 응용되고 있는 수처리제를 중심으로 구멍갈파래 방제 잠재력이 있는 수종의 화합물을 선발하였다. 그 결과 낮은 pH 조건에서 구멍갈파래의 생장억제가 심하였기 때문에(Table 3) 이를 국지적으로 활용하는 방안도 향후 검토될 필요가 있다고 여겨졌다. 또한 구멍갈파래를 신속히 고사시킬 수 있는 여러가지 화합물들 중 mefenacet, diquat 등과 같은 제초제는 먼저 대상 화합물이 주변 생태환경에 대해 어떠한 영향을 미치는지 사전에 면밀한 검토를 수행한 후 활용되어야 할 것이다. 그러나 hydrogen peroxide, sodium hypochlorite, sodium percarbonate 등과 같이 수처리제로 등록되어 있는 화합물들은 제한된 환경조건 내에서 활용될 잠재력이 있어 이에 대한 향후 검토가 필요할 것으로 사료된다.
궁극적으로 갈파래 대발생 문제를 해결하기 위해서는 발생 위치, 생육 단계(포자, 유묘, 성체 등), 오염지역(일반 해안, 양식장 주변, 하수유입지, 해수욕장, 공원지) 등의 다양성에 맞추어 여러가지 적용기술이 개발되어야 한다. 따라서 갈파래 방제에 활용될 수 있는 여러가지 요인들을 발굴하고 각각의 특성들에 부합된 물리적, 화학적, 생물적, 종합적 방제기술이 개발 적용될 수 있도록 발전시켜야 할 것이다.