서 론
한국잔디는 Zoysia속(Zoysia spp.)에 속하며 필리핀, 태국을 비롯한 동남아시아 열대 지역부터 한국, 일본, 중국 등 동북아시아의 온대 기후대에 걸쳐 분포하고 있다(Engelke et al., 1983). 난지형 잔디인 한국잔디는 한지형 잔디에 비하여 내염성이 우수하고(Kim et al., 1991a; Marcum et al., 1998), 내건성과 내병성도 우수하여 관리비용을 최소화 할 수 있는 초종이다(Beard, 1973).
현재 국내에서 사용 중인 한국잔디는 들잔디(Zoysia japonica)와 중엽형 잔디가 대부분이다(Choi and Yang, 2005). 전통적으로 들잔디(Zoysia japonica Steud.)가 재배되어 왔으나, 질감이 섬세하고 번식속도가 빠르며 내환경성이 높은 중엽형 잔디가 보급되면서 최근에는 한국잔디의 재배농가 및 재배면적도 증가하고 있는 실정이다(Choi and Yang, 2006).
건강하고 고품질의 잔디를 재배하기 위해서는 재배관리가 중요하다. 그 중 잔디 병해의 적절한 방제는 재식밀도, 시비 및 관수 등 다른 재배상의 문제점들보다 더욱 중요한 것으로 인식되고 있다(Shurtleff et al., 1987; Paik et al., 1998). 그러나 재배지 잔디의 경우 재배특성상 장기간 연작과 화학비료를 끊임없이 시용을 하고 있으며(Bae et al., 2013), 매년 증식과 뗏장의 출하가 반복적으로 수행된다(Bae et al., 2012). 또한, 장기간 동안 반복적으로 과도한 농약을 사용하고, 잔디갱신, 대취 관리 등을 소홀히 함으로써 토양 생육환경이 악화되고 있다 (Hwang and Choi, 1999; Kim, 2006). 이러한 재배환경상의 여러 가지 장해로 인해 야생의 잔디보다 재배지 잔디가 병원균에 쉽게 감염될 수 있는 조건을 갖추고 있으며(Paik et al., 1998), 특정 병해 발생으로 고품질 잔디 생산의 주 위협요소가 되고 있다(Min et al., 2014).
잔디에서 발생하는 병의 대부분은 진균성 병원균에 의해서 발생하며, 문제가 되는 토양전염성 병원균으로 Rhizoctonia spp., Pythium spp., Curvularia spp. 등이 보고되었어 있다(Chung et al., 1991; Shim et al., 1994 ). 이 중에서 주로 엽신, 엽초, 관부에 Rhizoctonia spp.가 침입하여 황변하여 말라죽는 잎마름증상을 나타내는 병은 세계 여러 지역의 잔디 조성지에서 큰 문제가 되고 있다(Endo, 1961; Dale, 1978; Smiley, 1983; Couch and Haygood, 1990). 한국잔디는 한지형 잔디에 비하여 내병성이 가장 강한 초종에 속하나 Rhizoctonia solani AG2-2에 의한 갈색퍼짐병(Large patch)에 대해서는 이병성이 높은 것으로 보고되어 있다(Kim et al., 1991b; Shim and Kim, 2000).
들잔디가 식재된 골프장의 경우 갈색퍼짐병 방제를 위해 상당한 경제적 비용을 부담하고 있지만, 강우시기와 배수 불량지에서는 상습적으로 갈색퍼짐병이 발병하며, 병 진전이 빨라 방제에 많은 어려움을 겪고 있다(Jung et al., 2008). 또한 갈색퍼짐병 방제는 주로 화학적 방제에 의존하고 있다(Shim and Kim, 2000; Lee et al., 2012). 그러나 화학적인 방제는 토양에 형성된 대취층(Thatch layer)이 병원균의 좋은 서식지가 되고(Shim and Kim, 2000) 약제 침투에 방해되어, 약제 방제의 효과를 낮아져 방제에 어려운 요인으로 작용하고 있다(Lee et al., 2012).
갈색퍼짐병 방제에 대한 연구는 주로 미생물과 농약 혼용에 의한 연구(Shim et al., 1997; Shim and Kim, 2000; Jung et al., 2008; Islam et al., 2009), 약용식물의 추출물 이용(Paik et al., 1998), 목초액(Grove, 1999) 및 파라핀오일의 살포(Lee et al., 2012)를 이용한 연구들이 수행된 바 있다. 갈색퍼짐병을 방제할 수 있는 화학적 방제 연구들이 수행되고 있지만(Lee et al., 2013) 토양전염병인 갈색퍼짐병은 농약으로 완전한 방제가 어렵고, 계속된 농약의 사용은 병원균의 내성의 증가와 잔디의 질에 나쁜 영향을 미칠 수 있다(Hwang and Choi, 1999). 최근 이를 대체할 길항미생물에 대한 연구들이 많이 이루어지고 있다(Shim et al., 1997; Hwang and Choi, 1999; Shim and Kim, 2000; Jung et al., 2008; Islam et al., 2009; Lee et al., 2012).
식물 내의 Chitinase는 진균의 세포벽을 분해하는 역할을 하며, 병저항성과 관련이 있다고 보고되어 있다(Abeles et al., 1971; Boller et al., 1983; Nawani et al., 2002; Kucuk and Kivanc, 2004). 잔디의 병은 대부분 진균에 의해 발생이 되며 진균의 세포벽은 chitin 등의 성분으로 이루어져 있는데 이는 chitin을 분해하는 유용균을 선발하면 병 방제에 효과적으로 사용할 수 있다(Lee et al., 2015b). 이 중 Streptomyces속(Shirai, 2006)과 Burkholderia속(Khan et al., 2004; Jin et al., 2005; Chae et al., 2006; Mao, 2007)을 포함하여 Serratia와 Klebsiella 등 많은 균들이 Chitinase를 생성하는 것으로 보고되어 있다(Shirai, 2006).
잔디재배지에서 갈색퍼짐병 방제 연구는 거의 없는 실정으로 본 병해에 대한 효율적인 방제가 이루어지지 않고 있으며, 최근 잔디재배지에 갈색퍼짐병이 대발생됨(Min et al., 2014)에 따라 생물적 방제를 위하여 잔디 재배지에서 선발된 균주를 이용하여 잔디의 생장과 갈색퍼짐병 병원균의 변화를 알아보고자 본 연구를 수행하였다.
재료 및 방법
균주 선발 및 선발된 균주 처리
균주 선발은 본 연구진이 선행되어진 연구에서(Lee et al., 2015a) 선발한 Streptomyces sp. S8 균주와 Streptomyces sp., Burkholderia sp. 총 3 균주를 사용하였다. PDK배지(Pepton 10 g, Potato dextrose broth 10 g/L)에 선발한 3가지 균주를 36 시간(Burkholderia sp.) 또는 96 시간(Streptomyces spp.) 진탕배양기(150 rpm, 28°C)를 이용하여 3-5× 107cfu/mL 배양하였으며, 배양된 균을 희석하여 2-6×106cfu/mL로 1L/m로 처리하였다. 대조약제 Tebuconazole 처리농도는 사용약량(2,000배 희석, 1L/m)을 기준으로 처리하였다. 각 처리구의 크기는 4 m×5 m로, 처리횟수는 6월 3회, 7월 3회, 8월 2회로 총 8회 분무 처리하였다. 모든 처리구는 통계처리를 위하여 3반복으로 구성되었다.
갈색퍼짐병 병원균 밀도의 균학적 조사
갈색퍼짐병 병원균 밀도조사는 홀 커터를 이용하여 잔디와 대취토양을 각 각의 실험구마다 3반복씩 채집하여 조사하였다. 실험구는 무처리구, 대조약제 Tebuconazole처리구, 각 미생물 처리구(Streptomyces sp., Burkholderia sp., Streptomyces sp. S8)로 총 5가지의 실험구로 나누어서 진행하였다. 병원균 밀도조사는 2016년 6월초 미생물을 처리하기 전에 1회 채집을 하였고 그 후로는 6월부터 10월까지 매달(6월 24일, 7월 25일, 8월 26일, 9월 23일, 10월 28일)한 번씩 수행하였다. 조사방법은 채집한 잔디의 근권부에 이쑤시개 3개를 삽입 한 후 24시간 상온에서 보관하였으며 24시간이 지난 이쑤시개를 Rhizoctonia 선택배지(Potato dextrose broth 24 g, Agar 20 g, chloramphenicol 100 μg/mL, benomyl 1 ug/L)에 치상하여 27°C에서 24시간 배양하였다. 그 후 이쑤시개 3개에서 뻗어 나온 균사를 현미경(CETI optical instrument, Korea)을 통하여 병원균의 밀도를 조사하였다. 병원균의 밀도는 이쑤시개 뻗어 나온 병원균의 균사수를 세어 조사하였다(Paulitz and Schroeder, 2005). 모든 실험은 3반복으로 진행 되었으며, 통계분석은 ANOVA분석(Tukey’s HSD, P=0.05)을 사용하여 분석하였다.
qRT-PCR을 이용한 갈색퍼짐병 병원균 밀도 조사
토양에 존재하는 갈색퍼짐병 병원균 밀도조사를 위해서 5가지의 실험구에서 잔디 근권부의 토양을 수집하여 DNA를 추출하였다. 토양 수집 방법은 각 각의 실험구에서 3반복으로 토양을 수집한 후 1 g으로 혼합하여 DNA추출에 사용하였다. 토양 DNA추출은 FastDNA®SPIN Kit (MP Biomedicals, Irvine, CA, USA)를 이용하여 매뉴얼에 따라 추출하였으며, 추출한 토양 DNA는 Ethanol Precipitation 과정을 거친 후 qRT-PCR (Real-Time PCR: CFX connect System, Bio-Rad, USA)에 사용되었다. qRT-PCR은 SYBR green 25 uL, Soil DNA 5 uL (100 ug/uL), Primer (AG 2-2_F, R) 각 2 uL, ddH2O 16 uL을 넣어 50 uL volume으로 qRT-PCR을 진행하였으며, 사용한 Primer는 갈색퍼짐병 병원균(Rhizoctonia solani AG-2-2) 특이적 프라이머를 사용하였다(Budge et al., 2009). qRT-PCR 반응조건은 95°C 5분 후 95°C 15초, 60°C 1분, 72°C 1분을 40 cycles로 진행하였다. 반응 후 CT (Cycle Threshold) 값과 표준농도와 비교하여 병원균의 밀도를 측정하였다. 표준농도 설정을 위하여 병원균의 genomic DNA를 추출하여 사용하였으며 genomic DNA 추출은 CTAB기법을 이용하였다(Graham et al., 2003).
토양 및 잔디의 생육 특성
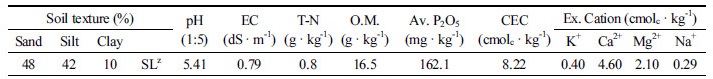
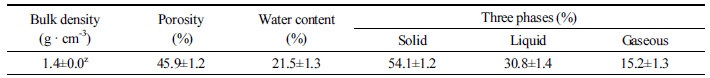
잔디재배지의 라지패취에 대한 생물적 방제를 위하여 잔디 재배지에서 선발된 균주를 이용한 잔디의 생육특성을 조사하기 위해 라지패취 증상이 보이는 경상남도 산청군 단성면(N35.258, E127.961)에서 조사를 실시하였으며, 한 시험구당 4×5 m (20 m2) 규격으로 난괴법 3반복으로 조성하였다. 관수는 자연강우를 활용하였고, 모든 처리구에 시비는 복합비료(Super 21, Namhae Chemical Co. Ltd., Yeosu, Korea, N : P : K = 21 : 17 : 17)로 질소 순성분량 32 g/m기준으로 4회로 나누어 시비하였으며, 잔디깎기는 시험기간 동안 5회를 실시하였다. 시험구 조성 전 살균제인 톱신엠(Kyungnong Co. Ltd., Seoul, Korea, Thiophanate-methyl 70%)을 1회 처리하였으나 시험기간 동안 Tebuconazole처리구 외 다른 시험구에는 농약 처리를 수행하지 않았다. 시험재배지의 토양 특성을 알아보기 위해 임의의 6개 지점을 선정하여 작토 깊이 10 cm 범위 내에서 표토를 약 3~5 cm 걷어내고 시료를 채취한 후 토성 및 토양 이화학성을 분석하였다(Table 1과 2). 토성은 Bouyoucoc (1962)방법에 준하여 분석을 하였고, 토양 이화학성은 농촌진흥청 국립농업과학원 토양분석법(I.A.S., 1987)에 준하여 분석하였다. 토양 물리성 100 mL 용량의 core sampling을 이용하여 측정하였다. 토양 수분변화가 없도록 밀봉하여 토양중량법으로 용적밀도, 공극률, 수분함량, 토양삼상을 분석하였다(Fonteno, 1996).
Table 2. The soil physical of zoysiagrass (Zoysia japonica Steud.) cultivation fields in Sancheong.
|
|
ZMean±Standard deviation. |
약제와 균주 처리구별 들잔디의 생육을 알아보기 위해 식물체 시료는 2016년 8월 26일에 처리별로 15×15 cm의 뗏장을 초장, 지상부, 포복경과 지하부의 생체중과 건물중, 지상부 개체수, 전체 포복경 길이 등을 조사하였다. 초장은 토양 표면에서부터 줄기 최상단까지의 길이를 실측하였다. 식물체의 건물중은 식물체를 건조기(Model DS-80-5, Dasol Scientific Co. Ltd., Gyeonggido, Korea)로 80°C에서 72시간 건조한 후의 무게를 측정하였다. 지상부 개체수는 15×15 cm의 면적 내에서 분지수를 측정하였다.
엽록소와 카로티노이드 함량 분석
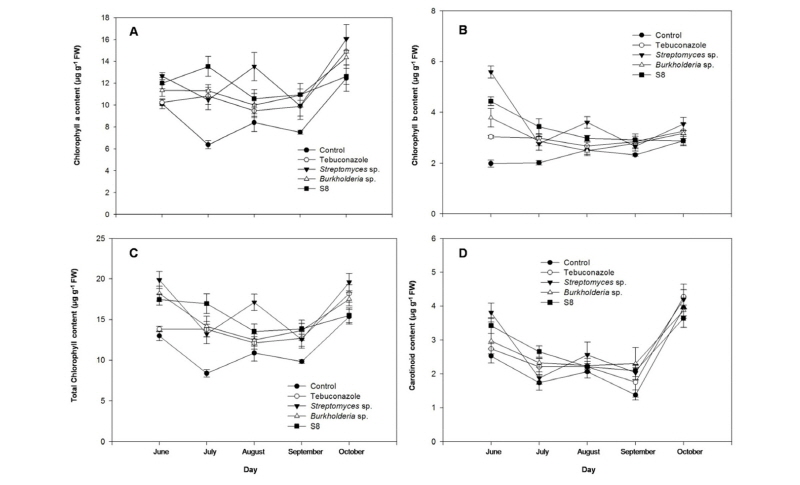
약제와 균주 처리에 따른 시기별 엽록소와 카로티노이드 함량 변화를 알아보기 위해 2016년 6월 24일, 7월 25일, 8월 26일, 9월 23일, 10월 28일 잎 시료를 채취하여 분석을 수행하였다. 엽록소와 카로티노이드 함량은 Lichtenthaler (1987)의 방법에 준하여 생체시료 0.05 g을 100% acetone 용매에 균질화한 후 10분간 4°C에 2,800 g로 원심분리하여 상등액을 661.6, 644.8 nm의 파장에서 분광광도계(UV-1800, Shimadzu, Japan)로 흡광도를 측정하고 엽록소 농도를 다음 식에 대입하여 계산하였다.
Chl a = (11.24×A661.6)-(2.04×A644.8)
Chl b = (20.13×A644.8)-(4.19×A661.6)
Chl a+b = (7.05×A661.6)+(18.09×A644.8)
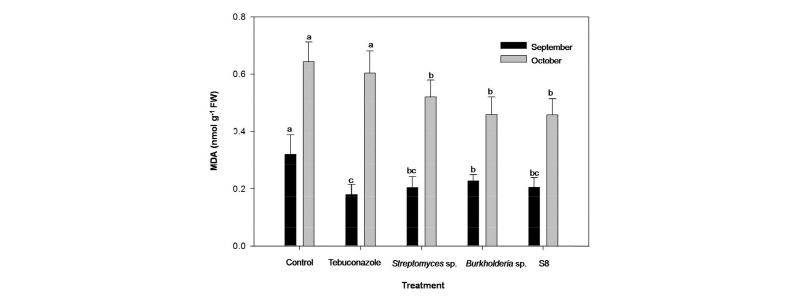
MDA (malondialdehyde)와 Proline 농도
지질의 산화는 불포화지방산의 분해산물인 malondialdehyde (MDA) 농도로 측정하였다. MDA 농도는 Heath and Pacher (1968)의 방법에 준하여 2016년 9월 23일과 10월 28일에 채취한 잎 생체시료 0.2 g을 5 mL의 5% trichloroacetic acid (TCA) 용매에 균질화한 후 20분간 4°C에 12,000 g 원심분리(5810R, Eppendorf, Germany)하였다. 2 mL의 상징액에 2 mL의 0.6% thiobarbituric acid (TBA) 용매를 첨가한 뒤 15분 동안 80°C 항온수조에 끓였다. 추출 용매를 다시 4°C에 10분간 12,000 g로 원심분리한 후 분광광도계(UV-1800, Shimadzu, Japan)로 450, 532, 600 nm의 파장에서 흡광도를 측정하여 다음 식에 대입 하여 계산하였다.
MDA(nmoll-1) = 6.45×(A532-A600)-0.56×A450
통계분석
통계분석은 SAS 프로그램(Cary, NC, USA)을 사용하여 Duncan다중검정을 실시하였고, 처리구 평균간 유의성 검정은 5% 수준에서 유의성을 실시하였다.
결과 및 고찰
균학적 특징을 이용한 갈색퍼짐병 병원균 밀도 조사
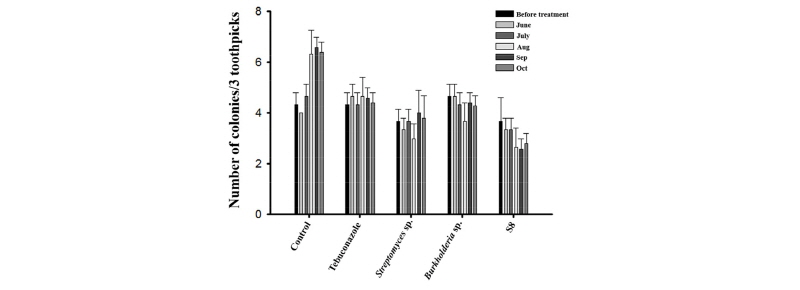
경남 산청군에 위치한 잔디재배지역에서 미생물을 이용하여 갈색퍼짐병 방제효과 및 병원균 밀도 변화 조사를 실시하였다(Fig. 1). 미생물을 처리하기 전 조사결과는 무처리구, Tebuconazol 처리구에서 평균 4.3으로 조사 되었다. Streptomyces sp., Burkholderia sp., Streptomyces S8 처리구에서는 각 3.6, 4.6, 3.6로 조사 되었다. 그 후 Tebuconazole살균제, 각 미생물을 처리 한 후 갈색퍼짐병 병원균 밀도를 조사한 결과 무처리구에서는 6~9월 달까지는 매달 병원균의 밀도가 증가하여 9월 조사에서 결과 이쑤시개당 평균 6.6으로 높게 조사되었다. 그 후 마지막 조사 결과에서는 6.4로 밀도가 감소하는 것을 확인 할 수 있었다. 대조약제인 Tebuconazole 처리구에서는 이쑤시개당 평균 4 이상으로 조사되었으며, 8월 조사 결과 최대 4.6까지 조사되었다. Tebuconazole 처리구에서는 비병원균의 밀도가 (4-5) 일정하게 유지되는 것으로 조사되었다. Streptomyces sp. 처리구에서는 6, 7월에는 3.3에서 3.6으로 증가하였다가 9월 병원균 밀도는 4.0으로 나타났으며 10월 조사에서 3.8로 감소하는 것을 확인 할 수 있었다. Burkholderia sp. 처리구 에서는 다른 미생물 제제 보다 병원균 밀도가 높게 나타났으며, 10월 결과에서는 Tebuconazole 처리구와 유사한 4.3으로 관찰되었다. 마지막으로 Streptomyces S8 처리구에서는 매달 병원균의 밀도가 감소하는 것으로 확인 되었다. 또한, Streptomyces sp. S8 처리구에서 10월달 병원균 밀도가 다른 처리구 보다 현저히 낮은 2.8로 확인되었다. 이러한 결과는 갈색퍼짐병의 화학적 방제를 보완하는 친환경 방제 미생물의 실용성적인 가치를 나타낸다고 사료된다. 사용된 미생물이 갈색퍼짐병 병원균에 유리한 환경인 데취(Hwang and Choi, 1999; Kim, 2006)에 성공적으로 정착하여, 방제 효과를 나타내는 것으로 사료된다(Lee et al., 2015a). 하지만 본 실험에서는 갈색퍼짐병에 대한 친환경적 방제효과를 검증하였음으로, 다른 여러가지 병해 또는 환경적 스트레스에 대한 효과 검증을 통하여 활용도를 평가하여야 할 것으로 판단된다.
qRT-PCR을 이용한 갈색퍼짐병 병원균 밀도 조사
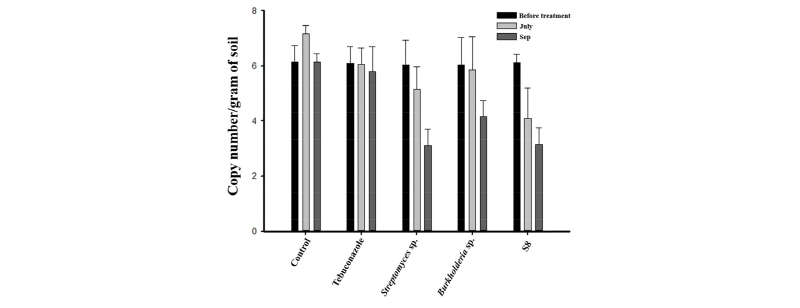
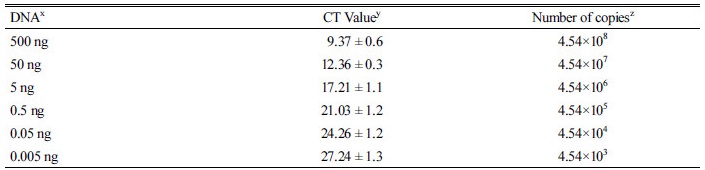
병원균을 정량적으로 검출하기 위하여 표준밀도를 설정한 결과 DNA 500 ug이 4.54×108 cfu/mL였으며 CT (Cycle Threshold)값의 평균은 9.37 ± 0.6 이였다. 표준농도를 설정하여 각 각의 시료를 기준의 10-3부터 10-8 까지 희석하여 각각의 농도별 CT값을 구하였다(Table 3). 표준농도에 대한 정확성 측정은 표준곡선(Standard Curve)의 R2 값이 0.993으로 정확한 결과를 나타낸 다는 것을 확인되었다(data not shown). 작성된 표준농도를 바탕으로 각의 실험 구에서 갈색퍼짐병의 밀도를 조사한 결과 산청군 잔디 재배지에 상기에 서술한 Tebuconazole 및 미생물을 처리하기 전에는 모든 처리구에서 병원균의 밀도가 106으로 조사되었다(Fig. 2). Tebuconazole 및 미생물을 처리한 결과 무처리구에서는 병원균의 밀도가 증가하거나 밀도를 유지한 반면 Tebuconazole처리구에서는 9월에 Tebuconazole처리전 보다 밀도가 다소 감소하였다. Streptomyces sp. 처리구에서는 조사 시기 (6월 24일, 7월 25일, 8월 26일, 9월 23일, 10월 28일) 마다 병원균의 밀도가 점진적으로 감소하는 것을 확인할 수 있었으며 9월 결과 103으로 나타났다. Burkholderia sp. 처리구에서도 동일하게 병원균의 밀도가 점진적으로 감소하였지만 최종 조사 결과 병원균의 밀도가 104으로 다른 미생물 처리구 보다는 높게 나타났다. 마지막으로 Streptomyces sp. S8 처리구는 7월 병원균의 밀도가 가장 적은 104으로 확인되었고, 이 후 9월에는 103으로 감소하였다. 갈색퍼짐병을 방제하기 위해서 농약 및 미생물을 처리하여 토양속 병원균의 밀도를 조사한 결과 농약보다 미생물이 병원균 밀도 관리 및 병발생 억제에 더욱 효과적인 것으로 나타났다. qRT-PCR 분석을 통한 갈색퍼짐병의 병원균 밀도 변화 분석 결과, 이쑤시개를 이용한 병원균 밀도 진단과 유사한 결과를 보였다. 잔디재배지 또는 골프장에서 갈색퍼짐병 병원균의 밀도는 비교적 간단한 이쑤시개를 이용하여 진단결과를 신뢰 할 수 있을 것으로 사료된다. qRT-PCR 결과도 잔디 유용미생물이 병원균의 밀도를 효과적으로 억제하는 것으로 나타난 것은, 유용미생물 특히 Streptomyces sp. S8균주는 잔디 대취 또는 근권에서 처리 후 밀도를 지속적으로 유지함(Lee et al., 2015a)으로 병원균의 성장을 효과적으로 억제하여 발병 및 병원균 증식을 억제하는 것으로 사료된다.
Table 3. Detection level of qRT-PCR for Rhizoctonia solani AG-2-2 specific detection.
|
|
xGenomic DNA Density, yCT (Cycle Threshold) Value, zCFU (Colony Forming Unit)/mL. |
들잔디의 생육특성
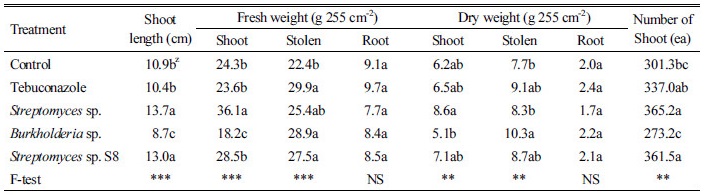
갈색퍼짐병이 발생한 들잔디 재배지역에 갈색퍼짐병을 방제하기 위하여 Tebuconazole 약제 및 Streptomyces spp.와 Burkholderia sp. 미생물을 처리한 결과 약제와 미생물을 처리하지 않은 무처리구에 비해 Tebuconazole 약제 처리구, Streptomyces sp., Burkholderia sp.와 Streptomyces sp. S8 미생물 처리구는 잔디의 생육이 유의적으로 향상된 결과를 나타내었다(Table 4와 Fig. 3). 초장의 경우 무처리구에 비해 Streptomyces sp.와 Streptomyces sp. S8 처리구는 각각 25.7%와 19.3%으로 유의하게 증가하였다. 지상부의 생체중과 건물중은 무처리구에 비해 Streptomyces sp.와 Streptomyces sp. S8 처리구가 유의한 증가를 관찰되었으며 Streptomyces sp. 처리구는 생체중과 건물중 각각 48.6과 38.7%로 가장 많이 증가하였다. 포복경의 생체중과 건물중은 무처리구에 비해 Tebuconazole, Streptomyces sp., Burkholderia sp.와 Streptomyces sp. S8 처리구 모두 유의한 증가를 나타내었다. 일반적으로 트리아졸계 농약은 잔디의 생육저하를 초래하는 것으로 알려져 있으나(Shim, G.Y., personal communication), 본 연구에서 Tebuconazole에 의한 생육저해 현상은 관찰되지 않았다. 실험포장에서 갈색마름병이 대발생하지는 아니하였지만, 무처리에 비하여 Tebuconazole 처리에서 병원균의 밀도가 억제 되는 결과와 더불어, 잔디생육저해 현상이 관찰되지 아니한 것은, 약제에 의한 보호 효과가 병원균에 의한 저해 효과를 상쇄한 것으로 사료된다. 지하부의 생체중과 건물중은 유의한 차이를 나타내지 않았다. 지상부 개체수는 무처리구 301.3개에 비해 Tebuconazole 처리구 337.0개, Streptomyces sp. 처리구 365.2개, Streptomyces sp. S8 처리구 361.5개로 각각 11.8, 21.2와 20.0%로 유의한 증가를 나타내었다. 갈색퍼짐병을 방제하기 위해 약제처리에 비해 토양 미생물을 처리하였을 때 잔디생육 향상에 도움이 되었음을 알 수 있었고, 특히 Streptomyces sp.와 Streptomyces sp. S8 처리구가 다른 처리구에 비해 잔디의 생육과 밀도가 유의성 있게 증가하여 효과적인 방제가 이루어진 것으로 판단되었다.
엽록소와 카로티노이드 함량
Tebuconazole 약제 및 Streptomyces spp.와 Burkholderia sp. 미생물을 처리한 결과 시험기간 내에 잔디재배 및 관리를 위하여 비료와 잔디깎기에 의해 시기별로 엽록소와 카로티노이드 함량의 차이는 있었지만 각 시기의 처리구간의 엽록소와 카로티노이드 함량은 유의한 차이를 보였다(Fig. 4). 약제와 미생물을 처리하지 않은 무처리구에 비해 Tebuconazole 약제 처리구, Streptomyces sp., Burkholderia sp.와 Streptomyces sp. S8 미생물 처리구에서 엽록소와 카로티노이드 함량이 증가하였다. 엽록소 a 함량의 경우 10월에 가장 높은 함량을 나타내었고, 6월부터 10월까지 평균 엽록소 a 함량은 무처리구에 비해 Tebuconazole, Streptomyces sp., Burkholderia sp.와 Streptomyces sp. S8 처리구가 각각 27.1, 42.3, 33.8와 40.8%로 증가한 결과를 보였다(Fig. 4A). 엽록소 b 함량은 6월에 가장 높은 함량을 보였고, 6월부터 10월까지 평균 엽록소 b 함량의 경우 무처리구에 비해 Tebuconazole, Streptomyces sp., Burkholderia sp.와 Streptomyces sp. S8 처리구가 각각 28.5, 59.7, 32.1와 47.3%로 증가하였다(Fig. 4B). 전체 엽록소 함량은 엽록소 a 함량과 유사한 경향을 나타내었고(Fig. 4C), 카로티노이드 함량은 10월에 가장 높은 함량을 나타내었으며, 6월부터 10월까지 평균 함량은 무처리구에 비해 Tebuconazole, Streptomyces sp., Burkholderia sp.와 Streptomyces sp. S8 처리구가 각각 15.6, 27.3, 25.1와 28.0%로 증가하였다(Fig. 4D). 이러한 결과를 통해 엽록소와 카로티노이드 함량은 Streptomyces sp.와 Streptomyces sp. S8 처리구가 가장 높게 나타나 토양미생물 처리로 인해 갈색퍼짐병으로 인한 잎마름증상이 완화됨을 알 수 있었고, 10월에 총 엽록소와 카로티노이드 함량이 높은 것으로 보아 오랫동안 녹색을 유지하는데 도움이 되었다고 판단되었다. 주로 갈색퍼짐병의 잔디는 엽신, 엽초, 관부에 Rhizoctonia spp.이 침입하여 황변하여 말라죽는 잎마름증상을 보이는데(Endo, 1961; Dale, 1978; Smiley, 1983; Couch and Haygood, 1990) 이러한 병징으로 잔디가 건조에 대한 스트레스가 발생하여 수분이 부족하면 전반적으로 기공이 닫힘으로 인해 엽록체가 대기의 이산화탄소를 공급받지 못하게 되어 탄소동화율이 감소되고, 세포내에 유해한 활성산소종들이 생성되어 엽록체나 미토콘드리아의 전자전달을 저해하고, 엽록소 함량과 성분의 변화와 광합성 기구의 손상으로 인해 식물의 광합성 능력이 감소된다고 하였다(Monakhova and Chernyad, 2002).
MDA (malondialdehyde)와 프롤린 함량
Tebuconazole 약제 및 Streptomyces spp.와 Burkholderia sp. 미생물을 처리한 결과 약제와 미생물을 처리하지 않은 무처리구에 비해 Tebuconazole 약제 처리구, Streptomyces sp., Burkholderia sp.와 Streptomyces sp. S8 미생물 처리구에서 MDA (malondialdehyde)함량이 유의하게 감소하였다(Fig. 5). 9월의 경우 무처리구와 Tebuconazole 처리구는 유의한 차이를 나타내지 않았고, 무처리구에 비해 Streptomyces sp., Burkholderia sp.와 Streptomyces sp. S8 처리구가 각각 36.0, 29.2와 35.7%로 유의하게 감소하였다. 10월은 무처리구에 비해 Tebuconazole, Streptomyces sp., Burkholderia sp.와 Streptomyces sp. S8 처리구가 각각 6.2, 19.1, 28.8과 28.9%로 유의한 감소를 나타내었다. 본 결과를 통하여 약제와 미생물을 처리하지 않은 무처리구의 경우 병원균에 의해 잔디의 세포막이 손상을 받았으며, 반면에 토양미생물인 Streptomyces sp., Burkholderia sp.와 Streptomyces sp. S8 처리에 따라 병원균 밀도 감소로 갈색퍼짐병의 증상이 완화되어 정상적인 잔디로 생육이 된 것으로 판단되었다.
식물은 생장과정에서 다양한 환경뿐만 아니라 병해에 대한 스트레스에 노출된다. 식물이 스트레스를 받으면 활성산소로 인해 지질 과산화와 같이 산화적 손상을 야기한다고 하였다(Scandalios, 1993). 세포막을 구성하는 불포화 지방산을 특히 산화과정에서 발생하는 singlet oxygen, hydroxyl radical의 피해를 심하게 받는데 세포내 구조물로 지방 과산화수소물질들(lipid hydroperoxides)을 생성하게 되어 세포막의 유동성을 감소시키고 세포 내부로부터의 전해질 유출을 촉진시켜 2차적인 세포막 단백질의 피해를 가져오게 된다(Moller et al., 2007). 갈색퍼짐병 병원균은 Zoysiagrass등의 난지형 잔디와 Bentgrass등의 한지형 잔디에서 주로 엽신, 엽초 관부에 침입하여 잎마름증상을 일으킨다(Couch and Haygood, 1990). 이러한 잎마름증상은 잔디에게 산화적인 스트레스를 야기시키는 원인이 되어 세포막 손상으로 인해 세포 내 과산화를 일으켜 지질의 과산화가 진행되어 MDA 함량이 증가되는 것으로 판단된다.
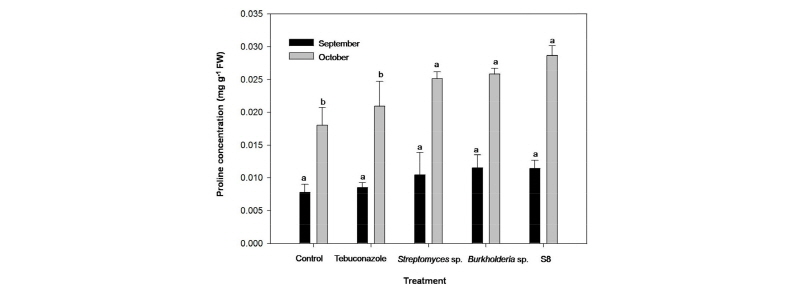
프롤린 함량은 9월에는 처리구간의 유의한 차이를 보이지 않았고, 10월의 경우 무처리구와 Tebuconazole 처리구는 유의한 차이를 나타내지 않았지만 무처리구에 비해 Streptomyces sp., Burkholderia sp.와 Streptomyces sp. S8 처리구는 각각 39.1, 43.2와 58.6%로 유의하게 증가하는 결과를 나타내었다(Fig. 6). 프롤린은 잎에 축적되어 기공개폐를 조절하고, 삼투스트레스의 적응과 연관된 효소 활성이나 세포막과 소기관들의 항상성 유지를 위한 삼투보호제 작용(Delauney and Verma, 1993)과 hydroxyl radicals를 제거하는 기능이 있다(Smironff and Cumbes, 1989). 라지팻취에 감염된 잔디에서 프롤린 축적을 조사한 결과 병원균에 감염된 잔디는 감염되지 않은 정상적인 잔디에 비해 프롤린 농도가 증가하여 스트레스를 나타내는 민감한 지표물질로서 의미가 있다고 보고된바 있다(Kim et al., 2007). 본 실험 결과의 경우 무처리구에 비해 토양미생물 처리구에서 프롤린 함량이 증가한 것으로 보아 단지 스트레스에 의한 피해 증상이라기 보다는 토양미생물 작용에 따른 프롤린 함량의 증가로 잎마름증상에 대한 삼투보호제로 작용하여 토양미생물이 갈색퍼짐병 병원균에 감염된 잔디에 대해 효과적인 방제가 이루어진 것으로 판단되었다.