서론
유전자변형(living modified; LM) 작물은 생명공학기술을 통해 제초제 저항성, 해충 저항성 등의 형질을 작물에 도입한 것으로서 재배가 용이하고 산업적으로 유용하여 전 세계적으로 재배 면적이 꾸준히 증가하고 있다. International Service for the Acquisition of Agri-biotech Applications (ISAAA)의 보고에 따르면 LM작물의 재배 면적은 2016년에 1억 8,510만 ha로 세계 전체 농지 면적의 약 13%에 달하였다(ISAAA, 2016). 이와 같이 전 세계적으로 LM작물의 재배 규모가 증가함에 따라 환경 방출에 대한 우려가 커지고 있으며 실제 LM작물의 환경 방출 사고 역시 꾸준히 발생하고 있다(Price and Cotter, 2014). 국외의 경우 2000년 영국의 LM유채 혼입과 2013년 미국 LM밀 혼입 사례 등 도입 유전자 이동, 일본 LM유채 잡초화 등 LM작물의 비의도적 환경 방출로 인한 부정적인 사례가 보고된 바 있다(GeneWatch UK and Greenpeace International, 2005; Katsuta et al., 2015; Nishizawa et al., 2009). 국내에서도 식용‧사료용으로 수입된 LM작물의 운송 경로를 따라 비의도적 방출이 발생한 사례들이 여러 차례 보고되었으며(Kim et al., 2006; Lee et al., 2009; Shin et al., 2016) 특히 2017년 전국적 규모로 발생한 미승인 LM유채의 환경 방출 사고로 인해 LM작물이 생태계에 미칠 위해성에 대한 우려가 더욱 높아지고 있다. LM작물이 자연 생태계에 방출되면 화분 또는 종자의 형태로 도입유전자가 시공간적으로 확산되고, 잡초화 등에 의해 생태계 내 지속성을 획득하게 되어 생태계 교란, 생물다양성 감소 등 부정적인 영향을 미칠 수 있다(AgBiosafety, 2018). 따라서 LM작물의 위해성 평가는 도입 유전자의 ‘확산’ 및 ‘지속성’을 장기적 관점에서 고려하여 수행되어야 하며, 작물종이나 도입 유전자의 특성에 따라 LM작물이 미치는 영향이 다양하므로 사례별 평가를 원칙으로 한다. 또한 동일한 LM작물이라도 노출되는 환경에 따라 위해도가 크게 달라지므로 방출된 주변 생태계의 특성을 고려해야 한다(Biosafety Clearing House, 2016).
LM콩은 전체 LM작물 재배 면적의 약 50%에 달하는 9,140만 ha에서 재배되고 있는 가장 주요한 LM작물 중 하나이다(ISAAA, 2016). 재배콩(Glycine max)은 자식성 작물로서 포장 조건에서의 자연교잡율이 1-4.5%로 보고되었다(Caviness, 1966; Gumisiriza and Rubaihayo, 1978). 주요 LM콩 재배국인 브라질, 미국 등은 야생콩이 자생하지 않으므로 도입 유전자의 확산 측면에서 비교적 안전한 반면, 한국을 포함한 동아시아는 콩의 원산지로서 다양한 야생종이 자생하고 있으며 LM콩으로부터 일년생 야생콩인 돌콩(Glycine soja)으로의 유전자 이동이 최대 5-8 m까지 발생 가능한 것으로 보고되어(Chen et al., 2007; Mizuguti et al., 2010; Park et al., 2016) LM콩의 환경 방출 시 생태계 교란 및 생물종 다양성의 심각한 훼손이 발생할 가능성이 있다.
LM콩은 생태계로 방출된 후 유전자 이동 및 잡초화에 의해 환경 위해성을 나타낸다. 이 때 LM콩 자체 또는 LM작물과 근연종 간 교잡후대의 잡초화 가능성을 고려해야 하며, 장기적으로는 교잡후대를 매개로 하여 원연종으로까지 유전자 이동이 발생할 가능성도 배제할 수 없다(Heinemann, 2007). 다만 LM콩 또는 도입 유전자 이동에 의한 교잡후대종이 생태계로 방출되어도 선택압력(selection pressure)에 의해 생장 및 세대 진전 과정에서 자연 도태될 수도 있기 때문에(Lim et al., 2015; Snow et al., 2005) LM콩의 잡초화 가능성 평가는 LM콩과 근연종(재배콩 및 자생 야생종) 간 교잡 가능성뿐 아니라 적응력(fitness)을 함께 고려하여 수행되어야 한다. 국내 농업생태계에서 LM콩과 야생콩 간 교잡후대종이 생장 및 세대 진전 중 첫 번째로 받게 되는 선택압력은 종자의 휴면발아능력이며, 이후 생활환에 따라 생육 시기별 적응력에 의해 생존 및 생장 여부가 결정된다. LM콩과 야생콩 간 교잡후대 종자가 활력 있는 상태로 월동하여 다음 주기에 발아한 이후 영양생장기, 생식생장기를 거쳐 종자생산이 가능한 경우 자식을 통해 세대 진전이 이루어지므로 유채 등 타가수분 작물에 비해 도입 유전자가 희석되지 않고 생태계에 지속할 수 있다. LM콩과 그 교잡후대종의 영양생장기, 생식생장기 적응력 및 종자생산성에 관한 연구는 해외에서는 Horak et al. (2007)이 LM콩과 재배종 간 비교 연구를 수행하였고, Kubo et al. (2013)이 교잡후대종의 적응력에 관해 일부 연구하여 보고하였으나 여전히 매우 제한적이며, 국내 환경에서는 LM콩 및 근연종의 월동성 및 개체군 지속 여부에 관한 연구(Ko et al., 2016) 및 LM콩 및 야생콩 간 교잡후대종의 종자 특성 연구(Park et al., 2016)가 일부 보고되었으나 LM콩 및 교잡후대의 적응력 평가 연구는 아직 부족한 실정이다.
따라서 본 연구는 LM콩과 근연종인 재배콩과 야생콩의 생육시기별 영양생장특성과 종자생산을 포함한 생식생장특성의 비교를 통해 이들의 잡초화 가능성을 평가하여 LM콩과 근연종간의 교잡종의 잡초화 가능성 평가의 기초 정보를 확보하고자 수행되었다.
재료 및 방법
공시재료
LM콩과 재배콩 및 야생콩의 잡초화 가능성 관련 생장 특성을 평가하고자 LM콩과 야생콩인 돌콩(Glycine soja cv. IT 182932, 2n=40) 및 LM콩의 모품종인 광안콩(Glycine max cv. Kwangan-kong, 2n=40)을 공시하였다. 광안콩과 LM콩은 동아대학교에서 돌콩은 한국생명공학연구원에서 분양 받았고 LM콩의 경우 선발마커로 제초제 glufosinate 저항성 유전자(bar-gene)가 삽입되어 있어 추후 제초제 약량 반응 평가 시 활용하였다.
영양생장특성 평가
LM콩과 재배콩 및 야생콩의 생장특성을 평가하기 위하여 광안콩, LM콩, 돌콩 을 LMO격리온실조건에서 제2본엽기까지 육묘한 후 서울대학교 LMO격리포장에 이식하였다(LMO 환경방출시험 승인 제2015-002호). 대상종의 생장특성평가는 국내 농업생태계에서의 콩 생육시기를 고려하여 2015년 5월부터 11월까지 야외 격리포장에서 수행되었으며 각 대상종은 6개체씩 정식되었다. LM콩과 근연종의 잡초화 관련 특성 평가 지표 및 조사 방법은 기 보고된 콩의 생장특성 평가 연구 사례 및 LM작물의 적응력 평가 연구 사례 등을 참고하여 선정하였다(Table 1). 영양생장특성 평가는 5월부터 7월까지 이루어졌으며 각 대상종의 초장, 경장, 경경은 이식 후 70일까지 매 10일마다 digital caliper를 이용해 측정하였고 엽면적은 개화개시일에 각 개체별로 가장 넓은 6개의 잎을 취하여 찍은 사진을 Photoshop (Adobe Photoshop CC 2014, USA) 프로그램으로 계산하였다.
|
Table 1. Parameters measured to assess growth characteristics of LM soybean and its relative soybeans. 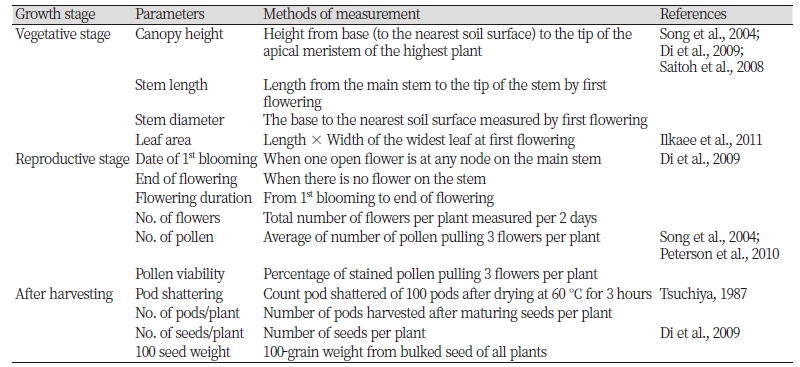
|
생식생장특성 평가
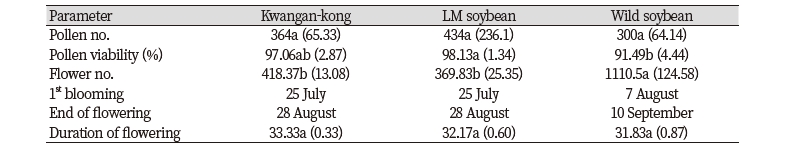
생식생장특성 평가는 영양생장특성 평가와 동일한 포장에서 2015년 8월부터 11월까지 이루어졌으며 각 대상종의 개화개시일, 개화종료일, 화기 수, 화분 수 및 화분 활력을 조사하였다(Table 1). 화기 수는 개화개시일부터 2일 간격으로 조사하였다. 화분 수 및 화분 활력은 각 식물체 당 3개의 화기를 취하여 측정하였다. 각 개체별로 채취한 화기의 화분을 Alexander 염색 용액으로 10분 간 염색한 뒤 현미경으로 관찰하여 화분 수 및 화분 활력을 조사하였다. 모든 조사는 6개의 개체 반복으로 수행되었다.
종자생산특성 평가
LM콩과 근연종의 종자생산특성 평가를 위하여 개체 당 꼬투리 수, 개체 당 종자 수 및 백립중, 탈립율을 측정하였다. 각 대상종은 포장 내 6개체씩 정식되었으며 자가수분을 통해 후대 종자를 얻고자 서로 다른 종과 최소 10 m 이상 격리되도록 배치하여 종 간 유전자 이동을 방지하였다. 개체 간 거리가 멀어질수록 유전자 이동률이 감소하며, 선행 연구를 통해 밝혀진 최장 유전자 이동 거리가 재배콩-재배콩 간 5.4 m (0.05%), 재배콩-야생콩 간 8 m (0.097%)로 보고되었으므로(Chiari et al. 2011; Mizuguti et al., 2010; Ray et al., 2003), 본 연구의 평가 대상종 간 이격 거리는 이를 고려하여 결정하였다. 2015년 11월 대상종별로 각 6개체씩에서 성숙된 꼬투리를 전량 수확하여 60℃에서 3시간 건조시킨 후 종자생산특성 관련 지표를 조사하였다(Table 1).
제초제 약량 반응 평가
본 연구에 사용된 LM콩은 AtSIZ 유전자 카세트 내에 선발마커로 제초제 glufosinate 저항성 유전자(bar-gene)가 삽입되어 있다. 도입 유전자 효과를 확인하기 위해 LM콩과 광안콩 및 야생콩을 대상으로 제초제 약량 반응 평가를 수행하였다. 야생콩의 경우 단단하고 두꺼운 종피를 지니고 있어 균일한 발아 유도를 위해 물리적 휴면 타파를 실시하였다. 각 대상종의 종자를 상토로 채워진 200공 다공포트에 파종하고 제 1본엽기에 glufosinate-ammonium (Basta®, 1.2 g ai L-1, Bayer CropScience Ltd., Korea)을 처리하였다. 처리 약량은 각 0, 0.15, 0.3, 0.6, 1.2, 2.4, 4.8 및 9.6 g a.i. L-1로 8002노즐(TP8002E, Teejet, USA)이 장착된 제초제 살포장비(Track sprayer, R&D Sprayers, USA)를 사용하여 물 살포량이 600 L/ha이 되도록 살포하였다. 제초제 처리 14일 후 생존 개체를 판별하여 약량 반응을 평가하였으며, 본 실험은 3반복으로 수행되었다.
통계분석
평가 대상종의 영양생장, 생식생장 및 종자생산과 관련된 특성은 분산분석(ANOVA)을 실시한 후 통계적 유의성이 확인된 경우 각 대상종간의 비교를 위해 던컨다중검정(Duncan’s multiple range test, DMRT) 또는 최소유의차(least significant difference, LSD) 검정을 실시하였다. 제초제 glufosinate 약량에 따른 생존율(Y)은 아래의 log-logistic 모델로 비선형회귀분석을 통해 분석하였다(Streibig, 2009).
Y는 제초제 처리 후 생존율, Y0는 무처리 대조군의 생존율이며, b는 곡선의 기울기이다. GR50는 무처리 대조군의 생존율을 50% 감소시키기 위해 요구되는 제초제 약량을 의미한다. 모든 통계분석은 Genstat (Genstat 5 Committee, 1997)을 이용하여 실시되었다.
결과 및 고찰
영양생장특성
LM콩과 그 모품종인 광안콩, 야생콩인 돌콩의 영양생장특성을 비교한 결과, LM콩과 광안콩의 영양생장특성은 통계적으로 유의한 차이 없이 매우 유사한 경향을 보였으며 야생콩은 다른 종과 확연히 다른 영양생장특성을 지니고 있었다(Fig. 1). 초관장과 경경 및 엽면적은 광안콩이 야생콩에 비해 매우 우세하였는데 이는 순화되는 과정에서 줄기가 두꺼워지고 광 이용이 용이한 초형으로 선발되었음을 반영한다. 이식 후 70일에 측정한 초관장은 광안콩이 64.75 cm으로 가장 컸고 LM콩(63.27 cm), 야생콩(8.31 cm)의 순서로 작았다. 광안콩, LM콩 및 야생콩의 경경은 각각 14.95, 13.61 및 9.54 mm이었으며, 엽면적은 각각 9.39, 7.41 및 0.76 cm2였다. 반면, 경장은 야생콩이 재배콩에 비해 우세하였으며 특히 생식생장기에 이르렀을 때 그 차이가 극대화되는 경향을 보였는데(Fig. 1B), 이는 야생콩의 포복 및 무한신육하는 생장특성 때문으로 잡초성과 관련이 있는 것으로 판단된다.
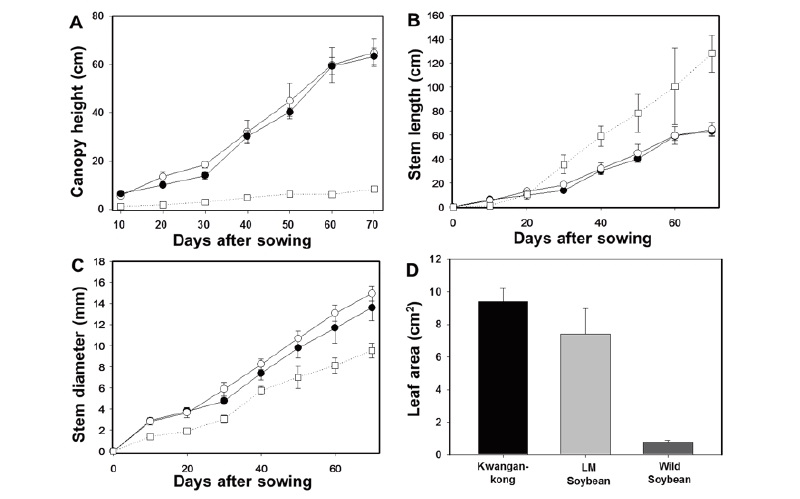
Fig. 1. Vegetative growth characteristics in canopy height (A), stem length (B), stem diameter (C) and leaf area (D) of Kwangan-kong (○), LM soybean (●) and wild soybean (□) measured until 70 days after sowing. Leaf area was measured at 70 days after sowing. The points and the error bars represent the mean values and the standard errors of 6 replications respectively.
각 평가 대상종의 영양생장특성에 대하여 던컨다중검정을 수행한 결과, 95% 유의 수준에서 초관장, 경장, 경경 및 엽면적 모두 LM콩과 광안콩 간 유의한 차이가 없었다. 이를 통해 광안콩에 도입된 염 스트레스 저항성 유전자 AtSIZ 및 제초제 glufosinate 저항성 유전자 bar가 LM콩 영양생장특성에 큰 영향을 미치지 않았음을 확인할 수 있었다. 한편 야생콩은 LM콩을 포함한 재배콩 그룹과 모든 평가 항목에서 통계적으로 매우 유의한 차이를 보여 야생콩이 재배콩 그룹과는 매우 다른 생태계 내 적응성을 갖고 있음을 시사하였다.
생식생장특성
LM콩과 광안콩, 돌콩의 생식생장특성을 비교한 결과(Table 2), 광안콩과 LM콩은 동일하게 7월 25일 개화가 시작되어 8월 28일에 종료되어 도입 유전자가 개화에 영향을 미치지 않았음을 확인할 수 있었다. 야생콩의 경우 재배콩보다 개화 개시가 10일 이상 늦어져 8월 7일부터 9월 10일까지 개화가 이루어졌다. 따라서 평가 대상종 모두 개화 기간이 8월7일부터 8월28일까지 21일 중첩됨을 확인할 수 있었으며 이는 한국의 자연 및 농업생태계에서 화분이동에 따른 유전자 이동이 발생할 가능성이 있다는 것을 시사한다.
웅성 임성을 평가하고자 화분 수 및 화분 활력을 조사한 결과, 모든 대상종은 화분 수는 유의한 차이를 보이지 않았다(P<0.05). 화분 활력은 LM콩이 98.1%로 가장 높았으며 광안콩(97.1%), 돌콩(91.5%) 순으로 낮았다. 평가 대상종 간 차이는 생식생장특성 중 화기 수에서 가장 뚜렷하게 나타났다. 야생콩은 무한신육하는 특성을 보유하고 있어 화기 수가 LM콩과 광안콩보다 3배 이상 많았으며, LM콩과 광안콩 간에는 유의한 차이가 없었다(Table 2). 이러한 결과는 LM콩이 야생콩에 비해 상대적으로 낮은 번식 능력을 지니고 있으며, 이는 도입 유전자에 의한 것이 아닌 모품종인 광안콩의 특성에 의해 결정되었음을 시사한다. 반면에 돌콩은 LM콩이나 광안콩에 비해 번식 능력이 높기 때문에 LM콩으로부터 야생콩으로 유전자 이동이 발생할 수 있으며 이로 인한 교잡후대종은 잡초화 가능성이 높을 수 있음을 시사한다.
종자생산특성
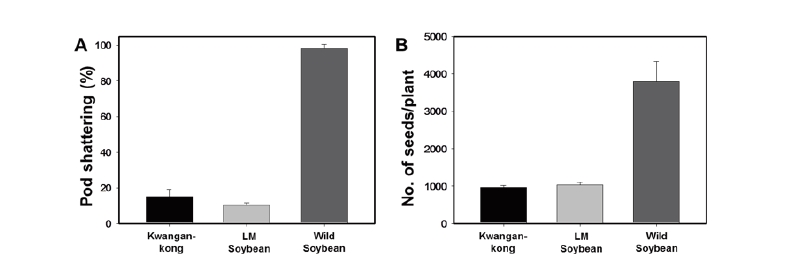
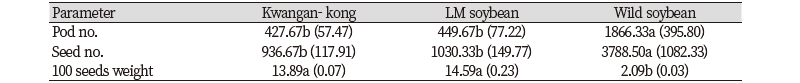
LM콩과 광안콩, 돌콩의 종자생산특성을 평가하고자 LMO 격리포장에서 등숙된 꼬투리를 수확하여 탈립성 및 개체당 꼬투리 수, 종자 수 및 백립중을 순차적으로 조사하였다. LM콩의 탈립성은 10.5%로 야생콩의 98.5%에 비하여 현저히 낮았는데 이는 작물의 순화 과정 중 수확 이전에 토양에 종자가 탈립되지 않도록 탈립성이 낮은 방향으로 선발되어 왔기 때문이다(Fig. 2A).
개체당 꼬투리 수 및 종자 수는 야생콩이 LM콩 및 광안콩보다 월등히 우세하였으며 생식생장특성 중 하나인 화기 수와 마찬가지로 재배콩에 비해 3배 이상 높았다(Fig. 2B, Table 3). 백립중의 경우 LM콩이 14.59 g으로 가장 높았으며 야생콩은 2.09 g으로 현저히 낮은 값을 보였다. 재배콩은 야생콩에 비해 종자 내 저장 양분이 많아 생태계 내에서 발아 후 초기 생육이 우수할 것으로 예상되나 종자의 휴면성 및 수명은 짧을 것으로 판단되며, 야생콩은 저장양분이 적어 발아 후 초기 생육은 다소 부진할 수 있으나 종자의 휴면성 및 지속성이 높아 잡초성은 높을 것으로 예상된다. 따라서 이들의 교잡후대종은 LM콩과 야생콩의 중간적인 잡초화 가능성을 갖고 있을 것이므로 이를 검증하기 위해서는 자연 및 농업환경 조건에서 평가가 이루어져야 할 것이다.
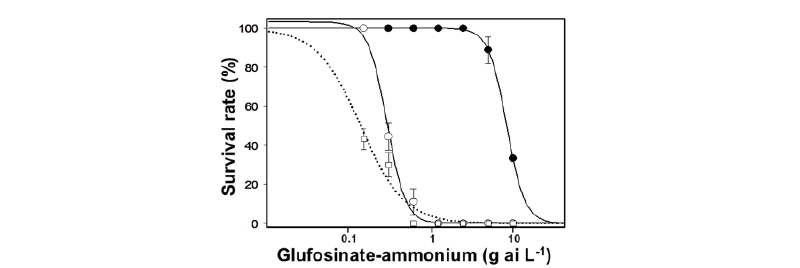
Fig. 3. Dose-responses in the survival rate of Kwangan-kong (○), LM soybean (●) and wild soybean (□) to a range of glufosinate-ammonium doses (recommended dose of 1.2 g a.i. L-1). The points and the error bars represent the mean values and the standard errors of the observed survival rates respectively. The curves represent the fitted line with the log-logistic dose-response model and parameters estimates in Table 4.
제초제 약량 반응
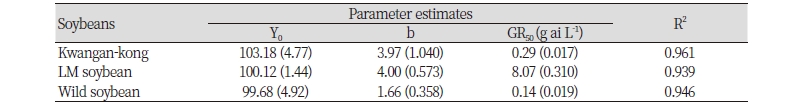
제초제 glufosinate 저항성 형질을 지닌 LM콩, 광안콩 및 돌콩의 제초제 약량 반응을 평가하고자 각 대상종을 제1본엽기까지 전개한 후 glufosinate 약량 반응을 평가하였다. 무처리구 대비 개체 생존율은 광안콩, LM콩 및 돌콩 모두 제초제 glufosinate 처리 농도가 증가에 따라 감소하였다. 콩의 생존율을 50% 감소시키는 데 필요한 제초제 약량(GR50)은 LM콩이 8.07 g a.i. L-1로 광안콩 및 돌콩(0.29, 0.14 g a.i. L-1)에 비해 현저히 높아 저항성 형질을 지니고 있음을 확인하였다(Fig. 3, Table 4). 광안콩과 돌콩의 경우 기준량의 0.5배량인 0.6 g a.i. L-1 이상에서 생존한 개체가 없었으며, 0.5배량 이하에서 광안콩의 생존율이 유의하게 높았다. 이를 통해 제초제 glufosinate가 선택압력(selection pressure)으로 존재하지 않는 조건에서 LM콩과 광안콩 및 돌콩의 생존력은 유사하다고 볼 수 있으나 제초제 선택 압력이 존재할 경우 도입유전자 효과(transgene benefit)에 의해 도입유전자를 지닌 개체들의 경합력이 매우 높아질 것으로 판단된다. 캐나다의 Mason et al. (2003)은 Bt 저항성 LM유채를 재료로 실험을 수행하여 해충 선택 압력이 높을 경우 도입유전자를 지닌 개체의 생식능력이 유지되었음을 보고하였으며, Londo et al. (2010)은 저약량의 제초제 살포 시 일반 품종은 종자생산이 현저히 감소한 반면, 제초제저항성 LM작물은 높은 적응성을 유지하는 결과를 보고하였는데 이는 본 연구의 결과를 뒷받침한다. LM콩의 도입유전자는 기본적으로 우성 형질이므로 근연종으로 유전자 이동이 발생할 경우 교잡후대가 도입형질을 획득하므로 선택 압력이 존재하는 조건 하에서는 생존성 및 경합력이 증가하여 생태계에 영향을 끼칠 것으로 예상된다.
LM콩 및 교잡후대종의 잡초화 가능성
이상의 연구결과를 종합하면 초관장, 경경, 엽면적 등의 영양생장특성에서 LM콩은 모품종인 광안콩과 유사한 특성을 보이며, 야생콩인 돌콩에 비하여 직립형의 초형을 지니며 줄기가 두껍고 엽면적이 넓어 광 이용 효율이 높은 형태를 지니고 있다. 반면, 경경은 무한신육형인 돌콩이 재배콩에 비하여 유의하게 긴 것으로 나타났다. 한편 화기 수, 꼬투리 수 및 종자 수는 돌콩이 LM콩에 비하여 월등히 높았으며, 종자 탈립성 역시 높아져 등숙기 이후 종자가 탈립된 후 토양에 혼입되어 seedbank를 형성할 우려가 높다고 할 것이다. 재배콩은 일반적으로 경합력이 낮아 다른 식물과 경쟁을 잘 하지 못하므로 잡초로서의 특성을 나타내지 않는 것으로 보고되었으나, 야생콩은 다양한 생육 환경에서 높은 적응력을 보이는 것으로 알려져 있다(OECD, 2000). 본 연구에서 LM콩은 선택 압력이 존재하지 않는 환경에서는 대체로 모품종인 광안콩과 같은 특성을 보여 생태계로 유입되더라도 LM콩 자체가 직접적으로 잡초화될 가능성이 크지 않을 것이나 제초제 glufosinate가 처리되는 제초제 선택압력이 존재할 경우 생존 및 경합력이 유지될 수 있을 것이다. 또한 LM콩의 근연종인 재배콩 및 야생콩과 충분한 기간 동안 개화기간이 중첩되어 유전자 이동 가능성이 존재한다. Park et al. (2016)에 따르면, LM콩 및 LM콩-야생콩 간 교잡후대종 종자는 높은 휴면성을 띠고 있으므로 토중에 한 번 seedbank를 형성할 경우 토양 중 지속성 및 집단 규모의 증가가 예상되어 잡초화 가능성이 있다고 보고하였다. 따라서 LM콩 및 근연종 간 교잡후대종에 대한 추가적인 생장 및 생식 특성 평가 연구를 통해 교잡후대종의 잡초화 가능성을 종합적으로 평가하기 위한 연구가 필요하다.
본 연구에서 제시한 LM콩과 근연종 간 생육단계별 생장특성의 정량적 평가 결과는 국내 농업환경에서 LM콩의 잡초화 가능성을 평가하기 위한 기초 정보로 활용될 수 있을 것으로 기대된다. 다만 LM콩이 자연 및 농업 생태계 내에서 잡초화되기 위해서는 주변 잡초들과의 경합에서 생존할 수 있는지를 고려해야 하므로 차후 연구를 통해 LM콩-근연종 간 교잡후대종의 환경 적응성과 관련된 생장 및 생식특성에 대한 장기적 검토가 이루어진다면 보다 종합적인 잡초화 가능성 평가가 가능할 것이다.
Acknowledgements
This research was supported by Rural Development Administration, Republic of Korea (Project code PJ01370201; Project of LMO Environmental Risk Assessment Center). We acknowledge Prof. Young-Soo Chung of Dong-A University and Dr. Soon-Chun Jeong of Korea Research Institute of Bioscience and Biotechnology (KRIBB) for providing LM soybean and wild soybean seeds, respectively.