생물학적 특성
개쑥갓(Senecio vulgaris L.)는 초롱꽃목(Campanulales) 국화과(Asteraceae/Compositae)에 속하는 일년생 혹은 동계일년생식물이다. 초장은 10-40 cm이고, 줄기는 속이 비어있고 가는 흰색 털이 있으며 주로 적자색이다. 잎에는 큐티클층이 잘 발달하여 광택이 있고, 엽신은 불규칙한 톱니모양이다(Fig. 1A). 식물체 하부의 잎은 엽병이 있으며, 로제트형으로 나고(Fig. 1A), 줄기의 잎은 호생으로 줄기를 감싼다. 황색 두상화가 산방화서를 이루고, 설상화는 없다(Fig. 1B). 끝이 검고 뾰족한 총포편(involucral scale)이 2줄로 나 있다. 개화기는 4-10월이라고 알려져 있으나, 여름을 제외하고 연중 개화한다. 관모(pappus)는 백색이며 쉽게 떨어진다. 수과는 2 mm 내외이며 원통형이고 미세한 털이 있다(Fig. 1C). 한 개체는 200-300여개의 두상화(capitulum)를 피우며, 한 두상화는 약 50여개의 종자가 맺혀 전체적으로 약 10,000-15,000개의 종자를 생산한다(Kim et al., 2018). 종자는보통 바람에 날려 퍼지며(MacNaeidhe and Curran, 1982), 수로를 따라 퍼지거나 미숙퇴비에 의해 전파되기도 하는 것으 로 추정한다.
염색체수는 2n=4x=40이고(Chang and Chung, 2011), 유전체크기(genome size)는 약 1.63 pg 1 C-1이며, 약 3.2 Gbp로 알려 져 있다(Garnatje et al., 2011).
지역적 분포
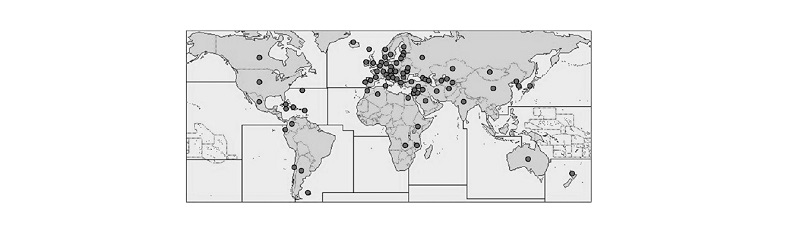
개쑥갓은 유럽이 원산지이며, 현재 전 세계적으로 분포하고 있다. 주로 온대지방에 집중적으로 분포하고 있으며(Fig. 2), 열대 및 아열대 기후의 국가에서는 거의 보고되어 있지 않다(CABI, 2017). 북미지역에서도 외래종으로서 널리 퍼져 있으며, 미국의 거의 전 지역에 분포하고 있다(USDA, 2017). Holm et al. (1979)은 개쑥갓을 자생잡초(native weed)로 기록 하고 있으나, 국내에서는 1921년 이전에 유입된 1기 외래잡초(exotic weed)로 분류하고 있으며(Mori, 1922), 1900년대 초 에 개항과 함께 유입되었을 것으로 추정된다. Yim and Jeon (1980)은 1980년 이전부터 개쑥갓은 이미 제주도 및 울릉도 를 포함한 전국에 분포하고 있었다고 보고했고, 2000년 이후에도 전국의 비농경지에서 개쑥갓의 분포가 보고되었다 (Choi et al., 2009; Choi and You, 2015; Kim and Oh, 2010; Lee, 2015; Lim and Hwang, 2006; Oh et al., 2009; Yang, 2008; You etal., 2008). Kang and Shim (2002)은 전국적 발생분포뿐 아니라 발생빈도 또한 높다고 평가하고, 대표적 외래잡초인 개망 초(Erigeron annuus L.)나 서양민들레(Taraxacum officinale Weber)와 함께 3A그룹으로 분류했으며(Table 1), 특히 밭에서 많이 발생한다고 보고하여 농경지에서 발생을 보고하였다. 그러나 이러한 분포조사 보고는 조사 범위가 제한적이라는 한계가 있어 전체적인 분포는 알 수가 없었다. 또한 조사 방법이 개쑥갓을 대상으로 조사한 것이 아니라, 외래식물 혹은 식물군락을 조사한 결과 중에 개쑥갓을 발췌한 것이기 때문에, 정확한 분포 상황을 알 수가 없었다. 최근 개쑥갓의 농경 지 내 분포조사에 따르면, 개쑥갓은 과수원이나 동계 및 하계작물에 상관없이 전국의 농경지에 고르게 퍼져있었고, 특 히 강원의 고령지 여름배추 재배지와 전남 신안, 무안 및 경남 창녕 등 마늘 및 양파 주요 산지, 그리고 경북 지역의 사과 및 포도 재배지에 에 집중적으로 분포하고 있는 것으로 나타났다(Kim et al., 2018). 이상의 결과를 바탕으로 유추해보면, 1980년대에 길가, 나대지 등지에 분포하고 있던 개쑥갓이 2000년대로 넘어오면서 급격하게 확산되었고, 최근 일부 지 역에서 심각한 문제를 야기하고 있는 것으로 판단된다.
|
Table 1. Classes for grouping the plants naturalized to Republic of Korea based on the abundance and the distribution range (Kang and Shim, 2002). 
|
발아생리
개쑥갓의 발아 최저온도는 2oC 내외이며, 발아 최적온도는 10-25oC로 넓은 온도범위에서 발아할 수 있으나(Guillemin et al., 2013; McGiffen et al., 2008), 30oC를 넘는 고온에서는 발아율이 급격하게 감소하기 때문에 6월에서 9월까지는 거의 발아하지 않는다. 광발아성 종자이나 광요구도 자체는 낮은 편이며, 온도에 따라 광요구도는 달라진다고 알려져 있다 (Hilton, 1983). 토양 내 질소와 칼슘의 함량이 개쑥갓의 발아에 큰 영향을 미치며, 황과 철분의 함량은 상대적으로 영향 이 적은 것으로 알려져 있다(Fenner, 1986).
개쑥갓 종자가 토양 내에 존재할 때, 시간이 지날수록 발아율은 점차적으로 떨어지나, 온도가 낮아짐에 따라 발아율 이 낮아지고 온도가 높아짐에 따라 발아율이 높아지는 순환적 휴면반응을 보인다(Figueroa et al., 2007). 종자의 휴면성은 종자가 생성된 시기(Popay and Roberts, 1970), 종자의 저장조건 혹은 채집지의 기후(Ndihokubwayo et al., 2016)에 따라 다양한 반응을 보인다. 지베렐린(GA3)을 처리하면 종자의 휴면을 타파할 수 있으며 다시 종자추출물(petroleum ether)을 처 리하게 되면 휴면이 유지되기 때문에, 발아를 촉진하는 식물호르몬의 저해요인이 종자 내부에 존재하며 이 물질이 휴면성을 조절하는 것으로 추정하고 있다(Ren and Abbott, 1991).
생식과 유전
엽록소 형광은 Kautsky and Hirsch (1931)의 광합성 과정 중 빛에 의한 CO2 동화작용에 대한 연구에서 시작되었다. 암적응된 식물이 빛에 노출될 경우 형광을 방출하며 시간이 지남에 따라 형광이 감소하는 현상을 발견하였으며, 이러한 형광의 변화 측정을 통해 광반응의 효율인 광합성 양자수율(quantum yield) 등 식물의 광합성관련 생리적 상태 측정에 활용되고 있다. 빠른 주기로 빛의 세기를 조절하여 식물의 형광을 측정하는 pulse amplitude modulation (PAM) 방식은 엽록소 형광 측정에 있어서 큰 변화를 가져왔으며(Schreiber et al., 1986), 특히 주변에 약간의 빛이 존재하는 환경에서도 형광 지표의 측정을 가능하게 하였다. 현재 널리 사용되는 식물 엽록소 형광 관련 지표들은 Fig. 2와 같으며, 이들 가운데 ΦPSII (제2광계의 양자수율), Fv/Fm (제2광계의 최대양자수율), NPQ (non-photochemical quenching)은 식물체의 비생물학적 스트레스에 대한 생리적 반응인 광합성 능력에 대한 간접적인 지표로서 폭넓게 사용되고 있다(van Tol et al., 2017; Zhang et al., 2016; Zhang and Kim, 2018).
Senecio vulgaris subsp. denticulatus (2n=4x=40)는 S. vulgaris subsp. vulgaris (2n=4x=40)와 Senecio squalidus L. (2n=2x=20) 의 종간 교잡으로 인해 분화된 것으로 알려져 있다(Abbott et al., 1992). 설상화 유전자(ray floret gene; Tr)가 발현하는 S.squalidus (TrTr)와 발현하지 않는 S. vulgaris subsp. vulgaris (TnTn)의 인공교배를 통해 F1세대에서 교잡종(TrTn)이 나타난다는 것을 증명하였고(Marshall and Abbott, 1980, 1982), 인공교배를 통해 생식이 가능하고 S. vulgaris subsp. denticulatus와 유사한 교잡종을 만들어내기도 했다(Ingram, 1978; Ingram et al., 1980). 국내에서도 쑥방망이(S. arguensis Trucz.)가 강원 중부 및 경북 북동부 산간지역에 분포하고 있고, 금방망이(S. nemorensis L.)가 경기 중부 서해안에 드물게 분포하고 있기 때문에(Oh et al., 2016), 비록 개쑥갓의 타가수분 비율은 1%미만이지만(Gibbs et al., 1975), 국내 자생 금방망이속 식물들과 개쑥갓의 자연교잡 가능성을 배제할 수는 없다.
화학적 방제
개쑥갓의 방제에 관한 연구는 많은 국가에서 다양한 작물을 대상으로 이루어졌고, 그만큼 화학적 방제법도 매우 다 양하다(CABI, 2017). 주로 Protox 저해제인 oxyfluorfen (Cassidy, 1988)이나 linuron (Wyss and Müller-Schärer, 2001)과 같 은 광합성저해제(Photosystem II inhibitor; PSII)계열의 토양처리 제초제로 방제했을 때 개쑥갓을 효과적으로 방제할 수 있다고 알려져 있다. 특히 영국의 사과 과수원에서는 napropamide와 oxyfluorfen이 효과적이었으며(Delaney and Moon, 1984), 미국의 관상용식물 재배지에서 acifluorfen (1,100 g a.i. ha-1), oxadiazon (4,500 g a.i. ha-1) 및 oxyfluorfen + pendimethalin (2,200+1,100 g a.i. ha-1) 등이 90% 이상의 방제가를 보였다(Gallitano and Skroch, 1993). 비선택성 제초제 또한 효과적으로 개쑥갓을 방제할 수 있었다(Wyss and Müller-Schärer, 2001).
최근 Kim et al. (2018)은 마늘(Allium sativum L.)과 양파(Allium cepa L.) 재배지의 개쑥갓을 방제할 수 있는 제초제 를 선발하였다. Linuron (500 g a.i. ha-1), alachlor (437 g a.i. ha-1), linuron + thiobencarb (100+600 g a.i. ha-1) 및 S-metolachlor + thiobencarb (20+50 g a.i. ha-1)이 개쑥갓 방제에 매우 효과적이었으며, pendimethalin (317 g a.i. ha-1) 및 ethalfluralin (350 g a.i. ha-1) 등 dinitroaniline계열의 제초제는 효과가 미미하였다. 따라서, 양파밭에서는 alachlor와 linuron을, 마늘밭에서는 linuron, linuron + thiobencarb 및 S-metolachlor + thiobencarb를 사용하면 효과적으로 개쑥갓을 방제할 수 있다고 보고했다. 이 연구에서, 비록 단제의 효과를 확인할 수 없었지만, thiobencarb가 개쑥갓 방제에 주요한 역할을 할 수 있을 것이라고 추측했다.
제초제 저항성
개쑥갓은 최초의 제초제 저항성 잡초이며(Ryan, 1970), 특히 북남미 및 유럽의 다양한 지역에서 PSII 저해제 중 triazine 계열의 simazine과 atrazine에 저항성을 보였다(Table 2) (Heap, 2019). 특히, Mallory-Smith (1998)는 Oregon 주에서 같은 PSII 계열 제초제인 bromoxynil 및 terbacil에 대한 교차저항성(cross-resistance)을 보이는 개쑥갓을 보고하였다. Triazine 계열의 제초제에 대한 개쑥갓의 저항성은 psbA 유전자의 변이로 인한 작용점저항성(target-site resistance; TSR)으로 알 려져 있으며, 다양한 방법으로 저항성 기작을 증명하였다. 염기서열 분석이 일반화되지 않았던 1979년에 이미 엽록체 내의 전기전도도 차이를 확인하며, 작용점인 제2광계(PSII) 내에 존재하는 단백질의 미세한 변화가 있음을 추측하였다(Pfister et al., 1979). Havaux (1989)는 저항성 및 감수성 간에 온도에 따른 엽록소형광(chlorophyll fluorescence) 및 광량자속밀도(photon flux density)의 차이를 보여주었다. Frey et al. (1999)는 엽록체 DNA (chloroplast DNA; cpDNA)의 다형성 (polymorphism)과 모계유전 교배결과를 통해 저항성과 관련된 유전자는 cpDNA에 존재한다는 사실을 밝혔다. Park andMallory-Smith (2006)는 psbA 유전자 염기서열을 분석한 결과, PSII 저해 제초제 저항성 개쑥갓에서 266번째 아미노산인 아스파라긴이 트레오닌으로의 변이를 확인하여 저항성의 기작이 작용점변이임을 증명한 바 있다. 최근에는 acetolactate synthase (ALS) 저해제에도 저항성이 있다는 보고가 있었으며, ALS gene의 변이에 의한 작용점변이로 인한 저항성임이 밝혀졌다(Délye et al., 2016). D1 protein의 변이에 의한 저항성 개쑥갓의 경우, 광합성 저하, 생장량 및 속도 저하 및 종자 생산량 저하와 같은 fitness cost를 보이기도 했다(Holt, 1988).
국내에서는 아직까지 제초제 저항성 개쑥갓에 대해 보고된 바가 없다. 그러나 개쑥갓과 같은 외래잡초가 증가하고 있고, 밭에서 발생하는 다양한 잡초를 방제하기 위해 밭제초제의 사용 증가와 연용이 예상된다. 개쑥갓이 다양한 작용 기작에서 저항성이 발견되었기에, 다른 잡초보다 빠르게 저항성이 출현할 수 있을 것으로 판단되며, 제초제 저항성 개쑥갓 발생에 대한 주의를 기해야 할 것이다.
|
Table 2. Summary of herbicide resistant Senecio vulgaris in the world. 
|
|
Data was obtained from www.weedscience.org (Accessed, Mar. 4, 2019) and re-arranged. |
생물학적 방제
개쑥갓을 기주로 하는 병원균은 유럽 및 북아메리카를 중심으로 다양한 종이 확인되었다(Supplementary Table 1). 이 중, 종 혹은 속 특이성을 보이는 두 종(Erysiphe fischeri 및 Puccinia lagenophorae) 은 개쑥갓의 생물학적 방제법으로 연구된 바가 있다.
흰가루병의 병원균인 Erysiphe fischeri는 금방망이속 식물에 속 특이적 반응을 보이는 병원균으로, 그 외의 작물에는 병원성이 알려진 바 없다(Farr and Rossman, 2017). 개쑥갓에서도 병원성이 확인되어 생물학적 방제법으로 활용을 제안 했으나(Harry and Clarke, 1992), 개쑥갓 집단간에 이병성의 편차가 심하여(Bevan et al., 1993) 구체적인 연구로는 이어지 지 않았다.
Puccinia lagenophorae는 일부 금방망이속에서 녹병(groundsel rust)을 일으키는 병원균으로(Wilson et al., 1965), 전 생육 시기에 걸쳐 병해가 나타난다(Paul and Ayres, 1986a, b). 이로 인해 개쑥갓의 생물학적 방제법으로 다양한 시도가 있었다. 실제 당근밭에서 Puccinia lagenophorae를 이용한 방제실험을 한 결과, 개쑥갓에 대한 유의적인 방제효과가 있었으나 무 처리구에 비해 상품성이 있는 당근의 수량 또한 유의적으로 감소하여 그 한계를 보였다(Grace and Müller-Schärer, 2003).
개쑥갓을 기주로 하는 병원균 중 국내에서 확인된 병원균으로는 점무늬병의 Alternaria cinerarie (Cho et al., 2001)와 흰가루병의 Sphaerotheca fusca (syn. Podosphaera fusca) (Shin, 1988) 2종이 알려져 있다. Alternaria cinerarie는 같은 금방망 이속인 산솜방망이(Senecio flammeus Turcz. ex DC.)에서만 병원성이 알려져 있으나, Sphaerotheca fusca는 망초(Conyza canadensis L.) 등 국화과 잡초뿐 아니라, 수박(Citrullus vulgaris Schrad), 참외(Cucumis mello L. var. makuwa) 및 오이(Cucumis sativus L.) 등 주요 박과 작물에도 점무늬병을 일으킬 수 있다는 보고가 있다 (Shin, 2000). 생물학적 방제는 기주 특이성(host specificity)이 전제조건이므로 개쑥갓의 방제를 위한 병원성 진균으로는 Sphaerotheca fusca보다 Alternaria cinerarie가 적합하다고 할 수 있으나, 병해 및 감염 정도에 대해서는 알려진 바가 없다.
결론
개쑥갓은 1기 외래식물로 국내에 유입된 지 100여년이 지나 국가에서는 이미 귀화식물로 분류하고 있다(Kang and Shim, 2002). 그러나 최근 농경지에서, 특히 사과, 포도 과수원이나 마늘, 양파 등 동계작물 주요산지 및 강원 산간의 배 추 재배지에서 문제가 되고 있으며, 이러한 문제는 점차 확산하고 있는 추세이다. 기초적인 방제법이 개발되었으나 (Kim et al., 2018), 지역 특이성, 작물다양성 및 약해 등을 고려한 구체적인 방제법이 추가적으로 마련되어야 할 것이다. 개쑥갓에 대한 제초제 저항성이 보고되어있기 때문에 저항성 발생문제에 대한 주의와 관심이 필요하다 할 것이다