서 언
최근 국민의 소득 증대와 주 5일 근무제의 시행과 같은 사회의 변화는 보다 나은 인간다운 삶에 대한 개인의 가치를 중요시하게 되었으며, 삶의 질에 대한 개인의 행복 기준선을 상승시키고 있다(Park and Hwang, 2011). 이러한 도시민의 삶의 질에 대한 관심은 여가에 대한 인식과 기대를 더욱 높이고 있어 공원, 골프장, 정원 및 운동장 등과 같은 시설을 이용한 레져 활동의 증가와 더불어 점점 잔디수요가 증가될 것으로 전망된다.
국내에 있어서 잔디시장의 환경과 잔디 수요자 및 생산자 요구를 충족시키기 위해서는 국내의 잔디 재배환경, 현장수요에 적합한 새로운 품종의 개발이 절실히 필요한 실정이다. 또한 기후변화의 영향으로 인해 한반도 기후 또한 점점 아열대화 되어가고 되어가고 있는 중에 있어서 이러한 기후변화 적응성이 높은 난지형 잔디인 한국잔디의 신품종 개발이 요구되고 있다.
최근 한국잔디의 자생지 현황 조사, 인공교배, 돌연변이 육종 등을 통해 신품종 개발에 대한 연구들이 활발히 진행되고 있다(Bae et al., 2010; Bae et al., 2013; Choi and Yang, 2006; Choi et al., 2017; Tae et al., 2014). 그러나 국내 환경에 적응성이 높은 한국잔디 육종소재의 한계성으로 인해 품종성능 개선하는데 어려움이 있으며, 이를 극복하기 위한 1대 잡종의 개발, 유용인자를 도입하는 생명공학기법 뿐만 아니라 식물체의 거대화를 꾀하기 위한 배수성 육종 등 여러 가지 방법을 채택할 필요가 있다.
한국잔디는 내환경성이 우수하며, 환경보호적 기능성이 우수한 잔디이다(Emmons, 1995). 한국잔디류의 육종현황에서 한국잔디류의 주된 육종목표는 녹색기간이 연장되는 품종, 내답압성이 우수하여 스포츠용으로 활용 가능한 품종, 내염성 및 내건성 품종, 관리요구도가 낮은 내척박성 품종 등이다(Joo et al., 1997).
한국잔디 대표종인 들잔디 (Zoysia japonica Steud.)는 자연환경에 대한 적응력이 뛰어나 거의 모든 기후와 토양에서 생장할 수 있기에 공원, 골프장, 제방, 운동 경기장에서 넓게 사용되는 품종이며(Al-Khayri et al., 1989; Toyama et al., 2003), 상업적인 측면으로 많이 이용되고 있다. 엽폭이 5 mm 이상으로 넓은 특성을 가지고(Choi et al., 1997; Hong and Yeam, 1985), 줄기가 드러누워 옆으로 펴지며, 토양적응성 및 내한성이 매우 강하고 관리가 필요 없어 묘지, 사면녹화 등에 적합한 잔디이다.
한국잔디류의 염색체 수는 스리랑카에서 수집된 금잔디(Z. matrella (L.) Merr.)가 2n=2x=20으로 2배체라고 보고되었지만(Gould and Soderstrom, 1974), 대부분의 한국잔디류에 대한 배수성 연구에서 2n=4x=40으로 4배체로 보고되고 있다(Arumuganathan et al., 1999; Chen and Hsu, 1962; Christopher and Abraham, 1974; Forbes, 1952; Murray et al., 2005; Schwartz et al., 2010; Tateoka, 1955). Restriction fragment length polymorphism (RFLP)를 이용한 유전자 지도를 작성
한 결과에서도 4배체 (4n=40)일 가능성이 높다고 보고하였다(Yaneshita et al., 1999).
최근 한국잔디의 이용범위가 더욱 다양해지고 사용면적도 확대되고 있기 때문에 새로운 한국잔디의 품종개발이 필요하지만 현재 이용 가능한 한국잔디의 유전적 다양성에 있어 제한적이다. 버뮤다그래스(Cynodon dactylon)의 경우 국내에 형태 및 생리생육 면에서 매우 다양한 생태형이 존재한다는 것이 밝혀졌다(Kang et al., 2008). 일반적으로 버뮤다그래스 중 빠르게 번식하면서 세엽형태의 생태형은 배수성이 낮은 반면 5배체와 6배체의 경우 광엽형태를 나타낸다고 하였으며, 핵 2C DNA 함량은 포복경 길이와 포복경 마디 수와 음의 상관 관계(r=-0.43과 -0.50)가 있다고 보고하였다(Hanna et al., 1990). 미국에서 개발된 6배체 버뮤다그래스 (cv. Tifton 10)는 진한 녹색의 광엽형태로 빠른 생장 특성을 가졌는데 이는 6배체의 생태형과 유사한 특성을 보인다고 하였다(Hanna et al., 1990). 따라서 이러한 보고를 통해 배수성에 따른 잔디의 다양한 형태, 생육특성을 확인할 수가 있었으며, 한국잔디에서도 배수성에 의한 다양한 특성의 한국잔디 개발이 필요하다.식물의 배수성 육종에서 가장 중요한 것은 염색체가 배가 된 배수체를 만드는 것이다. 배수체의 작성은 대부분 콜히친 처리로 이루어지며, 감수분열 시 방추사 기능을 무력화하여 염색체가 극으로 이동하는 것을 막음으로써 이루어진다(Scoles et al., 2001).
식물체에서 콜히친 처리에 의한 염색체의 배가 여부를 확인하는 방법은 처리 후 염색체 수를 직접 검경하는 방법이 흔히 사용되고 있다. 그러나 이 방법은 정확하다는 장점이 있으나 시간, 기술 및 노력이 많이 드는 단점이 있어 최근에는 유세포분석기 (flow cytometry)를 이용하여 DNA의 양의 변화를 추정하는 방법이 많이 이용되고 있다(Ochatt, 2008; Ono and Hosaka, 2010).
본 연구는 한국잔디 중 들잔디에 콜히친을 처리하여 배수체 잔디를 생성하고, 이 잔디의 모체와 형태학적 특성을 비교하고자 수행하였다. 본 연구를 통해 잔디의 배수체를 통한 품종개량 및 연구에 이용할 수 있을 것으로 기대된다.
재료 및 방법
콜히친 처리에 의한 배수체 개발
2010년 3월 들잔디(Zoysia japonica STEUD) ‘제니스’ 종자를 50% NaOCl에 10분간 침지하여 수세 후 4℃에서 증류수에 2일간 침지하였다. 발아를 위해 90×15 mm petri-dish에 필터페이퍼(Whatman No.2, WhatmanTM, UK) 2장을 깐 후 침지한 잔디 종자를 50립을 파종하였다. 관수는 매일 2 mL의 증류수로 오전과 오후 2회에 걸쳐 총 4 mL의 수분을 보충하였고, 온도 및 광처리는 식물생장상(Dasol Scientific Co., LTD., Hwaseong, Korea)에서 35℃, 8시간 광조건, 20℃, 16시간 암조건에서 24일간 배양하였다. Lim et al. (1990)은 콜히친(colchicine) 처리농도와 시간이 들잔디 (Zoysia japonica STEUD) 배가율에 미치는 영향을 조사한 결과 높을수록 종자발아가 감소하였으며, 콜히친 농도 0.1-0.4%, 12-48시간 범위 내에서는 발아에 영향을 받지 않은 것으로 보고하였다. 이에 준하여 발아 4일 후 0.2% 콜히친을 24시간을 처리하였고, 콜히친 처리한 종자는 지름 10.5 cm, 높이 9 cm pot에 원예용상토(SEOUL BIO, Eumseong, Korea)를 채워 이식하였다. 광 및 온도처리는 식물생장상(Dasol Scientific Co., LTD., Hwaseong, Korea)에서 20℃ 16시간 암조건, 30℃ 8시간 광조건을 처리하였다. 2011년 5월 식물체가 출현한 개체에 대해 배수체를 확인하였고, ‘제니스’에 비해 DNA의 양이 2배 지점에 피크를 보이는 배수체 잔디를 선발하였다.
선발한 배수체는 2011년 6월 충남 천안시에 소재한 단국대학교 시험포장에 식재 후 유지관리 하였다. 그 후 2012년 6월 단국대학교 시험포장에서 홀커트(hole cutter)를 이용해 배수체를 직경 10.5 cm의 플러그를 채취하여 경남 진주시 진주대로에 소재한 국립산림과학원 산림바이오소재연구소 유리온실에 상토와 마사토(3:7)를 섞은 토양을 채운 삽목상자에 이식하였다. 온도 최저 10℃, 최고 35℃, 습도 최저 40%, 최고 70% 온실조건에서 생육을 시킨 후 2013년 6월 경남 진주시 진주대로에 소재한 국립산림과학원 산림바이오소재연구소 잔디유전자원 보존원에 증식을 하였고, 이 잔디를 ‘태지’라고 명명하였다.
염색체 배가 확인
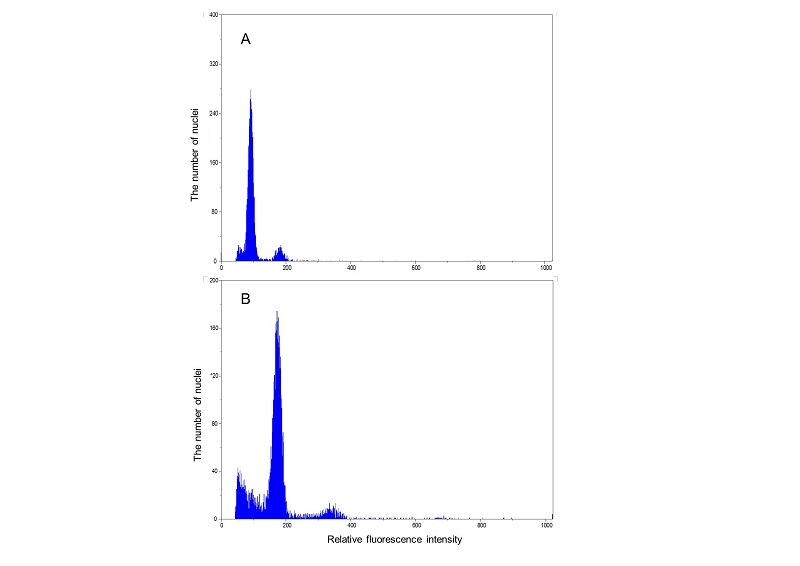
한국잔디 들잔디 ‘제니스’와 ‘태지’의 배수체 확인을 위해 유세포분석을 통한 DNA 함량을 분석하였다. 유세포분석에는 유세포분석기(PAS flow cytometry, Partec, Germany)를 사용하였고, 핵의 나출과 염색은 매뉴얼에 따라 실시하였다. 2-3매의 잎이 발생된 잔디 유묘에서 잎 약 0.5 cm2를 잘라 petri-dish에 넣고 400 μL의 nuclei extraction buffer를 첨가한 다음 칼날을 이용하여 1분간 세절하였다. 나출된 핵이 포함된 extraction buffer를 30 μm nylon sieve에 여과시킨 다음 4 volume의 DAPI (4,6-diamido-2-phenylindole-2HCl) staining solution을 첨가하여 형광염색 하였다. 염색된 핵은 유세포분석기를 이용하여 3000 nuclei 이상을 측정하였고, DAPC software (Flomax, Partec, Germany)를 이용하여 G0/G1 (nuclei) 피크의 평균 위치를 결정하고 세포당 DNA 함량을 분석하였다. 이때 각 샘플을 3반복으로 측정하였다(Johnston et al., 1999).
형태적 특성 조사
2015년 7월 경남 진주시에 소재한 국립산림과학원 산림바이오소재연구소 잔디유전자원 보존원에서 배수체의 형태조사를 수행하였다. 형태적 특성은 초장, 엽장, 엽폭, 엽각도, 최하위 엽 높이, 포복경 마디간격 길이 및 굵기, 종자길이와 폭을 조사하였다. 생육진전속도가 비슷한 줄기 10개를 무작위로 선택하여 측정한 후 평균 및 표준오차를 계산하였다. 초장은 지면으로부터 가장 높게 자란 잎까지의 높이를 측정하였고, 엽장은 기엽(1번째)을 기준으로 3번째 잎몸의 길이를 조사한 값이며, 엽폭은 3번째 잎몸의 최대 엽폭으로 자를 이용하여 mm이하 한자리까지 측정하였다. 엽각도는 수직분얼경의 중심축으로부터 3번째 잎몸이 벌어진 정도를 각도기를 이용하여 측정하였으며, 최하위 엽 높이는 지면으로부터 줄기 최하위에 붙은 잎의 기부까지의 높이를 측정하였다(Choi and Yang, 2006). 포복경 마디간격 길이는 지상 포복경 끝에서 3번째 마디 사이의 길이를 눈금자를 이용해서 실측하였고, 포복경 굵기는 지상 포복경 끝에서 3번째와 4번째 마디 사이의 굵기를 버니어 켈리퍼스(CD-15CPX, Mititoyo Crop, Japan)를 이용하여 실측하였다(Choi and Yang, 2013). 종자의 형태 및 크기를 종사하기 위하여 광학현미경(Leica MZ95, Leica Microsystems Gmbh Wetzlar, Germany)을 이용해 종자의 길이와 폭을 측정하였다.
통계분석은 SAS 프로그램(v. 9.1, Cary, NC, USA)을 사용하여 t-test 분석을 실시하였고, 품종간 평균간 유의성 검정은 5% 수준에서 유의성을 실시하였다.
품종보호권 등록
선발된 잔디 ‘태지’는 2015년 산림청 국립산림품종관리센터에 품종보호 출원(품종명: 태지, 출원번호: 2015-21)을 진행하였으며, 구별성, 균일성 및 안정성이 확인되어 2019년 4월에 식물신품종보호법에 따라 품종보호권이 등록되었다(품종보호 제187호).
결과 및 고찰
한국잔디 배수체의 염색체 배가 확인
한국잔디 들잔디의 염색체 배가 여부는 대상재료에 콜히친 처리를 한 후 생존한 개체에 대해서 유세포분석기 방법으로 확인하였다. 이 방법은 세포의 DNA 양을 측정함으로써 염색체 배가체를 확인하는 방법이다(Hwang et al., 2012; Ochatt, 2008). 본 연구에서는 들잔디 ‘제니스’와 ‘태지’의 세포당 DNA 함량(DAPI)을 분석하였다. 이를 위해 두 품종의 핵 DNA를 DAPI (4,6-diamido-2-phenylindole-2HCl)로 염색한 다음 유세포분석기를 이용하여 평균 G0/G1 (nuclei) 피크를 측정하였다. 그 결과 ‘태지’의 핵 DNA의 평균 G0/G1피크가 ‘제니스’보다 뒤쪽에 위치하는 것으로 나타났다(Fig. 1). ‘제니스’의 세포당 DNA 함량(DAPI) 73.7이었고, ‘태지’는 145.6로 나타났다. ‘제니스’ 종자에 콜히친을 처리하여 선발된 ‘태지’의 DNA 함량은 ‘제니스’보다 약 1.98배로 증가하여 염색체의 배가가 이루어졌음을 확인 할 수 있었다. 이는 배수성이 전혀 다른 호밀(Secale cereal L.) 품종간의 DAPI을 비교한 바 2배체인 곡우호밀이 세포당 DNA 함량이 48.3을 보였고, 4배체인 두루호밀은 96.5를 보여 배가된 배수체가 DNA함량이 높게 나타난 결과와 유사하였다(Hwang et al., 2012). 식물의 배수화를 위한 antimitotic agents로 콜히친(C22H25NO6)이 가장 보편적으로 사용되고 있다(Anderson et al., 1991; Chen and Goeden-Kallemeyn, 1979; Grisebach, 1981; Wan et al., 1989). 콜히친은 식물의 체세포 분열 과정에서 tubulin과 결합하여 방추사의 형성을 억제 시키고, 세포 분열 중기 단계에서 염색체의 양극 이동과 microtubules의 형성을 방해함으로써 염색체 배수화를 유도하는 것으로 알려져 있다(Hadlaczky et al., 1983). Hwang et al. (2012)가 호밀에 콜히친을 처리하여 호밀 배수체를 생성했던 것과 같이 본 연구에서도 콜히친을 처리하여 들잔디의 염색체를 배가시켜 배수체를 얻을 수 있었다. Arumuganathan et al. (1999)에 의해 ‘제니스’가 4배체(2n=4x)로 밝혀져 있는데 ‘제니스’에 비해 염색체가 배가된 배수체가 확인된 신규잔디를 ‘태지’라고 명명하였다.
형태적 특성
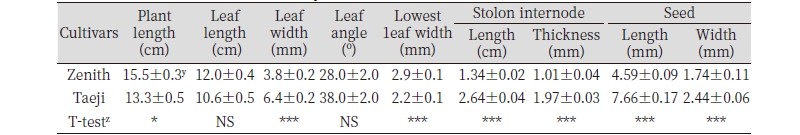
2015년 7월 경남 진주시에 소재한 국립산림과학원 산림바이오소재연구소 잔디유전자원 보존원에서 들잔디 ‘제니스’와 ‘태지’의 형태적 특성을 조사하였다(Table 1; Fig. 2.). 형태 형질의 평균 특성을 살펴보면 초장은 ‘제니스’가 15.5 cm로 ‘태지’ 13.3 cm보다 긴 특성을 나타내었으며, 엽장에서는 유의한 차이가 없었다. 엽폭은 ‘태지’와 ‘제니스’가 각각 6.4 mm와 3.8 mm를 나타내어 배수체인 ‘태지’에서 약 68% 증가하였고(Fig. 3A), 엽각도는 유의한 차이를 보이지 않았다. 포복경 마디간격 길이는 ‘태지’와 ‘제니스’가 2.64 cm와 1.34 cm를 나타내어 ‘태지’에서 97% 증가하였고, 포복경 마디간격 굵기는 각각 1.97 mm와 1.01 mm를 나타내어 95% 증가하였다(Fig. 3B).
본 연구결과를 통해 ‘제니스’ 종자에 콜히친을 처리하여 선발된 ‘태지’가 ‘제니스’와 형태적으로 유의한 차이를 확인할 수 있었고, ‘태지’가 ‘제니스’에 비해 엽과 종자의 폭이 넓고, 포복경이 길고 굵은 특성을 나타내어 잔디와 종자의 크기가 커지는 것을 확인하였다. 이러한 배수체는 대체로 생육이 왕성해 줄기가 굵어지고, 잎이 두꺼워지거나 꽃이 커지는 결과를 나타낸다고 하였다(Chen and Goeden-Kallemeyn, 1979; Lee and Koh, 2003). Knight et al. (2005)은 조사된 잔디 종류에 따라 잎 길이 및 면적 등 해부학적특성과 핵 DNA 함량과의 상관 관계가 있다고 하였다. 엽폭의 경우 buffalograss (Johnson et al., 1998)와 bentgrass (Bonos et al., 2002)에서는 핵 DNA 함량과 관계가 없다고 하였지만 본 연구에서는 ‘제니스’ 종자에 콜히친을 처리하여 선발된 ‘태지’의 경우에는 핵 DNA 함량 증가와 함께 엽폭이 증가하였다. 국내에서는 Zoysiagrass에 콜히친을 처리하여 배수성은 유도되었으나 추가의 연구를 통한 육종에의 적용은 보고되지 않았다(Lim et al., 1990).
‘제니스’에 비해 염색체가 배가된 배수체 ‘태지’는 향후 포복경 생장에 의한 그린업과 피복속도, 내건성 등 척박한 환경에 대한 저항성이 검증된다면 저관리가 가능한 잔디 녹화 공간에 활용이 될 수 있을 것으로 기대된다.
Authors Information
Eunji Bae, https://orcid.org/0000-0003-4597-8873
Chungyeol Kim, Forest Biomaterials Research Center, National Institute of Forest Science, Postmaster Researcher
Changhyun Sung, Forest Biomaterials Research Center, National Institute of Forest Science, Postmaster Researcher
Junhyuck Yoon, Forest Biomaterials Research Center, National Institute of Forest Science, Researcher
Eonju Jin, Forest Biomaterials Research Center, National Institute of Forest Science, Postdoctoral researcher