서 언
우리나라는 세계 13위의 OECD 국가로 수출주도형 경제사회화와 국민들의 국제화 활동으로 외국과의 교역과 교류가 증가하고 있다. 2018년 기준으로 수출액은 6,048억 달러, 수입액은 5,353억 달러이었으며(Trade Korea, 2018), 내국인 중 외국으로 출국한 사람이 2,869만 명이다(Korea Tourism Organization, 2018). 이에 따라 외국으로부터 의도하였던 의도하지 않았던 외래식물의 유입이 지속적으로 이루어지고 있는 실정이다. 이렇게 침입한 외래식물을 유엔환경계획(UNEP)에서는 ‘의도적 또는 비의도적으로 외부로부터 도입되어 새로운 서식지의 생물다양성, 생태계, 서식처와 인간의 복지를 위협하는 식물’로 정의하고 있으며, 캐나다 식품검역청에서는 ‘인간의 건강을 포함하여 환경, 경제 및 사회에 위협이 되는 유해한 비자생종’으로 정의하고 있다(Jung et al., 2016). 즉, 침입외래식물은 생태계뿐만 아니라 인간의 안전까지도 위협한다고 할 수 있다. 우리나라에는 가시박, 돼지풀, 서양등골나물, 도깨비가지, 애기수영 등 279종의 침입외래식물이 다발생하여 자연생태계를 교란하는 등의 부정적인 영향을 미치고 있고(Kim et al., 2010, Park, 2009), 또 농경지에는 166종이 발생하여 경제적인 손실을 입히고 있는 것으로 보고된 바 있다(Kim et al., 2018). 대한민국 환경부에서는 생물종의 특성, 분포 및 확산양상 및 생태계에 미치는 영향을 평가하여 생태계의 균형을 교란하거나 교란할 우려가 있는 식물을 생태계교란식물로 관리하고 있는데 총 15종이 지정되어 있다: 환삼덩굴, 가시박, 가시상추, 갯줄풀, 단풍잎돼지풀, 도깨비가지, 돼지풀, 물참새피, 미국쑥부쟁이, 서양금혼초, 서양등골나물, 애기수영, 양미역취, 영국갯끈풀, 털물참새피. 또한 생태계교란식물의 범주에는 비록 외래식물은 아니지만 특정지역에서 생태계의 균형을 교란하거나 교란할 우려가 있는 식물과 유전자의 변형을 통해 생산된 유전자변형식물도 포함되어 있다.
침입외래식물 중 현재까지 생태계교란식물로 지정되지는 않았지만 우리나라의 농경지에서 도태되지 않고 오랜 기간동안 생육, 번식, 확산을 거듭하고 있으며, 일부 지역적으로 심각한 경제적 또는 농업생물다양성 감소 등의 피해를 야기하는 것 중 하나로 들개미자리(Spergula arvensis)를 들 수 있다. 들개미자리와 같은 오래전 도입된 침입외래식물의 경우 체계적인 위해성평가가 거의 이뤄지지 않고 있으며, 특히 대상종이 들개미자리를 포함한 긴털비름, 개비름, 어저귀 등 농업잡초인 경우 더욱 소홀한 실정이다. 들개미자리는 유럽이 원산지인 석죽과(Caryophyllaceae)의 1년 내지 2년생식물로 우리나라에서는 중남부 지방과 제주도에서 서식하고 있으며(Lee et al., 2018) 특히 제주도의 밭에서 급속도로 확산되고 있어 사회적인 문제가 되고 있다. 들개미자리는 대부분의 토성에서 생육 가능하나, 양호한 광조건 및 배수가 좋은 사토에서 가장 왕성한 생육을 보인다(Mann, 1939). 들개미자리는 개체당 2,000-7,000개의 종자를 생산하며, 이들 종자는 12.7-21℃에서 연중 발아하는 특성을 보이며 호광성 종자는 아닌 것으로 평가된다(New, 1961). 종자의 확산은 사슴종류의 섭식과 관련 있으며(New, 1961), 주로 농기구, 작물종자와 혼입 등의 인간활동이 종자확산에 영향을 미친다고 알려져 있다(Broad, 1952; Volkart, 1924). 들개미자리가 다발생하는 이유는 농업생태계에서의 쉬운 적응가능성, 다 종자생산력, 종자형성을 위한 짧은 생육기간, 월동 능력, 장거리 전파 가능성과 같은 생태적 특성뿐만 아니라 체계적인 연구가 이루어지지 않아 확실하지는 않지만, 지금까지 고려되지 않았던 환경 독성(environmental toxicity)을 들 수 있을 것이다.
제주도의 농경지에서 들개미자리가 빠르게 확산되어 우점되고 있는 반면 들개비자리가 왜 농경지에서 우점되고 있는지, 환경에 미치는 영향을 무엇인지에 대해서는 거의 알려진 바가 없다. 본 연구에서는 들개미자리 추출물의 식물, 토양미생물과 포유류에 대한 독성을 평가하여 들개미자리가 환경에 미치는 영향을 평가하는데 있다.
재료 및 방법
시료 채취 및 조제
실험에 사용된 재료인 들개미자리(Spergulas arvensis)는 2019년 05월 제주특별자치도 서귀포시 안덕면 상천리(33°19'28.9"N 126°22'38.4"E)에서 채집되었고(Fig. 1), 7일간 음건된 후 분쇄기(HANIL HMF-3260S, Hanil Electric Co., Seoul, Korea)를 이용하여 0.6 mm 이하의 크기로 마쇄하였다.
메탄올 추출물
메탄올 추출물은 Choi et al. (2003)의 실험 방법에 따라 생산되었다. 삼각 플라스크(5 L)에 들개미자리 건조시료 1 kg을 넣고 메탄올 2 L를 첨가한 다음, 플라스크를 100 rpm의 속도로 24시간 2회 반복·추출하였다. 메탄올 추출물을 둥근 바닥 플라스크(4 L)에 넣고 감압농축기(EYELA NE-1101, Tokyo Rikakikai Co., Ltd., Tokyo, Japan)로 농축시킨 다음, d-H2O를 이용하여 잘 용해시키고 동결건조기(FD5505, ILSHINBIOBASE, Dongduchon, Korea)에서 건조시켰다. 동결건조된 시료는 4℃의 냉장고에 보관하면서 메탄올 추출물의 독성검정에 사용되었다.
식물 독성 검정
실내 테스트 (in vitrotest)
들개미자리의 식물독성은in vitro와 in vivo 검정을 수행하였으며in vitro 검정은 seed bioassay를 수행하였다(Choi et al., 2003). 메탄올 추출물을 d-H2O를 사용하여 10,000 mg L-1이 되도록 stock solution을 제조하였고, 이를 이용하여 처리액을 제조하였다. 처리액을 각 well 당 1 g의 sea sand (10-20 mesh; DAEJUNG, Siheung, Korea) 위에 3립의 나팔꽃 (Morning glory, Ipomoea nil (L.) Roth) 종자가 치상되어 있는 24-well tissue culture testplate에 처리하였고, testplate를 온도 25oC, 습도 70%, 광도 250 μmol m-2 s-1 조건의 실험실에 놓고 7일간 생장시켰다. 처리 7일 후 나팔꽃 유식물의 생체중을 측정하여 각 시료에 대한 GR50값(식물의 생장을 50% 저해할 수 있는 약량)을 구하였다.
온실 테스트 (in vivo test)
들개미자리 메탄올 추출물의 경엽 및 토양처리 식물독성을 검정하기 위하여 온실조건에서 실험을 수행하였다. 원예용 상토(HORTICULTURAL NURSERY MEDIA, BUNONG Co., Kyungju, Korea)가 충진되어 있는 사각 플라스틱 포트(350 cm2)에 5종의 작물(옥수수[Zea mays], 콩[Glycine max], 목화[Gossypium hirsutum], 밀[Triticum aestivum], 벼[Oryza sativa])와 8종의 잡초(물피[Echinochloa curs-galli], 바랭이[Digitaria sanguinalis], 쥐꼬리뚝새풀[Alopecurus myrosuroides], 호밀풀[Lolium perenne], 유홍초[Ipomoea hederifolia], 어저귀[Abutilon theophrasti], 자귀풀[Aeschynomene inidca], 도꼬마리[Xanthium strumarium])를 파종한 후 온실조건에서 화본과 식물은 3-3.5엽기, 광엽 식물은 2-3엽기까지 생육시켰다. 들개미자리 추출물 조제액(acetone 50%, Tween 20 0.1%)으로 0. 0.5, 1, 2, 4, 10 kg ha-1이 되도록 조제한 후 flat fan nozzle (Teejet 8002E, Spraying Systems Co., Roswell, USA)이 장착된 CO2 sprayer (KOREA PLANTS ENVIRONMENTAL RESEARCH, Suwon, Korea)를 이용하여 경엽처리 하였으며, 처리 10일 후 약해정도를 달관조사(0: 효과없음, 10: 완전방제)하고 사진을 확보하였다.
미생물 독성 검정
황산화미생물을 이용한 독성평가
토양 내 미생물 독성을 검정하는데 있어서 황산화 미생물(sulfur oxidizing bacteria, SOB)을 사용하였다. 들개미자리 독성 평가를 위하여 25 mL Vial을 이용하여 실시하였다(Fig. 2A). 본 테스트를 위하여 활성이 일정한 황산화 미생물의 원활한 공급을 위하여 3개월 이상 반연속식으로 황산화 미생물 모반응조(MCR; 반응조 부피 1.2 L; 황크기 0.05-1 mm)를 운전하였다. 이 모반응조의 황 입자 5 g이 본 Vial 독성 평가의 미생물 접종원으로 사용되었다. 기존 우리 연구에 따르면 이 황 입자의 표면에는 Acidithiobacillus가 약 99 %의 비율로 우점종을 이루고 배양되고 있다(Hassan et al., 2010). 황산화 미생물 Vial 테스트에 사용된 미생물 배양액은 5 mL의 100배 희석된 nutrient mineral butter (NMB)이다. NMB의 제조 방법은 Oh et al. (2011)을 따랐다. 독성 평가를 위해 각기 다른 농도의 들개미자리 추출물을(수용액 기준으로 0, 10, 50, 100, 200, 500, 1,000, 2,000 mg L-1) 이 Vial 테스트에 주입한 후 밀봉하여 섭씨 38도의 항온 교반 배양조에서 100 rpm의 교반 강도로 배양하였다. 밀봉 직전 Vial의 Head-space에 산소를 약 10초간 불어넣어 산소 부족으로 인한 미생물 활성 저하를 방지하였다 (황산화 미생물은 산소를 전자 수용체로 사용하는 호기성 미생물이다). 5시간 배양 후 미생물 배양액의 전기전도도(electrical conductivity) 변화를 측정하여 황산화 미생물의 활성도를 평가하였다. 모든 황산화 미생물 Vial 테스트는 2반복으로 진행되었고 그 평균 값들이 결과 및 토의에 제시되어 있다.
미세조류를 이용한 독성평가
미세조류를 이용한 들개미자리 추출물 독성 평가에도 25 mL Vial 테스트를 활용하였다(Fig. 2B). 기존의 Chlorella vulgaris를 배양해오던 조류 배양조에서 1 mL를 추출해 조류 Vial 테스트의 접종원으로 사용하였다. 이 1 mL의 조류는 Dry biomass 기준으로 약 500 mg L-1의 미세조류 농도를 가지고 있었다. 조류 Vial 테스트에는 탈염소 처리된 수돗물 14 mL에 중탄산염(500 mg L-1), 질산 나트륨(750 mg L-1), 질산염 완충액(1염기 500 mg L-1 + 2염기 100 mg L-1)이 포함된 미세조류 배양액이 사용되었다. 독성 평가에 사용된 들개미자리 추출물의 농도는 황산화 미생물 테스트와 동일하게 0, 10, 50, 100, 200, 500, 1,000, 2,000 mg L-1 (수용액 기준)였다. 들개미자리 추출물을 조류 Vial 테스트에 주입, 밀봉한 후 섭씨 25도의 항온 교반 배양조에서 75 rpm의 강도로 12시간 동안 배양하였다. 밀봉 직전 Head-space에 존재하는 산소를 제거하기 위해 질소 가스를 1분가량 불어넣어 줬다. 배양이 진행되는 동안 일정한 강도의 (10,000 lux) 빛을 조류 테스트 Vial에 균등하게 비쳐줬다. 배양 시작 직후 그리고 12 시간 후 Head-space의 산소 농도를 측정하여 조류의 활성도를 평가하였다. 모든 조류 Vial 테스트는 2반복으로 진행되었고 그 평균 값들이 결과 및 토의에 제시되어 있다.
황산화 미생물 및 미세조류 저해도 분석
황산화 미생물 Vial 테스트의 전기전도도는 휴대용 전기전도도 측정 장치 (InLab 737, Mettler Toledo, Columbus, OH, USA)를 이용하여 수동으로 측정하였다. 조류 Vial 테스트의 산소 농도 측정은 휴대용 Needle type 산소 측정 센서 (OXF500PT, Pyro-science sensor technology, Germany)를 사용하여 수동으로 측정하였다.
황산화 미생물과 미세조류의 들개미자리 추출물에 의한 저해도(%)는 다음 Eq. 1을 이용하여 분석하였다.
저해도 (%) = (1)
(1)
50 %의 저해도를 나타내는 Effective concentration (EC50) 값은 Sigma Plot 10 (SYSTAT SOFTWARE, INC., San Jose, USA)의 Hillslope EC50 분석법을 활용해 계산하였다.
포유류 독성 검정
세포 독성 평가
마우스의 대식세포인 RAW 264.7 세포와 인간의 각질형성세포인 HaCaT 세포 (2×105 cells/well)를 96 well cell culture plate에 분주하여 37℃, 5% CO2 incubator에서 24시간 배양하였다. 배양액을 serum free medium으로 갈아주고 24시간 배양시킨 후 medium을 제거하고 농도별 추출물을 첨가한 medium 100μL에서 배양하였다. 24시간 후, 5 mg mL-1의 MTT 시약을 serum free medium과 1:9로 혼합하고 각 well에 100μL씩 첨가하여 4시간 재 배양하였다. 이후 medium을 제거하고 99.5% DMSO 100 μL씩 첨가하여 세포를 용해시키고 microplate Reader를 이용해 540nm에서 흡광도를 측정하였다. 세포에 대한 들개미자리 추출물의 독성 여부는 CC50 (cytotoxicity concentration 50)을 계산하여 평가하였다.
실험용 쥐의 단회경구투여를 통한 독성 평가
들개미자리 추출물을 단회경구투여시 나타나는 독성을 평가하고 독성 용량에 대한 정보를 얻기 위하여 sprague dawley (SD) 실험용 쥐에 들개미자리 추출물을 단회경구투여하고 투여 이후 14일간 관찰하였다. 실험동물은 ORIENTBIO Inc. (Seongnam, Korea)에서 6주령 수컷 20마리를 공급받았고 시험기간 동안 동물실의 온도는 21-24℃, 습도 45-60%, 조명은 12시간 주기로 일정하게 유지하였으며 사료와 물은 제한 없이 공급하였다. 입고 후 1주일의 적응기간을 거친 후 체중을 측정하여 그룹당 체중의 평균이 유사하도록 동물들을 Z배열법에 따라 1군당 5마리씩 4개의 군(대조군, 들개미자리 추출물 저용량, 들개미자리 추출물 중용량, 들개미자리 추출물 고용량)으로 분리하였다.
일주일 간의 적응 기간을 거친 실험용 쥐에게 증류수, 들개미자리 추출물 (500, 1000, 2000 mg kg-1)을 각각 단회 경구 투여하였다. 투여액량은 5 mL kg-1으로 하고, 개체별 투여액량은 투여 전 측정 체중을 기준으로 산출하였다. 경구 투여한 뒤 사망률, 일반증상, 체중변화, 사료섭취량을 관찰하고 부검(투여 이후 14일차)을 통해 혈액생화학 분석을 진행하고 육안으로 장기의 이상을 관찰하였다. 체중은 투여 후 3, 7, 10, 14일차에 측정하고 사료 섭취량은 투여 후 2, 6, 9일차에 공급량을 측정하여 익일에 공급과 동일한 시간대에 잔량을 측정하여 일일 섭취량을 산출하였다. 부검은 전날 12시간 절식한 동물에 대하여 isoflurane 과마취 하에 개복하여 복대동맥에서 채혈하여 일반 혈액 검사 (complate blood count, CBC)와 혈액 생화학검사를 실시하였다.
통계처리
모든 수치는 평균 ± 표준편차로 표시하였고 통계처리는 SPSS for Windows (Release 14.0K, SPSS Inc., USA)를 이용하여 평가하였으며, p-value가 0.05 이하인 경우 통계적 유의성을 인정하였다.
결과 및 고찰
들개미자리 메탄올 추출물의 회수율
실험에 사용된 들개미자리는 제주특별자치도 서귀포시 안덕면 상천리에서 수집된 지상부위(줄기+잎)를 이용하였으며, 메탄올 추출물의 회수율은 6.31%이었다.
식물독성 검정
식물독성 실내 테스트(in vitro experiment)
외래식물인 들개미자리 추출물의 식물독성을 신속하게 평가하기 위하여 국내 농경지에서 재배되고 있거나 혹은 환경 중에 서식하고 있는 식물종이 발아에 걸리는 최초 시간을 조사하였다. 발아실험 결과, 종자의 발아가 16시간 내에 이루어진 식물로는 감초, 나팔꽃, 무, 보리, 브로콜리, 비타민채, 삼색무, 수수, 알팔파, 완두, 적하수오였다. 이들의 평균 발아율은 모두 80% 이상이었으며 (데이터 미제시) 보리를 제외하고는 모두 광엽 식물이었다. 독성평가를 위한 유묘의 생중량 체크뿐만 아니라 육안관찰이 쉬운 식물종으로는 나팔꽃이 최적이라고 판단되었다. 국내의 많은 연구자들이 환경 중에서 한 식물종이 타 식물종의 발아와 생장을 억제하는 상호대립억제작용(allelopathy) 실험에 사용한 대상 종으로는 배추, 한련초, 벼, 달맞이꽃(Woo and Kim, 1987), 고추, 상치, 쇠무릎, 배추, 무(Jin and Kim, 2001), 콩, 무, 유채, 상추(Lee, 2010) 등 매우 다양하였으며 특정 종이 선발되어 사용된 경우는 없었기 때문에 본 연구의 나팔꽃도 식물독성 평가에 있어서 좋은 소재라고 판단되었다.
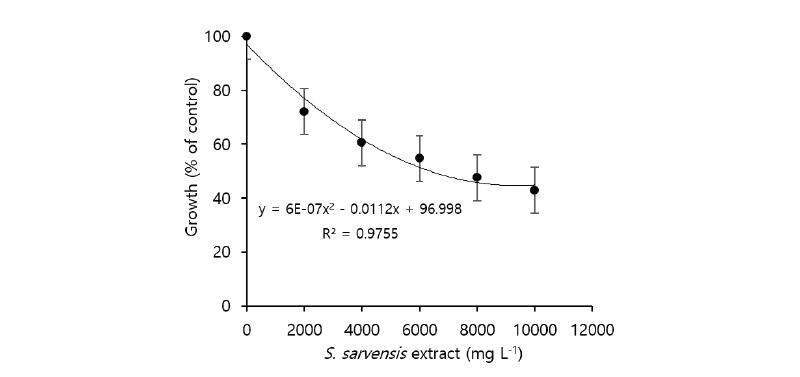
들개미자리 메탄올 추출물을 24-well tissue culture testplate의 well에 치상되어 있는 나팔꽃 종자에 처리한 결과, 나팔꽃의 생장은 농도의존적으로 억제되었으며(y = 6E-0.7x2 - 0.00112x + 96.998) 생장의 50%가 억제되는 농도는 6,370 mg L-1 이었다 (Fig. 3). 이와 같은 결과를 타식물의 생장을 억제하는 살초활성물질을 함유하여 식물독성이 높았던 족도리풀(Asarum sieboldii MIQ.: GR50값, 242 μg g-1)(Kim et al., 2005), 가시박(Sicyos angulatus LINN.; GR50값, 328 ug g-1)(Cho et al., 2010), 두릅나무(Aralia elata SEEM; GR50값, 362 μg g-1)(Kim, 2006), 삼지구엽초(Epimedium Koreanum NAKAI; GR50값, 381 μg g-1)(Lim et al., 2006)과 비교하면 식물독성은 매우 약하다고 판단되었다.
식물독성 온실 테스트(Green house experiment)
들개미자리 메탄올추출물이 다른 식물에 미치는 영향은 두 부분으로 나뉘어 온실조건에서 연구가 수행되었다: 토양에 처리되어 식물의 발아에 미치는 영향(토양처리)과 타 식물의 경엽에 처리되어 식물의 생장에 미치는 영향(경엽처리).
토양처리 효과
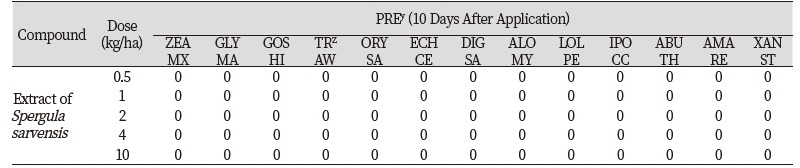
토양처리의 경우 작물 5종(옥수수, 콩, 목화, 밀, 벼)과 잡초 8종(물피, 바랭이, 쥐꼬리뚝새풀, 호밀풀, 둥근잎유홍초, 어저귀, 털비름, 도꼬마리) 종자가 파종되어 있는 표토에 들개미자리 추출물 0, 0.5, 1, 2, 4, 10 kg ha-1을 처리하고 처리 10일 후에 달관평가를 실시하였다. 들개미자리 추출물은 10 kg ha-1 수준(10,000 μg L-1)에서 다른 식물의 생장에 영향을 미치지 않았다(Table 1; Fig. 4). 본 연구의 결과는 토양에 매몰되었다가 발아하는 식물종자에 미치는 들개미자리의 독성이 거의 없다는 것을 보여준다.

Fig. 4. Phytotoxicity of pre-emergence treatment of corn spurrey (Spergula sarvensis) extract (10 kg ha-1) on several plants in a greenhouse condition. Photos were taken 10 days after treatment. Crop (from the left in pot) corn (Zea mays), soybean (Glycine max), cotton (Gossypium hirsutum), wheat (Triticum aestivum), rice (Oryza sativa); Weed (from front left in pot) cocklebur (Xanthium strumarium), redroot pigweed (Amaranthus retroflexus), velvet leaf (Abutilon theophrasti),red morningglory (from behind left) perennial rye-grass (Lolium perenne), black grass (Alopecurus myrosuroides),southern crabgrass (Digitaria sanguinalis), barnyardgrass (Echinochloa curs-galli).
경엽처리 효과
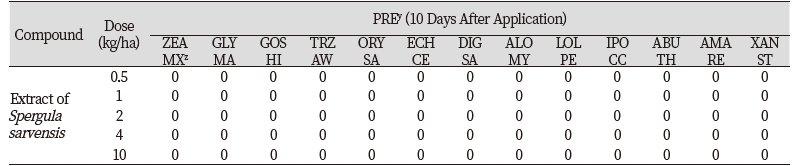
경엽처리의 경우 작물 5종(옥수수, 콩, 목화, 밀, 벼)과 잡초 8종(물피, 바랭이, 쥐꼬리뚝새풀, 호밀풀, 둥근잎유홍초, 어저귀, 털비름, 도꼬마리) 종자를 파종하고 14일간 재배한 후 들개미자리 추출물 0, 0.5, 1, 2, 4, 10 kg ha-1 경엽에 처리하고 처리 10일 후에 달관평가를 실시하였다. 그 결과 들개미자리 추출물은 10 kg ha-1 수준에서 타 식물의 생장에 그 어떠한 효과도 미치지 못하였다(Table 2; Fig. 5). 본 연구의 결과는 들개미자리 추출물이 환경 중으로 방출 또는 누출되어도 인접하여 자라는 식물의 생육에 어떠한 영향도 미치지 못한다는 것을 나타낸다고 하겠다.
본 연구에서 들개미자리 추출물을 토양처리와 경엽처리하였을 때 모두 타 식물에 대한 생장억제가 발견되지 않았다; 이러한 결과는 들개미자리가 농업생태계뿐만 아니라 환경생태계에 확산되더라도 그 원인은 독성에 의한 것은 아니라는 것을 시사하여 준다.

Fig. 5. Phytotoxicity of foliar treatment of corn spurrey (Spergula sarvensis) extract (10 kg ha-1) on several plants in a greenhouse condition. Photos were taken 10 days after treatment. Crop (from the left in pot) corn (Zea mays), soybean (Glycine max), cotton (Gossypium hirsutum), wheat (Triticum aestivum), rice (Oryza sativa); Weed (from front left in pot) cocklebur (Xanthium strumarium), redroot pigweed (Amaranthus retroflexus), velvet leaf (Abutilon theophrasti), red morningglory (from behind left) perennial rye-grass (Lolium perenne), black grass (Alopecurus myrosuroides), southern crabgrass (Digitaria sanguinalis), barnyardgrass (Echinochloa curs-galli).
미생물 독성 검정
황산화 미생물에 대한 들개미자리 추출물 독성 평가
본 연구에서는 토양에 빈번하게 존재하는 황산화 미생물을 이용해 들개미자리 추출물에 대한 독성평가를 시험하였다. 황산화 미생물은 산소를 최종전자수용체로 이용하여 황을 산화시켜 황산염을 만들고 그로부터 얻은 에너지를 활용하는 호기성 자가영양 미생물이다(식 (2); Madigan et al., 2003).
S0 + H2O + 1.5O2 → SO42− + 2H+, ∆G◦′ = −587 kJ/reaction (2)
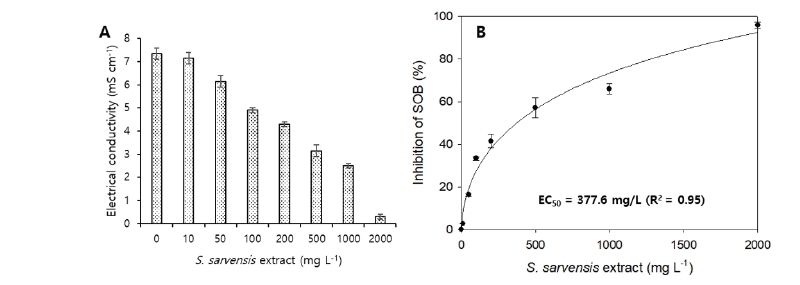
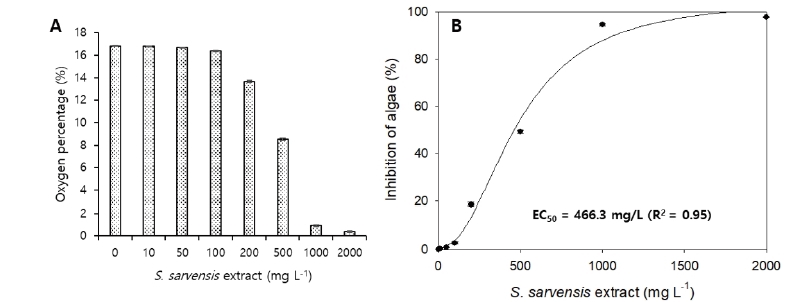
독성물이 존재할 경우 황산화 미생물의 활성은 그렇지 않을 때 보다 감소하여 황산염 이온의 증가 속도는 느려진다. 이때 황산염 이온의 농도 증가는 전기전도도로 측정이 가능해 독성 물질이 없는 대조군과 독성 물질을 함유한 실험군의 전기전도도 값을 비교, 분석하여 독성 평가가 가능하다. Fig. 6A는 각기 다른 농도의 들개미자리 추출물을 황산화 미생물 Vial 테스트에 주입하고 5시간 배양 후 전기전도도 변화를 나타내고 있다. 전반적으로 높은 농도의 추출물이 주입될수록 전기전도도의 변화량은 적었다. 예를 들어 추출물이 전혀 주입되는 않은 테스트에서는 5시간 배양 동안 평균적으로 약 7.4 mS cm화량은 적었다. 예를 들어 추출물이 전혀 주입되는 않은 테스트에서는 5시간 배양 동안 평균적으로 약 7.4 mS cm-1의 전기전도도 상승을 보였으나 100, 500, 1,000, 2,000 mg L의 전기전도도 상승을 보였으나 100, 500, 1,000, 2,000 mg L-1의 추출물이 주입될 경우 각각 4.9, 3.2, 2.5, 0.3 mS cm-1의 전기전도도 상승을 보였다. 이는 더 많은 양의 들개미자리 추출물이 주입될 수록 독성이 증가하고 황산화 미생물의 활성이 저해되어 더 적은 황산염을 생산하므로 전기전도도 상승이 적은 것이라 추정된다.
Fig. 6B는 주입 추출물 농도에 따른 황산화 미생물의 저해도(%)를 나타낸다. 100, 500, 1,000, 2,000 mg L-1의 들개미자리 추출물 주입에 황산화 미생물은 각각 33.3, 57.1, 66.0, 95.9%의 저해도를 보였다. 저해도 결과 값들을 바탕으로 황산화 미생물의 들개미자리 추출물에 대한 5시간 EC50 값을 계산해본 결과 그 값은 377.6 mg L-1였다. 이 값은 앞의 세포 독성 평가의 CC50 값 보다는 낮았지만 본 연구실에서 수행된 연구(Ahmed and Oh, 2018; Eom et al., 2019; Hassan et al., 2010; Oh et al., 2011; Qambrani et al., 2014; Van Ginkel et al., 2010; Van Ginkel et al., 2011)에서 발견한 중금속, 무기질소, BTEX, endocrine-disrupting compounds 와 같은 무기, 유기 오염물들에 대한 황산화 미생물의 EC50 (0.2-101.5 mg L-1) 값들 보다는 크게 높아 들개미자리 추출물은 황산화 미생물의 활성에 큰 저해효과를 일으키는 물질이라 보기 어렵다고 판단된다.
미세조류에 대한 들개미자리 추출물 독성 평가
본 연구에서는 토양에 빈번하게 존재하는 미세조류인 Chlorella vulgaris를 활용해 들개미자리 추출물에 대한 독성평가를 시험하였다. Chlorella vulgaris는 독성 평가에 빈번히 활용되는 광합성 미생물로서 미생물 활성(광합성)의 결과로 산소를 발생시킨다. 오염물질 존재 시 독성으로 인해 Chlorella vulgaris의 활성은 저해 받고 더 적은 산소를 발생시킨다. 이를 바이오 반응조 Head-space의 산소농도로 측정하고 그 결과값을 바탕으로 들개미자리 추출물의 독성을 평가하였다. 들개미자리 추출물을 주입하고 12시간 배양 전후 조류 Vial 테스트의 Head-space 산소 농도(%) 변화량을 Fig. 7A에 나타냈다. 배양 시작 전 질소 가스를 불어넣어 산소를 제거하여 산소 농도는 0.42-0.47% 였다. 12 시간 배양 후 추출물을 주입하지 않은 미세조류 테스트에서는 평균적으로 약 16.8%의 산소 농도 상승을 기록하였다. 그러나 100, 500, 1,000, 2,000 mg L-1의 들개미자리 추출물을 주입한 테스트에서는 16.4, 9.0, 1.4, 0.8%의 산소 농도 상승을 보였다. 이는 높은 농도의 추출물이 주입될수록 조류에 의한 광합성 활동이 저해 받아 더 낮은 산소 발생을 보였다는 것을 암시한다.
Fig. 7B는 들개미자리 추출물 농도에 따른 미세조류의 저해도를 나타낸다. 100, 500, 1,000, 2,000 mg L-1로 주입 추출물의 농도가 증가할수록 미세조류의 저해도 역시 2.6, 49.2, 94.5, 97.6%로 증가하였다. 이 값들을 이용하여 조류의 들개미자리에 대한 12시간 EC50 값을 계산한 결과 그 값은 약 466.3 L-1 였다. 이 값은 앞의 황산화 미생물의 EC50 값 보다 높았는데 이와 같은 결과는 조류가 황산화 미생물과 비교하여 들개미자리 추출물에 영향을 덜 받았다고 할 수 있다.
앞의 미생물을 이용한 들개미자리 추출물 독성평가는 각각 황산화 미생물과 조류의 활성 결과 황산염과 산소를 만들어 내는 생물학적 반응을 이용하였고 이들을 측정한 전기전도도와 산소 농도를 최종 독성측정 평가 항목(the end-point measurement)으로 삼았다. 일반적으로 생태독성의 유효성을 평가함에 있어서 가장 중요한 부분은 dose-response의 상관관계이다 (독성물의 농도와 생물학적 저해도의 상관관계). 즉, 독성물의 농도가 높아짐에 따른 시험 생물종의 활성이 저해되고 그 상관관계가 높아야 그 시험 생물종을 이용한 생태독성 평가가 독성 평가로서 유효성을 갖는다. Fig. 6B와 7B에서 볼 수 있듯이 황산화 미생물과 조류를 이용한 생태독성 평가 모두 R2가 0.95 이상의 높은 dose-response의 상관관계를 가졌다. 이는 두 미생물을 활용한 독성 평가가 생태독성 평가로서 높은 유효성을 갖는다는 것을 보여준다. 그러나 독성 평가의 민감도 측면에서는 황산화 미생물과 미세조류의 들개미자리 추출물에 대한 EC50 값들은 상당히 높았으며 이는 들개미자리 추출물에 대한 낮은 독성 민감도를 뜻한다.
미생물을 이용한 독성 평가법은 간단한 Vial 테스트 형태로 개발되어 현장에서 직접 독성을 측정할 수 있게 설계되었으며 측정 시간 역시 5시간, 12시간으로 상대적으로 단시간에 독성을 평가할 수 있다. 뿐만 아니라 독성을 평가하는 항목인 전기전도도, 산소 농도는 측정이 용이하고 측정에 전문적 지식이 필요치 않는다. 또한 측정 오류가 개입될 여지도 낮아 실제 2반복 실험에서 높은 재현성을 보였다. 비록 독성 탐지 민감도는 높진 않았으나 독성 평가를 위해서 EC10 또는 EC20을 독성 평가 임계 값으로 설정 시 황산화 미생물은 15.2-52.5 mg L-1 미세조류는 170.5-247.3 mg L-1 정도의 탐지 민감도를 가질 수 있다. 향후 미생물 독성 Vial 테스트의 운전 조건 최적화를 통해 탐지 민감도를 향상시킬 수 있으리라 기대된다. 또한 본 연구에서 사용한 Acidithiobacillus와 Chlorella vulgaris는 토양 속에 빈번히 존재하는 미생물이므로 이들의 활성 저해 정도를 통해서 들개미자리에 의한 토양의 오염 정도 또는 토양의 질을 평가하는 항목으로도 활용될 수 있으리라 생각된다. 따라서 이러한 여러 장점들을 종합해 볼 때 본 연구의 황산화 미생물과 미세조류를 이용한 미생물 독성 Vial 테스트는 들개미자리 또는 나아가 여러 식물 추출물들이 가지고 있는 독성 평가에 높은 활용도를 가질 수 있는 유용한 평가법이라 판단된다.
포유류 독성 검정
들개미자리 추출물이 마우스 대식세포(RAW 264.7)와 인간 각질형성세포(HaCaT)의 생존율에 미치는 영향
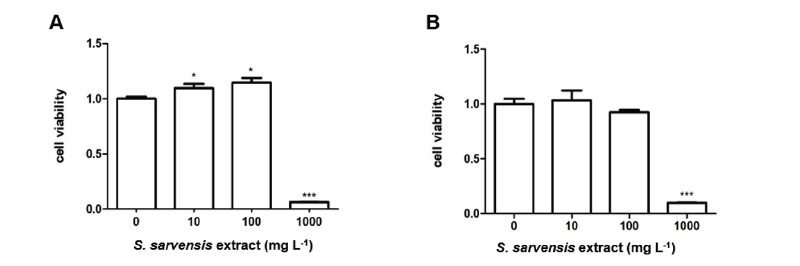
들개미자리 추출물이 마우스 대식세포와 인간 각질형성세포의 생존율에 미치는 영향을 평가하기 위해 MTT assay를 각각 실시하였다. 들개미자리 추출물을 10, 100, 1000 μg mL-1 농도를 마우스 대식세포에 처치하였을 시, 세포 생존율은 1000 μg mL-1 농도에서 대조군과 비교하여 약 94% 감소하는 경향을 보였고 그 이하의 농도에서는 세포독성을 나타내지 않았으며, 이때 CC50은 591.4 μg mL-1로 산출되었다(Fig. 8A). 한편, 들개미자리 추출물을 10, 100, 1000 μg mL-1 농도를 인간 각질형성세포에 처치하였을 시, 세포 생존율은 1000 μg mL-1 농도에서 대조군과 비교하여 약 91% 감소하는 경향을 보였고 그 이하의 농도에서는 세포독성을 나타내지 않았으며, 이때 CC50은 563.3 μg mL-1로 산출되었다(Fig. 8B). 들개미자리 추출물은 면역세포(마우스 대식세포) 및 피부세포(인간 각질형성세포)에서 모두 세포생존율을 감소시켰으나, 독성농도가 매우 높아 실제로 독성을 일으킬 확률은 낮을 것으로 사료된다.
실험용 쥐에게 들개미자리 추출물의 단회경구투여 시 미치는 영향
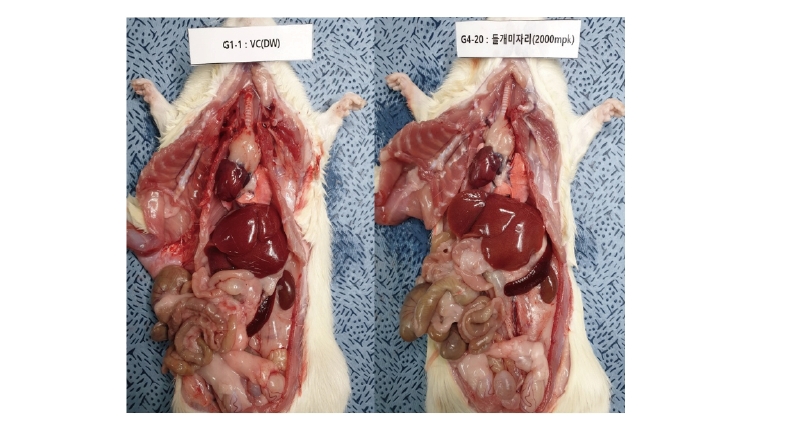
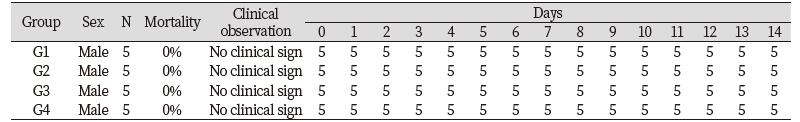
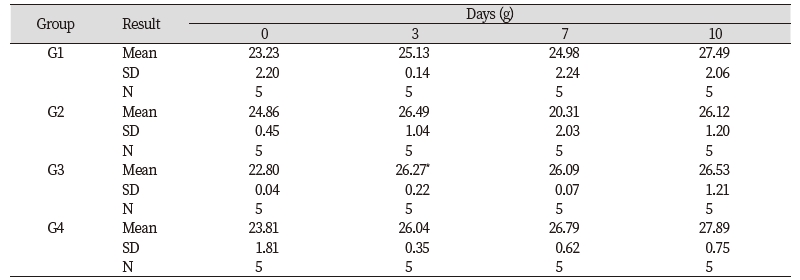
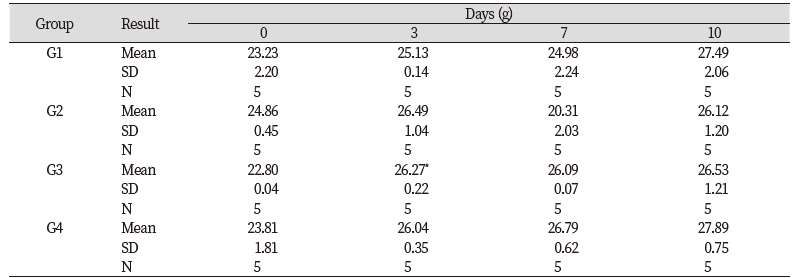
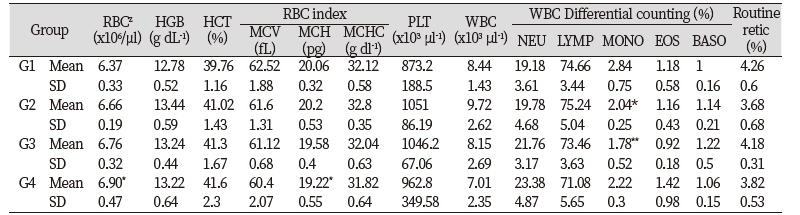
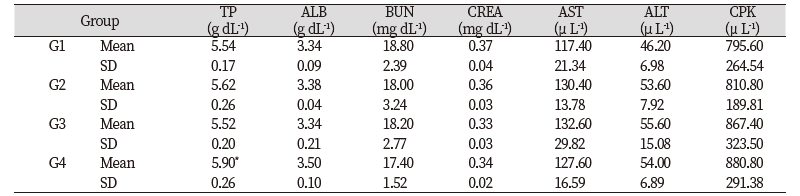
들개미자리 추출물의 단회경구투여 시 나타나는 독성을 평가하기 위하여 실험용 쥐를 사용한 단회경구투여 독성시험을 실시하였다. 모든 투여용량에서 단회경구투여 후 사망개체 발생은 없었고, 시험물질 투여 후 14일 동안에도 특이한 임상증상은 관찰되지 않았다(Table 3). 체중은 총 5회 측정하였으며, 대조군 대비 들개미자리 투여군에서 유의적인 체중 차이는 확인되지 않았다(Table 4). 사료섭취량도 대조군 대비 사료 섭취량의 큰 차이는 확인되지 않았다(Table 5). 투여 14일 후 부검 시 전 개체에 일반적인 약물의 대사에 의한 간의 변화, 비장의 변화, 신장의 변화가 관찰되지 않았다(Fig. 9). 또한 채취한 혈액의 일반 혈액검사(Table 6)와 혈액 생화학적 검사(Table 7) 결과 역시 들개미자리 추출물에 의한 독성이 나타나지 않았다. 다만 WBC 관련 항목 중 Monocyte의 비율은 중용량 이상에서 대조군과 비교하여 유의적으로 감소하였다. 임상증상과 연결된 수치의 변화는 아니었으나 추후 실험시에 추가적으로 관찰할 필요가 있다.
본 시험에서 들개미자리 추출물을 500, 1000, 2000 mg kg-1 용량으로 단회경구투여 후 독성학적 의미가 있는 임상증상, 부검소견, 체중변화, 혈액학 및 혈액생화학적 검사 소견이 발견되지 않았다. 따라서 본 실험의 랫드 단회경구투여 독성실험에서 들개미자리 추출물의 반수치사량 및 개략적 치사량은 각각 2,000 mg kg-1이상으로 산출되어 경구투여 시 안전한 물질로 사료된다(Han et al., 2013). 다만, 반복적인 섭취시의 독성 여부에 대한 평가는 추후 확인되어야 할 것으로 사료된다
Authors Information
Heonseop Eom, School of Natural Resources and Environmental Sciences, Kangwon National University, Postdoctoral researcher
Sang Eun Oh, School of Natural Resources and Environmental Sciences, Kangwon National University, Professor
So-Yeon Kim, School of Natural Resources and Environmental Sciences, Kangwon National University, Master student
Se Jin Park, School of Natural Resources and Environmental Sciences, Kangwon National University, Professor
Minji Hong, School of Natural Resources and Environmental Sciences, Kangwon National University, Ph.D. student
Songmun Kim, School of Natural Resources and Environmental Sciences, Kangwon National University, Professor, https://orcid.org/0000-0002-8032-7569
Ki-Hwan Hwang, Moghu Research Center, Researcher
Yong Ho Lee, Department of Plant Life and Environmental Science, Hankyong National University, Research Professor, https://orcid.org/0000-0002-8714-3746
Sun Hee Hong, Department of Plant Life and Environmental Science, Hankyong National University, Professor, https://orcid.org/0000-0001-7581-0604