서 언
잔디의 피복은 물이나 바람에 의한 토양유실을 방지해주며, 거주 지역의 햇빛에 의한 눈부심이나 소음을 감소시킴으로써 생활환경 개선에 도움을 준다. 또한 학교 운동장의 천연잔디 식재는 먼지의 비산을 방지하며 도심의 열섬 현상을 완화시키고, 공기 정화, 소음 감소 등으로 학습환경을 개선시킨다(Potter, 1998; Stiles et al., 2009). 따라서 잔디가 가지는 다양한 기능들로 인해 주택이나 공원과 같은 생활권 주변이나 종합운동장, 골프장과 같은 곳에 대규모로 사용되어 산업적으로도 중요한 자원이 되고 있다.
이러한 잔디에는 다양한 해충들과 병해가 발생하여 잔디에 직·간접적인 피해를 유발하고 있으며 잡초도 주요한 관리 대상이다(Choi et al., 2016; Lee et al., 2014; Min et al., 2014). 또한 잔디에는 다양한 식물기생선충들도 피해를 주고 있는데 Couch (1995)는 8과 12속 63종의 식물기생선충을 보고하였고, Southern New England 지역의 38개 골프장 114개 잔디 시료들에 대한 식물기생선충 조사 시 Tylenchorhynchus속이나 Helicotylenchus속 선충의 검출률이 100%로 이들 두 속의 선충이 보편적으로 잔디에서 발생하였다(Jordan and Mitkowski, 2006). 이와 같이 다양한 선충들이 잔디에 발생하여 피해를 주고 있는데 잔디의 초종이나 지역에 따라 발생하는 식물기생선충의 종류는 차이가 있지만 우리나라에서는 고구마뿌리혹선충(Meloidogyne incognita)이나 잔디뿌리혹선충(M. marylandi), Tylenchorhynchus claytoni를 비롯한 소수의 선충들 만이 잔디에 피해를 주고 있는 것으로 보고되고 있다(Choo et al., 1998; Kang et al., 2002; 2003; Khan et al., 2008).
잔디에 기생하는 선충들에 의한 잔디 피해는 선충의 종류에 따라 다양하게 나타나는데 잔디 뿌리의 분열조직을 파괴하여 뿌리 생장을 저해하기도하고, 뿌리를 왜화시키거나 썩게 하기도 한다. 또한 이러한 뿌리 부분에 의한 피해로 지상부에 부분적인 황화현상이 나타나거나 시들음, 생육저해, 고사 등의 피해가 발생하기도 한다(Radewald and Westerdahl, 1989).
식물기생선충에 의한 작물 피해가 매년 발생하고 있고, 이러한 피해를 줄이기 위해서 다양한 식물기생선충 방제법이 활용되고 있는데 물대기나 경운, 깨끗한 휴경지 관리, 유기질 비료 시용과 같은 물리적 방제법이나 잡초관리 및 비기주 작물 재배, 혼작, 유인식물 재배, 길항식물 재배, 식물체를 이용한 훈증과 같은 작물 기반의 방제법, 각종 미생물이나 식물체 유래 살선충 물질을 활용하는 생물적 방제, 작물 재배 전이나 후에 살선충제를 이용하는 화학적 방제법 등이 있다(Sikora and Roberts, 2018). 그러나 잔디가 영년으로 관리되고 있는 골프장과 같은 곳에서는 경종적 방법을 활용할 수 없으며 골프장의 그린과 같이 집약적 관리가 필요한 곳에 선충 피해가 발생하면 즉각적인 대처가 필요하기 때문에 화학적 방제가 현실적 대안이다. 그러나 우리나라에서는 잔디에 피해를 주고 있는 선충 피해가 실제적으로 발생하고 있음에도 불구하고 잔디에 발생하는 선충에 대한 연구가 부족하고, 현장에서는 선충 피해를 인식하지 못하고 있는 실정으로 잔디 선충 방제제로 등록된 농약도 부재한 실정이다. 따라서 잔디에 발생하는 식물기생선충 방제를 위한 방제제 개발이 절실하다.
따라서 본 연구는 기존에 살선충 효과가 있는 것으로 알려진 화학 살선충제와 친환경 소재 살선충 활성 제품들의 잔디기생선충에 대한 활성을 검증하여 골프장이나 잔디재배지에서 실용적 활용을 위한 기초자료를 확보하기 위해 수행하였다.
재료 및 방법
잔디기생선충에 대한 살선충 활성 실내 검정
선충 분리
2019년 7월 경상남도 사천시에 위치한 서경타니컨트리클럽의 주작4번 코스의 티와 인천광역시에 위치한 스카이 72 골프클럽 4번 코스의 그린에서 황화현상이 일어나거나 활력이 떨어지고, 뿌리 발육이 부진한 잔디를 지름 10.5 cm의 홀 커트를 이용하여 채취하여 지퍼팩에 넣어 실험실로 가져와 토양과 잔디뿌리를 조사하여 잔디기생선충의 존재를 확인하였다. 이후 이들 지역에서 채취한 시료에서 잔디 뿌리 주변에 붙은 흙을 잘 분리하고, 토양 내 존재하는 선충을 분리하여 실내에서 잔디기생선충에 대한 살선충 물질들의 활성 검정을 수행하였다.
선충의 분리는 직경 20 mesh (850 µm), 60 mesh (250 µm), 325 mesh (45 µm), 400 mesh (38 µm)의 채(Testing sieve, Chunggyesanggongsa, Seoul, Korea)를 이용하였다. 300 cc의 토양에 물을 넣어 잘 섞어준 후 채에 부어주었다. 325, 400 mesh 채에서 분리된 토양은 킴와이퍼(Wipers medium 200's, KIMTECK SCIENCE, Korea) 2장을 겹쳐 깔아준 후 베르만 깔때기법을 응용하여 선충을 분리하였고(Bridge and Starr, 2010), 24시간 경과 후 100 mL 비이커에 선충을 받아 실험에 사용하였다.
분리한 선충은 입체현미경(Nikon M2 1000, Nikon, Kawasaki, Japan) 하에서 형태학적인 특징을 확인하여 속 수준으로 분류를 한 후, 슬라이드 표본을 제작하여 Zeiss imager Z3 microscope (Carl Zeiss, Gottingen, Germany)로 각 선충의 체장, 체폭, 구침의 길이 등 분류학적 형질을 측정하여 종을 동정하였다(Mwamula et al., 2020a; 2020b; 2020c).
살선충 활성 검정 방제제
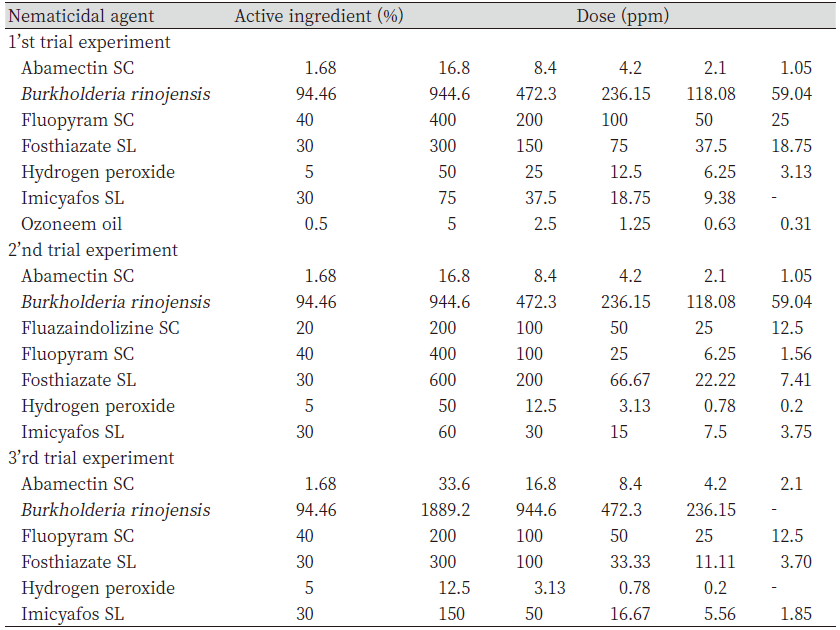
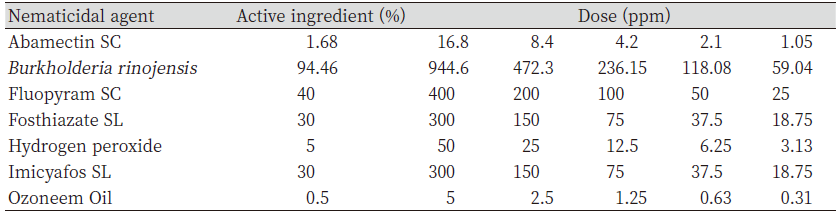
실험에 사용된 방제제들은 우리나라에서 식물기생선충의 방제 약제로 등록이 되어있거나 살선충 효과가 있다고 알려진 약제들로 선정하였다. 약제는 시중에 판매 중인 것을 구입하거나 회사로부터 공급받아 사용하였으며 시험 방제제들의 유효성분 함량이나 제형 및 실내 시험의 처리 농도는 Table1, 2와 같았다. 처리 농도는 권장 처리 농도를 기준으로 예비시험을 수행하여 설정하였다.
Table 1. Nematicidal agents used in laboratory experiment against turfgrass parasitic nematodes isolated from Tani country club.
|
|
SC: Suspension concentrate; SL: Soluble concentrate. |
Table 2. Nematicidal agents used in laboratory experiment against turfgrass parasitic nematodes isolated from Sky72 golf club.
|
|
SC: Suspension concentrate; SL: Soluble concentrate. |
살선충 활성 검정
실내 살선충 활성물질 효과 검정은 서경타니 골프장 토양 시료에서 채취한 선충들을 이용하여 세 차례 수행하였고, 스카이72 골프장 토양 시료의 선충을 이용해서 한 차례 수행하였다. 서경타니 골프장에서 분리한 선충을 이용한 첫 번째 실험과 스카이72 골프장 선충을 이용한 살선충 활성 검정 실험은 살선충 활성 물질들에 대한 1차적인 효과를 검정하였고, 이후 서경타니 골프장 분리 선충들을 이용한 실험들은 첫 번째 실험에서 효과가 우수한 살선충 물질들을 처리 농도를 변화시키면서 살선충 효과를 평가하였다.
토양 시료에서 상기에 기술한 방법으로 분리한 선충을 교반기(Corning PC-420D, Laboratory Stirrer, Tamaulipas, Mexico)에서 75 rpm으로 100마리/mL의 밀도가 되도록 현탁액을 만들었다. 자동피펫(Finnpipette F1 100-10,000 µL, Thermo Scientific, Vantaa, Finland)을 이용하여 12 multi well-plate (Multi-well plate, SPL, Pocheon, Korea)에 각 well당 선충 현탁액 1 mL과 시험약제 1 mL를 처리하였다. 한 개의 well을 한 반복으로 4반복 처리하였으며 무처리는 증류수를 사용하였다. 처리가 끝난 후 빛을 차단하기 위해 알루미늄호일(Lotte Alminum Co., Ansan, Korea)로 감싸 23℃의 생육상(HB 303 DH-0, Hanbaek, Bucheon, Korea)에 보관하였다.
서경타니골프장 분리 선충을 이용한 첫 번째 실험에서는 24, 48, 72시간 후 입체현미경(SM2 1000, Nikon, Kawasaki, Japan)하에서 선충의 치사여부를 조사하였는데 fluopyram의 경우 현탁액의 투명도가 낮아 현미경 하에서 선충의 형태가 식별되지 않아 처리 72시간 후에만 피펫으로 용액을 여러 개의 물방울로 나누어 선충의 치사 여부를 조사하였다. 선충의 치사 유무는 가는 핀으로 선충의 몸에 자극을 주었을 때 움직임 반응이 있으면 살아있는 것으로 간주하였다. 이외의 실험들도 처리 24, 48, 72시간 후에 치사 유무를 조사하였는데 결과는 72시간 자료를 보정사충율로 나타내었다.
처리 시간별에 따른 살선충 효과 검정
1차 실내 생물검정에서 우수한 효과를 보인 fluopyram과 hydrogen peroxide 두 물질에 대해 치사가 일어나는 시간을 알아보기 위해 실험을 수행하였다. 선충은 서경타니컨트리클럽의 주작4번 코스 티에서 채취한 토양시료에서 분리하여 실험에 사용하였다. Fluopyram은 400 ppm 농도로 처리하였으며 hydrogen peroxide는 50 ppm농도로 처리하였는데 활성 검정은 앞에서 기술한 살선충 활성 검정과 동일한 방법으로 12 multi well-plate (Multi-well plate, SPL, Pocheon, Korea)에 처리하였다. 시험약제의 살선충 활성 효과는 처리 후 3, 6, 9, 12, 24, 48, 72시간 후 입체현미경하에서 선충의 치사 여부를 전술한 방법으로 조사하였다. 무처리는 증류수만 처리하였으며 한 개의 well을 한 반복으로 4반복 처리하였다.
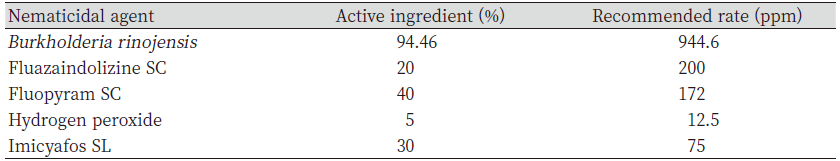
Table 3. Nematicidal agents used in field experiment.
|
|
SC: Suspension concentrate; SL: Soluble concentrate. |
잔디기생선충에 대한 살선충 효과 야외 검정
잔디기생선충 방제 야외 시험은 실내 실험에서 선충 분리를 위해 이용한 시료의 채취 지역인 경남 사천시에 위치한 서경타니컨트리클럽의 주작 4번 코스의 티에서 수행하였다.
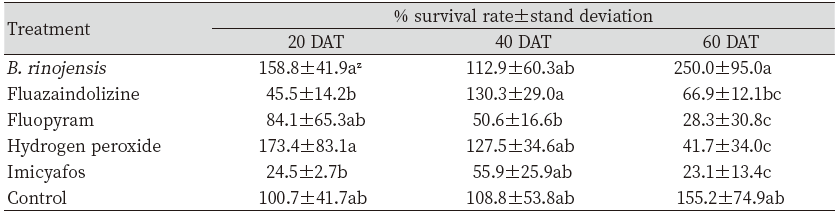
시험구는 가로와 세로 각각 1 m 크기로 설정하였는데 처리구 사이는 50 cm의 이격 공간을 두어 처리 간 혼입을 방지하였다. 시험구 별로 처리 전에 지름 10.5 cm의 홀 커트를 이용하여 각 구당 세 곳에서 토양 시료를 채취하였으며 채취한 시료는 지퍼팩에 넣어 연구실로 가져와 앞서 기술한 방법으로 토양 200 cc 당 식물기생선충의 밀도를 조사하였다. 살선충 물질은 실내실험에서 효과가 우수하였던 과산화수소와 fluopyram 및 중간정도의 살선충 효과를 보인 imysiafos, 살선충 활성이 낮았던 fluaziindolizine를 처리하였다. 각각의 처리량은 Table 3과 같았다.
약제 처리는 물뿌리개를 이용하여 m2 당 2 L씩 관주 처리하였는데 무처리구는 물만 처리하였으며 난괴법 3반복으로 배치하여 수행하였다.
약제 처리 일인 8월 6일에는 평균기온이 30.0℃, 강우량은 0 mm였으며 약제 처리 다음 날인 8월 7일에는 평균기온 28.4℃, 강우량 0.1 mm로 약제살포 전, 후로 약효에 영향을 미칠 만한 특별한 기상 상황은 없었다. 약제 처리 후 선충 밀도 조사는 처리 후 20, 40, 60일차에 사전 조사와 동일 한 방법으로 이전 조사 때의 토양 시료 채취 지점과 다른 부분에서 각 반복 당 세 곳의 시료를 채취한 뒤 처리 전 밀도 조사와 동일한 방법으로 선충 수를 조사하였다.
통계 분석
각 처리 약제의 살선충 효과 차이는 Microsoft Excel 2010을 이용해 생충률과 보정사충률 등을 구하였고, 각 항목들의 처리 평균 간 차이를 Tukey’s studentized range (HSD) test를 이용하여 분산분석 하였다(PROC ANOVA, SAS Institute, 2011). 모든 결과 자료는 평균±표준편차로 표기하였다.
결과
잔디기생선충에 대한 살선충 효과 실내 검정
사천 타니컨트리클럽에서 채취한 토양시료에서 분리된 선충은 Paratrichodorus minor, Helicotylenchus microlobus, Paralongidorus koreanensis, Mesocriconema curvatum, Tylenchorhynchus thermophilus 5 종이었는데(Mwamula et al., 2020a; 2020b; 2020c) 이들 선충은 토양 내에 혼재하여 발생하고 있어 선충을 구분하지 않고, 혼재된 상태의 선충을 분리하여 세 번의 실내 검정 실험을 수행하였는데 첫 번째 실내 실험 결과, 처리 24시간 후 hydrogen peroxide는 전체 처리 농도에서 95% 이상의 매우 높은 살선충 활성을 보였고(df=33, 68, F=708.53, p<0.0001)(Fig. 1A), 처리 48시간 후에는 abamectin과 fluopyram, fosthiazate의 일부 농도에서 80% 이상의 치사율을 보였다(df=33, 68, F=236.39, p<0.0001)(Fig. 1B). 처리 72시간 이후에는 fluopyram, hydrogen peroxide의 전체 농도에서 치사율이90% 이상으로 높게 나타났고, abamectin, fosthizate, imicyafos에서는 80% 이상의 치사율을 나타내었다(df=34, 70, F=270.22, p<0.0001) (Fig. 1C).
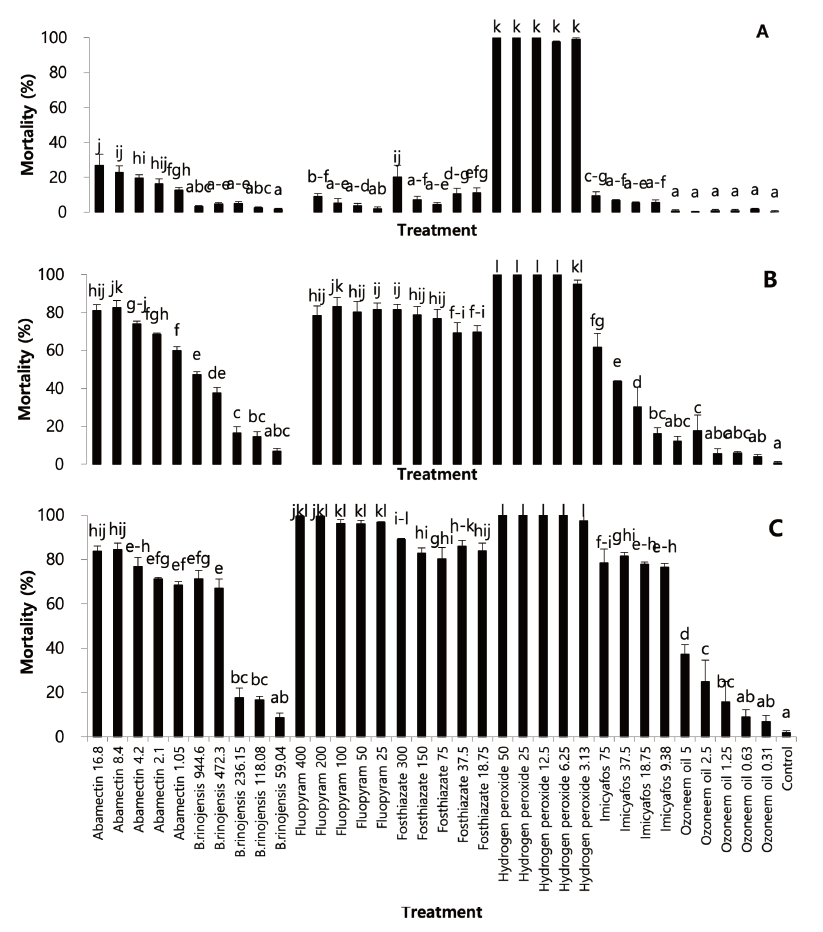
Fig. 1. Control efficacy of some nematicidal agents against turfgrass parasitic nematodes isolated from Kentucky blue grass in tee of Tani country club in multi-well plate (first trial). A: 24 hours after treatment; B: 48 hours after treatment; C: 72 hours after treatment. Nematodes were socked with aquatic suspension of nematicidal materials. Bars on the graph represent means of 4 replicates±SE; bars with the same lowercase letters are not significantly different according to the Tukey’s studentized range (HSD) test (P<0.05). Number in treatment is amount of applied nematicides’ active ingredient (ppm).
두 번째 실내검정에서는 첫 번째 실험에서 효과가 우수하였던 일부 살선충 물질의 처리 농도를 조절하여 처리하였는데 처리 72시간 후 처리별로 효과의 차이가 있었다(df=34, 70, F=54.91, p<0.0001) (Fig. 2). Fluopyram은 6.25 ppm이상에서 80% 이상의 보정사충율을 보였으며 fosthiazate는 100 ppm이상에서 hydrogen peroxide는 12.5 ppm이상에서 80% 이상의 보정사충율을 보였다(Fig. 2).
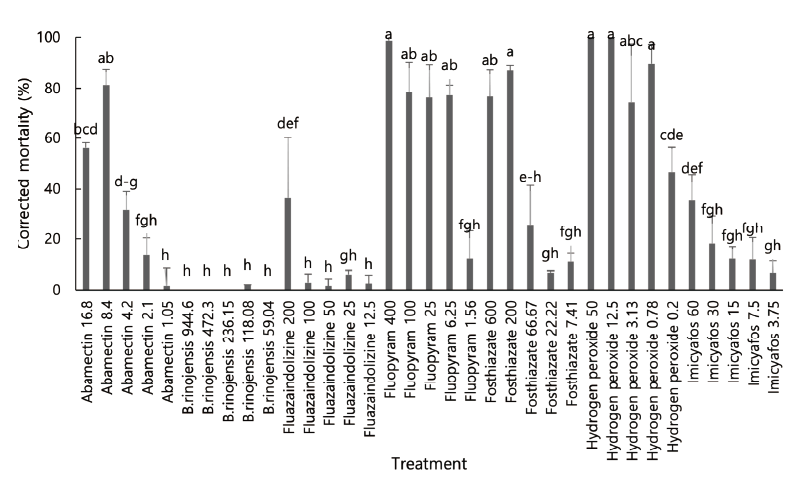
Fig. 2. Corrected mortality of turfgrass parasitic nematodes isolated from Kentucky bluegrass in tee of Tani country club socked with some nematicidal agents, 72 hours after treatment in multi-well plate (second trial). Bars on the graph represent means of 4 replicates±SE; bars with the same lowercase letters are not significantly different according to the Tukey’s studentized range (HSD) test (P<0.05). Number in treatment is amount of applied nematicidal agents’ active ingredient (ppm).
서경타니컨트리클럽 분리 선충을 이용한 세 번째 실험의 결과도 이전의 실험결과와 유사하게 나타나 fluopyram 200 ppm과 fosthiazat 100 ppm 이상 농도 처리에서 80% 이상의 살선충 효과를 보였다(df=27, 56, F=178.24, p<0.0001) (Fig. 3).
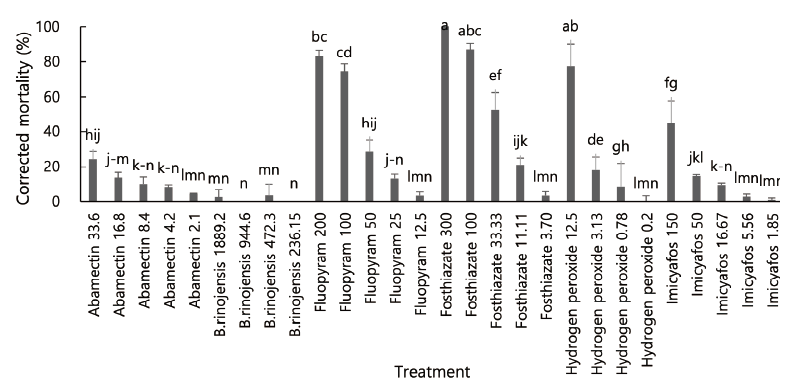
Fig. 3. Efficacy of some nematicidal materials against different turfgrass parasitic nematodes isolated from Kentucky bluegrass in tee of Tani country club, 72 hours after treatment in multi-well plate (third trial). Bars on the graph represent means of 4 replicates±SE; bars with the same lowercase letters are not significantly different according to the Tukey’s studentized range (HSD) test (P<0.05). Number in treatment is amount of applied nematicidal agents’ active ingredient (ppm).
스카이72골프장에서 분리한 토양에서는 Helicotylenchus microlobus 와 Mesocriconema curvatum 이 확인되었는데(Mwamula et al., 2020b; 2020c) 이들 선충들에 대한 살선충 활성검정 결과도 서경타니컨트리클럽에서 분리한 선충에 대한 실험결과와 유사하게 fluopyram 은 25 ppm이상에서 80%이상의 치사율을 보였고, fosthiazate는 150 ppm, hydrogen peroxide는 50-12.5 ppm에서 80% 이상의 치사율을 보였다(df=35, 72, F=316.24, p<0.0001) (Fig. 4).
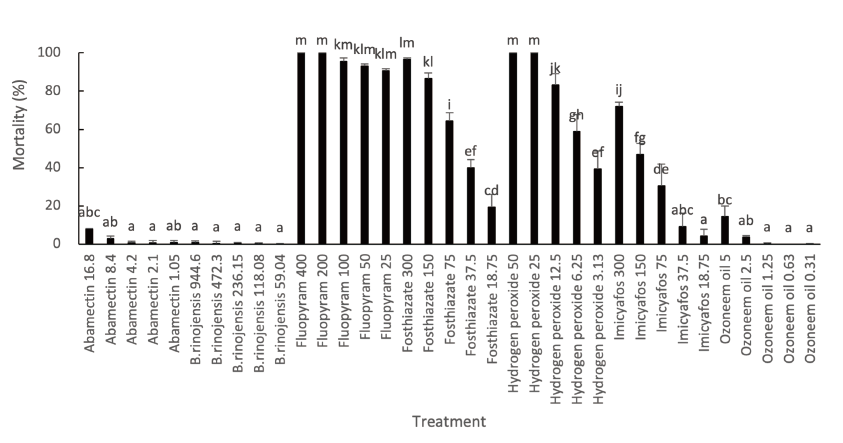
Fig. 4. Efficacy of some nematicidal materials against different turfgrass parasitic nematodes isolated from ryegrass in greens of Sky 72 country club, 72 hours after treatment in multi-well plate. Bars on the graph represent means of 4 replicates±SE; bars with the same lowercase letters are not significantly different according to the Tukey’s studentized range (HSD) test (P<0.05). Number in treatment is amount of applied nematicidal agents’ active ingredient (ppm).
시간별에 따른 살선충 효과
실내 살선충 활성검정에서 24시간대에 높은 살선충 활성을 보였던 hydrogen peroxide와 fluopyram을 이용하여 약제에 노출된 후 치사가 일어나는 최소시간대를 확인하기 위하여 조사한 결과 처리 3시간 후부터 두 약제 모두 20% 미만의 생충율을 보이며 무처리구와 유의한 차이를 보였고, hydrogen peroxide는 약제 처리 후 12시간에는 전체 선충이 치사되었다(Fig. 5)(3시간: df=2, 12, F=1244.17, p<0.0001, 6시간: df=2, 12, F=2406.92, p<0.0001, 9시간: df=2, 12, F=6732.64, p<0.0001, 12시간: df=2, 12, F=6730.49, p<0.0001, 24시간: df=2, 12, F=12376, p<0.0001, 48시간: df=2, 12, F=17555.1, p<0.0001, 72시간: df=2, 12, F=48185.4, p<0.0001). 또한 약제 처리 전에는 처리구와 무처리구 간 선충의 활동성에 차이가 없이 활발하게 움직이는 모습을 볼 수 있었지만, 처리 후 12시간이 되었을 때 약제 처리구는 선충이 일자로 곧게 펴진 모습으로 운동성이 없는 모습을 보인 반면 무처리구는 72시간까지 활발하게 움직이는 모습을 볼 수 있었다(observation data).
잔디기생선충에 대한 야외 검정
실내 실험 결과를 바탕으로 골프장에서의 약효를 알아보기 위하여 야외 시험을 수행하였는데 처리 20 일차에서 fluazaindolizine과 imicyafos처리구에서 무처리구 대비 낮은 생충율을 나타냈고(df=5, 12, F=4.3, p<0.0179), imicyafos의 경우 약제 처리 후 40일차(df=5, 12, F=2.37, p<0.1024)와 60일차(df=5, 12, F=8.62, p<0.0011)까지도 약효가 지속되었다(Table 4). 60일차에는 imicyafos와 fluopyram, hydrogen peroxide 처리가 무처리구와 유의하게 낮은 생충율을 보였다(Table 4).
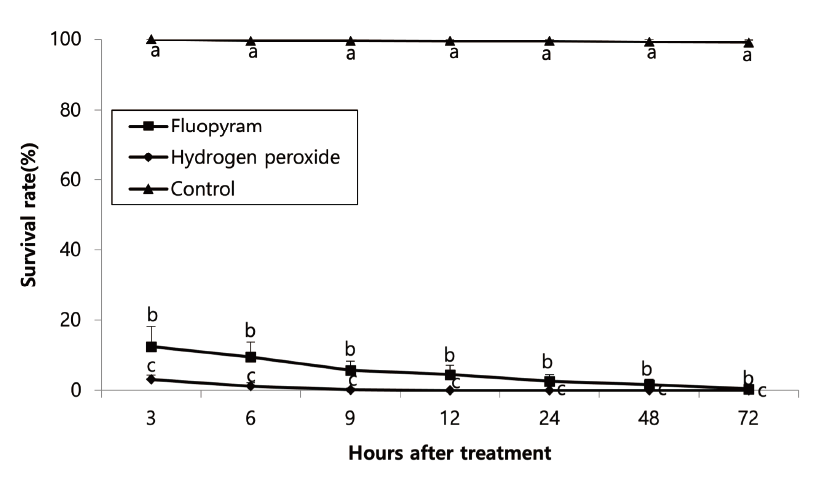
Fig. 5. Survival rate of turfgrass parasitic nematodes depending on exposure time against different nematicidal agents in petri dish. Bars on the graph represent means of 4 replicates ± SE; bars with the same lowercase letters are not significantly different according to the Tukey’s studentized range (HSD) test (p <0.05).
고찰
1980년대 이후 우리나라에서는 골프장 수가 매년 증가하고 있으며 올림픽과 월드컵 대회 개최 등을 통해 잔디에 대한 인식이 바뀌면서 잔디 재배지 면적도 증가하고 있다(Choi and Yang, 2006). 우리나라에서 잔디에 피해를 주는 병이나 해충에 관한 연구는 대부분 1990년대부터 활발히 수행되었지만 식물기생선충에 관한 연구는 매우 제한적으로 수행되었다(Choi et al., 2016; Lee et al., 2014; Min et al., 2014). 우리나라의 주요 경제작물 재배지에서는 뿌리혹선충의 피해가 가장 심각하고, 최근에는 씨스트선충류에 의한 피해가 대두되고 있으며 구근선충류나 뿌리썩이선충에 의한 피해도 발생하여(Cho and Han, 1986; Ko et al., 2017; Kwon et al., 2018; Park et al., 2019) 이들에 대한 살선충제들이 등록되어 있다(KCPA, 2020). 그러나 잔디의 경우 어떠한 선충류가 주로 피해를 주고 있는지에 대한 실태조사도 이루어지지 못하고 있는 실정이다. 본 연구에서는 두 골프장에서 잔디의 생육이 부진한 곳을 대상으로 식물기생선충들을 조사한 결과 5종의 식물기생선충이 확인되었고, 그들은 이미 미국 등지에서 잔디에 피해를 주는 선충으로 알려져 있는 종으로 우리나라에서는 새로이 잔디에 발생하는 선충으로 기록되는 종들이었다(Mwamula et al., 2020a; 2020b; 2020c).
Paratrichodorus minor는 우리나라에서 2008년 제주도에서 처음 보고되었는데(Park et al., 2008) 주로 식물의 뿌리 분열 조직을 파괴하여 생장을 억제하며 전 세계적으로 분포하고 다양한 기주 선호성을 가지고 있어서 여러 작물들의 생장을 저해한다(Christie and Perry, 1951; Walkinshaw et al., 1961). 나선선충인 Helicotylenchus microlobus는 미국의 미네소타주 토양에서 가장 일반적으로 관찰되는 나선선충 중 하나로 보고되고 있는데(Taylor, 1960) 이 종에 감염된 콩의 경우 뿌리에 작은 갈색 병변이 발견되었다(Yan et al., 2017). 이 외에도 2020년에 한국에서 발견된 침선충류인 Paralongidorus koreanensis (Mwamula et al., 2020a)와 환선충인 Mesocriconema curvatum은 본 연구의 토양 시료 채집지 분만 아니라 우리나라의 몇몇 골프장 잔디에서 발견되었다(Mwamula et al., 2020b). 이들 선충들은 모두 외부기생선충으로 잔디의 뿌리에 피해를 주는 종들로 우리나라에서는 이들 종들에 대한 방제 연구가 전혀 수행된 바 없다.
다양한 살선충제들이 우리나라의 식물기생선충 방제제로 등록되어 있으며 친환경 농자재로 등록된 선충 방제용 농자재도 상용화되고 있다. 또한 살선충제들 중에는 미생물 유래 물질을 이용한 방제제들도 개발되어 이용되고 있는데 방선균 유래 물질로부터 합성된 abamectin은 면화 종자에 처리 시 뿌리혹선충류의 증식 억제효과가 알려져 있고(Faske and Starr, 2006), Burkholderia rinojensis는 Burkholderia속 토양세균으로 단백질이나 지방을 분해하고 다양한 세포 외 효소를 분비하여 항생작용을 돕는 것으로 알려져 있는데 토양세균으로써 토양에 큰 해를 끼치지 않고, 낮은 잔류성으로 인해 친환경 생물학적 방제제로 사용되고 있다(Cordova-Kereylos et al., 2013).
Ozoneem oil은 neem나무 추출물인 azadirachtin이 주성분인 식물성 병해충 방제제로 neem은 살충, 살균, 살선충 등 광범위한 병해충 활성 효과가 있는 것으로 알려져 있다(Koul, 2004).
Fluopyram은 우리나라에서는 2012년 살균제로 등록되어 과채류에 발생하는 잿빛곰팡이병이나 흰가루병 등에 적용되다가 복합체 2의 숙신산 탈수소효소 저해제로서 살선충 효과가 추가로 검증되어 2016년부터 토양 혼화처리형 입제로 개발되어 뿌리혹선충류 방제에 사용되고 있다(Faske and Hurd, 2015; KCPA, 2020). Fluazaindolizine은 2017년 뿌리혹선충류에 살선충제로서의 효과가 검증되어 사용되어 오고 있는데 접촉독으로 인한 선충의 치사를 유도하며, 특히 작물의 생장에 유익한 진균이나 세균류와 선충 또는 자연발생하거나 인공적으로 도입한 생물학적 방제 물질들에 대해 혼용가능하여 농작물과 토양을 크게 오염시키지 않아 자연 친화적인 것으로 알려져 있다(Lahm et al., 2017). Hydrogen peroxide는 감귤선충인 Tylenchulus semipenetrans에 효과를 보였다(El-Saedy et al., 2019).
네 번의 실내 실험에서 실험 때마다 차이는 있었지만 hydrogen peroxide와 fluopyram, fosthiazate는 권장량 기준으로 비교 시 다른 실험 약제들에 비해 효과가 높은 살선충 활성을 보였다. 80% 이상의 살선충 활성을 보이는 농도는 실험 시 마다 변이가 있었지만 전체적으로 종합하면 hydrogen peroxide의 경우 12.5 ppm, fluopyram은 100 ppm, fosthiazate는 150 ppm 이상이었다. 또한 hydrogen peroxide와 fluopyram은 침지 처리 3시간 후에도 90%이상의 치사율을 보여 직접접촉 시 단시간에 높은 치사율을 보였다. 따라서 이러한 물질들은 단시간에 충분히 토양 내 선충에 접촉될 수 있는 조건이 형성되면 선충 방제 효과를 높일 수 있을 것으로 기대 되었다. 그러나 실내실험에서 높은 치사율을 보였던 hydrogen peroxide는 야외시험에서는 상대적으로 낮은 방제가를 보였다. 이는 과산화수소의 화학적 특성상 물과 산소가 만나 쉽게 분해되는 성질 때문인 것으로 유추되는데 실내 검정의 경우에는 실험에 사용된 12 multi well-plate의 뚜껑을 덮은 후 알루미늄호일로 감싸서 2중 차단을 하였지만 골프장은 노출된 공간으로 광분해나 지속적인 관수로 인해 물과 접촉이 잦아져 분해가 실내 조건보다 잘 이루어졌기 때문으로 생각된다. 반면 실내실험에서 상대적으로 효과가 낮았던 imicyafos는 골프장에 처리 시 방제가가 60일동안 안정적으로 유지되었으며 fluopyram은 실내 실험의 결과와 유사하게 골프장 처리 시에도 유의한 방제효과를 보였다. 따라서 처리 60일차까지 70-80%대의 방제가를 보인 fluopyram 과 imicyafos 두 약제는 추후 잔디기생선충의 살선충제로써 활용될 수 있는 가능성을 확인하였다.
골프장의 경우 지속적 관수가 이루어지고 특히 그린의 경우 토양층이 주로 모래로 조성되어 물 빠짐이 좋은 것을 고려할 때 약해가 발생하지 않는 고농도의 살선충제 처리 후 추가 관수처리를 통해 효과를 향상시킬 수 있는 방법도 고려해 봐야 할 것으로 생각된다.
요 약
잔디에는 다양한 식물기생선충들이 피해를 주고 있지만 우리나라의 경우 등록되어 있는 살선충제가 없다. 이에 본 연구는 골프장 잔디에 발생하는 식물기생선충에 대한 효과적인 살선충제를 알아보기 위하여 살선충제(abamectin, fluazaindolizine, fluopyram, fosthiazate, imicyafos)와 neem oil, 미생물 살선충제(Burkholderia rinojensis), 농업용 과산화수소수 제품을 이용하여 실내와 야외에서 실험을 수행하였다. 5종의 선충(Paratrichodorus minor, Helicotylenchus microlobus, Paralongidorus koreanensis, Mesocriconema curvatum, Tylenchorhynchus thermophilus)이 혼재하여 발생하는 서경타니골프장 토양시료와 두 종의 선충(H. microlobus, M. curvatum)이 혼재하는 스카이72 골프장 토양시료에서 분리한 선충들을 이용하여 실내 살선충 활성 검정 결과 과산화수소수와 fluopyram의 활성이 높았고, 이들 두 물질에 선충 침지 시 3시간에도 80% 이상의 치사율을 보였다. 켄터키블루그래스로 조성된 골프장 티에서 살선충물질(B. rinojensis, fluazaindolizine, fluopyram, imicyafos, 과산화수소수)들의 효과를 시험한 결과 imysiafos와 fluapyram의 효과가 처리 60일째까지 높게 나타나 이들 두 살선충제의 경우 골프장 선충 방제에 실용적 활용이 가능 할 것으로 사료된다.
주요어: 살선충제, 생물검정, 식물기생선충, 이미시아포스, 플루오피람
Acknowledgements
This research was conducted with the support of research funding for the ’Investigation of nematodes damage in turfgrass cultivation areas and landscaping areas and development of control methods' by the National Institute of Forest Science. We would like to thank the green keepers at Seokyung Tani country club and Sky 72 golf club who helped in the field investigation at the respective golf courses and we are grateful to Faisal Md. Kabir, Mun-gi Jeong, Yun-seok Cha, Hyun-guk Kim, In-ho Choi who assisted in executing both laboratory and field experiments.