서 언
생태계교란야생동식물(生態系攪亂野生動植物, ecosystem disturbance wild animals and plant)은 환경부에서 지정하여 관리하고 있는 토종 동식물의 생태계를 위협할 우려가 있는 동·식물을 말한다. 생태계교란 생물 지정은 ‘생물다양성 보전 및 이용에 관한 법률’ 제21조의2에 따라 생태계 등에 미치는 위해가 큰 생물을 생태계교란 생물로 정함을 목적으로 한다(KLIC, 2021). 그리고 환경부령으로 정하는 야생 동식물로써 외국으로부터 인위적 또는 자연적으로 유입되었거나 유전자의 변형을 통하여 생산된 유전자 변형 생물체 가운데 생태계의 균형에 교란을 가져오거나 가져올 우려가 있는 야생 동식물을 포함하고 있다.
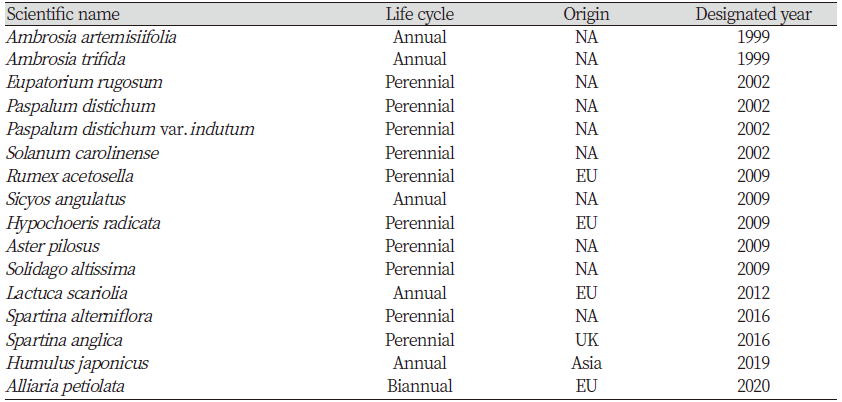
환경부 고시(제2020-285호, 2020. 12. 30)에 따라 2020년에 6종이 추가·지정되어 우리나라에는 총 30종의 생태계교란 생물이 있다. 동물(어류, 양서·파충류 포함)은 황소개구리(Rana catesbeiana), 갈색날개매미충(Pochazia shantungensis), 미국선녀벌레(Metcalfa pruinosa) 등 총 14종이다. 식물은 돼지풀(Ambrosia artemisiifolia)과 단풍잎돼지풀(Ambrosia trifida), 환삼덩굴(Humulus japonicus), 마늘냉이(Alliaria petiolata) 등 총 16종이다(Table 1).
생태계교란 생물인 돼지풀(속)에는 돼지풀, 단풍잎돼지풀, 둥근잎돼지풀이 있지만, 단풍잎돼지풀과 둥근잎돼지풀은 형태학적, 분자생물학적으로 차이가 없어 우리나라에는 돼지풀과 단풍잎돼지풀만 발생한다(Choi, 2005). 이 돼지풀(속)의 원산지는 북미지방이다. 돼지풀에 대한 지역별 발생, 생리·생태적 특성 및 관리방안에 대한 다양한 연구가 진행되었지만, 단풍잎돼지풀에 대한 연구는 미흡하다. 또 다른 생태계교란 생물 환삼덩굴은 자생잡초로 덩굴성으로 인해 서식지 식생변화 연구(Oh et al., 2008a; 2008b), 꽃가루에 대한 알레르기 유발 연구(Choi et al., 2020; Jung et al., 2017), 한약재로서의 이용연구(Ryu, 2017), 식품으로 이용 가능성(Hur et al., 2003) 등은 많으나, 발생생태와 방제연구(Lee et al., 2008)는 다소 미흡하다.
돼지풀(속)과 환삼덩굴은 도로변, 밭 주변 및 하천변의 양지쪽에 주로 서식하는 일년생 초본이다. 이들 잡초는 빠르게 생장하며 주변 식생들을 뒤덮어 타 생물종의 성장을 억제하고 단일 식생군락을 형성하는 등 국내 생물다양성을 저해한다. 또한, 다량의 꽃가루를 날려 알레르기(花粉病[화분병], pollinosis, hay fever)를 유발하는 등 인체에도 악영향을 미쳐 꽃이 피기 전에 신속한 제거가 필요하다. 화분병은 꽃가루가 코의 점막을 자극하여 눈물, 콧물, 가려움증을 일으키며, 심한 경우 잦은 재채기뿐만 아니라 기침, 구토를 유발하기도 한다. 꽃가루가 날리는 봄, 가을이 되면 비염, 천식 등 호흡기 환자에게 고통을 준다.
따라서 생물다양성을 저해시키고 꽃가루를 날려 인체에 화분병을 유발시키는 외래잡초인 돼지풀과 단풍잎돼지풀, 그리고 자생잡초인 환삼덩굴의 발생생태 및 관리방안을 여러 문헌의 리뷰를 통해 모색하고 최적의 확산대책을 마련하고자 한다.
돼지풀(Ambrosia artemisiifolia, common ragweed)의 생태와 관리
형태와 분포
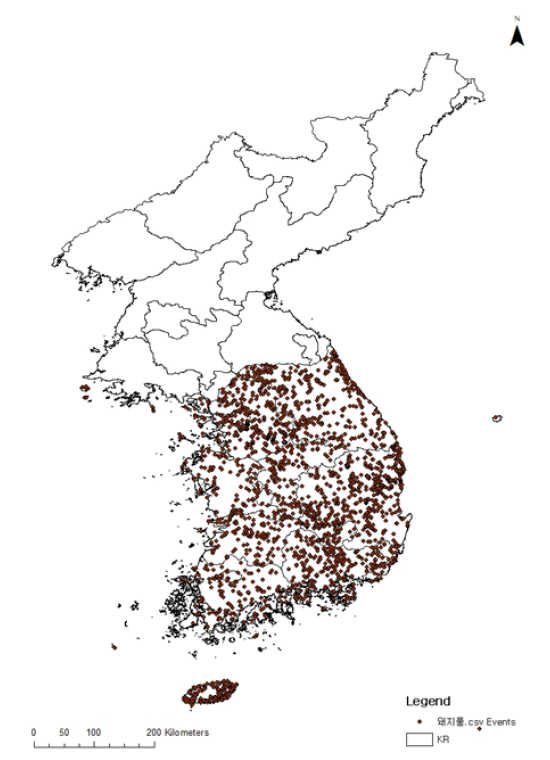
돼지풀은 일년생으로 줄기는 높이 30-180 cm, 직립하며 원추상으로 가지를 치고 식물체 전체에 부드러운 털이 있다. 위쪽의 잎은 어긋나기(互生[호생], growing in alternation)이며, 잎자루가 없고 잎이 깃털처럼 심하게 갈라진 모양(羽狀深裂[우상심열], pinnatipartite)을 한다. 아래쪽 잎은 마주나기(對生[대생], dichotomy)이고 짧은 잎자루가 있으며, 2번 우상심열하고 암록색, 앞면은 털이 없고 뒷면은 회록색으로 부드러운 털이 매우 빽빽하게 퍼져 있다. 꽃은 8-9월에 피며, 암꽃과 수꽃이 한 그루에서 피는 자웅동주(雌雄同株, monoecism)이다. 북아메리카 원산으로 유럽, 아시아 등에 널리 귀화되었고(Kim and Park, 2009b), 우리나라에서는 6.25전쟁 당시 유입되었으나 국내에 처음 알려진 것은 1968년으로 현재는 강원 및 전라 지역을 제외한 전국에 고르게 분포하고 있다(Kim et al., 2017; Fig. 1). 유럽에서도 돼지풀이 문제인데, 19세기에 북미에서 종자가 들어왔으나, 2차 세계대전이 진행되는 동안 온난한 기후대에서 확산되었다. 지금은 농업잡초로의 습성을 가지고 있다(Essl et al., 2015; EUPHRESCO, 2010).
생태적 위협
돼지풀이 밭이나 들, 도로변 등에서 최대 1 m2당 500여 개체가 한꺼번에 밀집하여 자라면서 자생식물의 생육을 방해하여 자연생태계에 위협이 되고 있다. 또 돼지풀이 꽃을 피울 때 노란 꽃가루가 날려 사람에게 꽃가루 알레르기를 유발시키기 때문에 인간에게도 피해를 주고 있다(Kim and Park, 2009b).
생리·생태적 특성
돼지풀은 종자로 번식하는 일년생잡초이다. 1주당 생산하는 종자는 평균 3,000립으로 갓 채취한 종자는 휴면상태로 놓여 있어 발아에 앞서 일정기간의 후숙기간이 요구된다. 발아에는 온도가 중요한 요인으로 작용한다. 온도조건이 맞지 않으면 휴면상태를 40년 이상 지속된다. 종자의 발아는 10-40℃ 범위의 항온보다는 10/30℃의 변온이 좋다. 종자의 발아율은 명조건(明條件, light condition)에서 높다. 돼지풀 종자를 수확 4주 후 4℃ 페트리디시에서는 69%이었으나, 15주 후에는 89%이었고, 수확 후 20/30℃ 광조건에서 2개월 후에 온전한 상태의 종자는 7% 발아되었으나, 껍질을 제거하면 55% 발아하였다(Buhler and Hoffman, 1999). Jeong et al. (2019)은 우리나라 충주와 김제에서 채집한 돼지풀 종자를 대상으로 온도조건별 발아시험에서도 유사한 결과를 얻었다. 즉 돼지풀은 온도가 상승함에 따라 발아율이 증가하였으며, 10/15℃의 변온조건에서도 35%의 발아율을 보였다고 하였다. 발생심도는 2.5-15.5 cm로 다양하다(Kim and Park, 2009b). Seo et al. (2019)는 식물생장상에서 돼지풀의 생육상황을 확인한 결과, 20/15℃에서 돼지풀은 1일 평균 초장은 0.29 cm, 엽수는 0.52엽씩 생장하고, 25/20℃에서는 각각 0.43 cm 및 0.72엽씩 생장하는 것을 확인하였다. 이런 결과는 돼지풀의 물리적 방제시기 설정에 도움이 될 것이다.
돼지풀의 꽃가루 분산 거리와 방향성을 조사한 결과(Kang, 2009)에 따르면 돼지풀이 자라고 있는 곳에서 사방 5 m 이내에 꽃가루가 가장 많이 분산되거나 흩어지며 꽃가루가 많이 날리는 시간은 오전 10시부터 오후 5시까지이었다. 수꽃은 하루에도 주당(株當) 약 1백만 입자(粒子)에 이르는 미세한 황색의 화분을 발산한다고 한다(Kim and Park, 2009b). 알레르기를 유발하는 돼지풀의 화분 크기(pollen size)는 20-22 μm로 발아구(aperture)는 공형(porate)과 구형(colpate)이 같이 있는 공구형(colporate)으로 3개이다. 화분의 표면은 작은 바늘모양의 돌기들이 있다(NIMS, 2021).
관리 및 방제기술
경종적 방제: 겨울밀 재배지에 red clover (Trifolium pretense)를 피복식물(cover crop)로 재배하면 돼지풀의 바이오매스(biomass)를 감소시킨다(Mutch et al., 2003). 그러나 우리나라에서는 사료용 옥수수밭이나 도로변 등에 발생하여 이런 방법은 적용하기는 어렵다.
물리적 방제: 물리적 방제에는 뿌리째 뽑거나 자르거나 중경이나 경운하는 방법이 있다. 돼지풀을 뿌리째 뽑을 경우에는 종자가 맺히기 전에 실시하는 것이 중요하고, 해바라기밭과 옥수수밭에 발생한 돼지풀은 2엽기 때 괭이질을 하면 효과적이며, 이런 괭이질은 땅이 마르고 채소와 같이 재배되는 면적이 좁을 경우에 유효하다고 하였다(EUPHRESCO, 2010). 그리고 줄기를 자르는 것은 넓은 면적에 발생하는 돼지풀을 제거하여 종자 생산을 방지하는데 좋은데, 제초제를 사용하기 어려운 곳에서 유효하다고 하였다. 절단은 땅 표면과 가까운 2-6 cm 높이가 적당하며, 절단시기로 꽃피고 종자가 맺히기 전에 해야 한다(Vincent et al., 1992). 또 경운을 통해 돼지풀 종자를 10 cm 정도 매몰하면 발아를 억제할 수 있고, 멀칭도 돼지풀 종자 발아억제에 효과적이라고 보고하였다(EUPHRESCO, 2010). 기계적인 절단은 돼지풀의 종자 생산을 74%까지 줄일 수 있으나 절단시기가 중요하다고 하였다(Guan et al., 1991).
화학적 방제: 돼지풀에 대한 화학적 방제는 미국이나 유럽에서 대규모로 재배하는 작물을 대상으로 한 연구결과가 대부분이었다. 그만큼 미국과 유럽에서 돼지풀에 대한 문제가 심각하다는 것을 암시하고 있다. 돼지풀 제거에는 2,4-D, MCP, mecoprop, dicamba 등이 효과적인데 6-8월에 살포하는 것이 좋다(Bassett and Crompton, 1975). 그리고 우리나라에는 사용하지 않는 diphenyl ether계 제초제인 lactofen, fomesafen, acifluorfen (Nelson and Renner, 1998; Zhan et al., 1993), chlorimuron (Moseley and Hagood, 1991)은 콩밭에 발생한 돼지풀을 발아 후 처리로 방제하였다. 또 flumioxazin과 chlorimuron+metribuzin을 콩이 발아하기 전에 살포하여 돼지풀을 방제하였으며, glufosinate-resistant 콩에는 glufosinate 단독처리만으로 돼지풀을 85%이상 방제하였다고 보고하였다(Beyers et al., 2002). 옥수수밭에서 돼지풀 방제에 atrazine (Culpepper and York, 1999), diflufenzopyr+dicamba (Sikkema et al., 1999), atrazine+bromoxynil (Wiese et al., 1986), atrazine+bentazone (Hamill and Zhang, 1997)이 이용되었다. 땅콩밭의 돼지풀은 imazapic을 살포한 후 bentazone+paraquat를 처리하거나(Richburg et al., 1996), 땅콩 심기 전에 acifluorfen+bentazone (Wilcut, 1991; York et al., 1995) 처리하면 방제된다고 하였다. 유럽에서는 지난 50년동안 농업지대에서 돼지풀을 방제하기 위하여 2,4-D와 같은 제초제가 널리 사용되어 왔다. 주요 작물 재배에는 돼지풀을 방제하기 위하여 발아 전 또는 발아 후 제초제를 사용하였으나, 소면적 재배작물(예, 오일 호박[oil-pumpkin], 채소류, 다양한 콩과 작물)에서는 적용할 수 있는 효과적인 제초제는 없었다고 하였다(Gauvrit and Chauvel, 2010). 그리고 red thyme (Thymus vulgaris), summer savory (Satureja hortensis), cinnamon (Cinnamomum zeylanicum), clove (Syzygium aromaticum)에서 얻은 essential oils (1%, v/v)을 돼지풀 줄기에 실험실과 온실에서 처리한 방제효과는 완벽했다(Tworkoski, 2002). 이 에센스 오일은 유기농업에서 돼지풀 방제에 천연 제초제로 유용할 수 있다.
농경지에서 돼지풀 방제를 위한 제초제 의존은 제초제 내성 생태형의 발달로 이어졌다. 일반 돼지풀의 제초제 내성 개체군은 1970년대 중반 이후 캐나다와 미국의 다양한 작물에서 발견되었다. 제초제 저항성 돼지풀은 미국에서는 옥수수밭에서 atrazine에 대해(Stephenson et al., 1990), 캐나다에서는 당근밭에서 linuron (Saint-Louis et al., 2005)에서 관찰되었다. 미국에서는 돼지풀 방제에 이용되는 glyphosate를 10회 사용하면 저항성이 발견되므로 작용기작이 다른 제초제를 교호살포하여야 한다고 하였다(EUPHRESCO, 2010). 지난 20년 동안 ALS (acetolactate synthase) 억제제와 glyphosate에 대한 돼지풀의 저항성 사례가 미국에서 많이 관찰되었다(Brewer and Oliver, 2009; Patzoldt et al., 2001; Taylor et al., 2002).
우리나라에서 돼지풀 방제를 위해서는 토양처리제 보다는 비선택성 경엽처리제로 방제할 수 있다. 즉 돼지풀이 도로변이나 비농경지 등에 발생하기 때문에 glyphosate, glufosinate, tiafenacil 등의 비선택성 제초제 살포하면 방제할 수 있을 것이다. 그러나 제초제 살포에 따른 주변 농작물 약해발생 우려 및 환경단체의 반발 등의 부정적인 시각으로 사용에 제약이 따르는 것은 사실이다.
생물적 방제: 돼지풀에 대한 생물적 방제 연구는 전세계에서 다각적으로 진행되고 있다. 구 소련에서 생물적 방제로 몇 종의 나방과 딱정벌레가 이용되었다고 한다(Parsons and Cuthbertson, 1992). 유럽에서 돼지풀에 대한 생물적 방제에 효과적인 연구는 현재까지 없으나, 전통적인 생물적인 방제는 러시아, 우크라이나, 전 유고슬라비아에서 시도된 적이 있었다.
가장 효과가 우수했던 생물적 방제 매개체인 Zygogramma suturalis (Coleoptera, Chrysomelidae, ambrosia striped leaf beetle)은 다른 식물에 비해 돼지풀을 선호하여, 돼지풀의 잎을 50-70% 갈아 먹는다(CABI, 2021a)고 한다. 1978년에 러시아, 1984년에는 유고연방, 1985년에는 크로아티아를 포함하여 북미의 여러 나라들이 Z. suturalis을 도입하였고, 1997년과 1988년에 캐나다와 러시아에서 중국으로 도입되었지만, 낮은 군집 형성과 이동성이 좋지 않아 그다지 성공적인 결과를 얻지 못했다(CABI, 2021a)고 하였다. 돼지풀은 Ophraella communa (ragweed leaf beetle)의 기주로도 알려졌다. O. communa은 1996년에 일본과 대만에 도입되었으며, 그 후 스위스 남부와 이탈리아 북부의 알프스 남쪽에서 발견되었다는 보고(CABI, 2021a) 도 있다. 돼지풀의 생물적 방제에 사용 가능한 병원균으로서는 Epiblema strenuana, Pseudomonas syringae pv. tagetis, Protomyces gravidus, Phyllachora ambrosiae, Septoria epambrosiae 등이 보고(CABI, 2021a)되고 있다.
돼지풀의 생물적 방제는 발생이 심하고 인축에 많은 피해를 주고 있는 미국과 유럽을 중심으로 활발하게 진행되어 왔다. 국내에는 돼지풀의 생물적 방제를 위해 별도의 연구과제가 수행되고 있지 않은 것은 그 발생면적이 좁고 인축에 대한 피해를 피해로 실감하기 않았기 때문으로 사료된다.
돼지풀 확산 방지를 위한 종합방제 모형
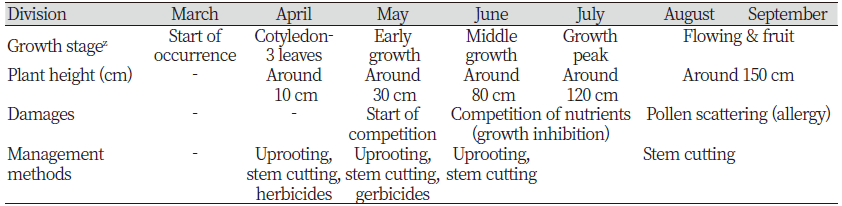
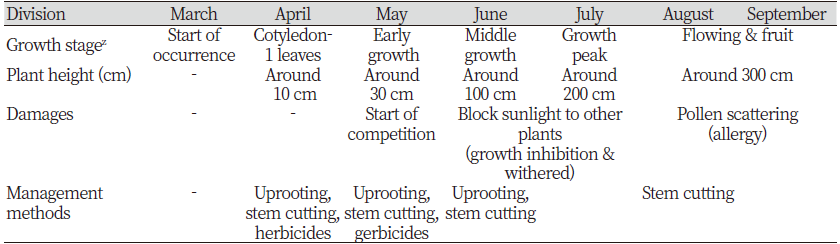
우리나라에서 돼지풀은 사료용 옥수수밭, 도로변, 제방, 비농경지 등에 많이 발생한다. 사료용 옥수수밭에서는 제초제 선택성을 이용하여 dicamba와 같은 광엽잡초방제용 제초제 살포로 확산을 방지할 수 있다. 그러나 도로변, 제방, 비농경지에 발생하는 돼지풀에는 이들 광엽잡초 방제용 제초제 적용이 곤란하다. 주변식생에 약해가 유발되기 때문이다. 따라서 도로변이나 제방에는 발생초기인 4월과 5월에 뿌리뽑기와 경우에 따라서는 줄기절단 방법이 유효하다(Table 2). 돼지풀의 초장은 150 cm 내외이므로 꽃이 피기 전(7월까지)에 예초기 등을 이용하여 줄기를 절단하는 것이 좋다. 줄기 절단과정에서 종자가 떨어져 확산을 조장할 수는 있으나 그냥 둠으로써 경관을 해치고 비바람 등에 의해 종자가 떨어질 것이므로 그다지 문제는 안된다. 또 비선택성 제초제를 사용하여 방제할 수 있으나 도로변이나 제방까지 제초제를 살포할 경우 환경에 미치는 영향도 고려하여야 하고 생활주변인들을 의식해야 하며 또 환경단체의 반발 등으로 곤란을 겪을 수 있어 여러 상황을 고려하여야 한다.
단풍잎돼지풀(Ambrosia trifida, giant ragweed)의 생태와 관리
형태와 분포
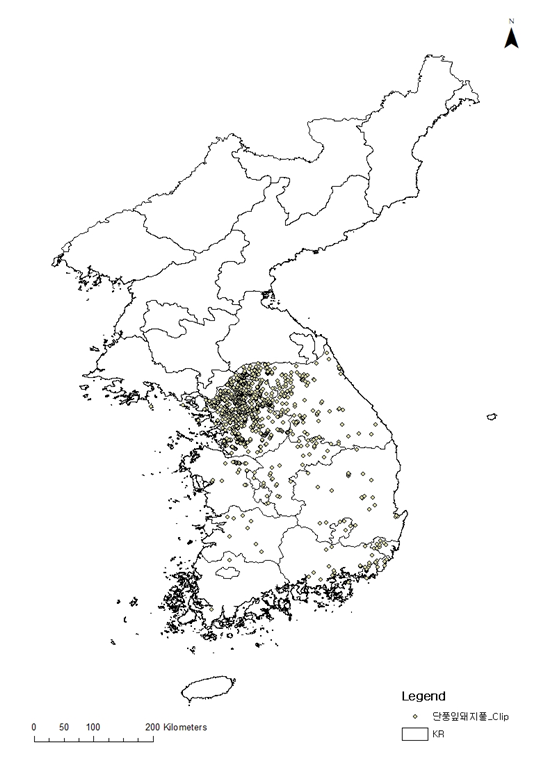
단풍잎돼지풀은 종자로 번식하는 일년생잡초이다. 줄기는 곧추서고 높이는 3 m, 많은 가지를 치며, 거친 털이 있다. 잎은 마주나기(대생, 對生, dichotomy)이며, 긴 잎자루가 있다. 잎 모양은 계란형으로 길이와 폭이 20-30 cm에 이르며, 3-5군데 찢어졌다. 7-9월에 꽃이 피며, 이 때 발생한 꽃가루가 알레르기를 유발한다. 열매는 둥근 모양(난형, 卵形, egg shape)이며, 길이 6-12 mm, 폭 4-5 mm, 5-7개의 능선(稜線, ridge)이 있고 각 능선의 끝에 작은 혹이 붙는다(Kim and Park, 2009b). 북아메리카가 원산지인 단풍잎돼지풀은 우리나라에서는 경기 파주, 의정부 등 임진강 주변에서 발생하다 종자가 강물과 같이 확산됨에 따라 전국의 강가, 휴경지 등에서 생육하고 있다(KIAS, 2016; Fig. 2). Choi et al. (2007) 보고에 의하면 강원 북서부지역인 철원, 화천, 양구, 춘천 도로변에 발생되어 예방적 관리가 시급하다고 하였다. Kim and Park (2009b)에 의하면, 둥근잎돼지풀(A. trifida f. integrifolia [Muhl.] Fernald) 서울과 춘천에서 자라고 있다고는 하나, 거의 유사한 종으로 보고되고 있다.
생태적 위협
일년생임에도 불구하고 지하경을 뻗어 다른 식물이 생육하는 것을 방해하고, 1년에 3 m 이상 자라면서 많은 가지를 치기 때문에 다른 식물에 광합성을 하지 못하게 하여 발생 및 성장에 영향을 주어 종 다양성을 단순하게 만든다. 또 7-8월 개화할 때 날리는 꽃가루는 화분병을 유발시킨다(Kim and Park, 2009b).
생리·생태적 특성
단풍잎돼지풀의 종자는 휴면성이 있으며, 겨울동안 흙 속에 묻어두면 휴면에서 깨어난다. 발아에는 20/30℃의 변온이 유효하며, 발아심도는 2 cm이나 일부는 16 cm 깊이에서도 발아한다. 흙 속에서 종자의 수명은 21년에 이르기도 한다(Kim and Park, 2009b). 휴면종자는 5℃ 건조조건에서 3개월 동안 후숙(後熟, after-ripening)하면 제거되었다(Buhler and Hoffman, 1999).
관리 및 방제기술
물리적 방제: 단풍잎돼지풀은 발생초기 유묘기 때 손으로 뽑으면 효과적이다. 그리고 반복적으로 깎아도 종자 생산을 줄일 수는 있으나 제거되지는 않는다. 단풍잎돼지풀에 전기적 충격을 가하면 효과적으로 방제된다(Rasmusson et al., 1980). 단풍잎돼지풀의 생육 왕성기인 8월 상순-하순에 지표면으로부터 25 cm 이하의 높이로 줄기를 절단하면 재생이 되지 않아 확산을 줄일 수 있다(Oh, 2006). 우리나라에서 단풍잎돼지풀은 경기 북부지역 사료용 옥수수밭이나 율무밭, 도로변에 많이 발생하고 있어 적절한 시기에 예초기를 이용하여 줄기를 절단하는 방법이 적용 가능할 것이다.
화학적 방제: 사료용 옥수수밭에 발생하는 단풍잎돼지풀 발생을 억제하기 위하여 토양처리제인 linurion, alachlor, S-metolachlor, pendimethalin을 처리하였지만, 50% 내외의 낮은 방제효과를 보였다(Yoo et al., 2008). 그러나 미국잡초학회에서 조사한 바에 의하면, 발아전처리제인 atrazine, chlorimuron, imazaquin이 단풍잎돼지풀 방제에 효과적이라고 하여( University, 2020), 대상약제는 다르지만 우리나라와 상반된 결과를 보였다. 발아후처리제(경엽처리제)는 acifluorfen, bentazone, dicamba, glyphosate, imazethapyr, 2,4-D가 추천되었다. Glyphosate는 초장이 6인치 이상(15 cm 내외) 된 단풍잎돼지풀을 방제할 수 있으며, 2,4-D와 glyphosate를 혼용하여도 단풍잎돼지풀을 방제할 수 있다( University, 2020). 제초제 저항성 단풍잎돼지풀 개체군은 1998년에 처음 확인되었다( 2021). 그리고 미국 중서부의 많은 지역에서 분지 아미노산 생합성 저해제(ALS 억제제) 및 방향족 아미노산 생합성 저해제인 glyphosate에 저항성을 보이는 개체군이 존재하지만 아직 공식적으로 발표되지는 않았다. 제초제 저항성 개체군이 생각보다 더 널리 퍼져 있다는 우려때문에 미네소타와 같은 많은 주에서는 제초제 내성에 대한 단풍잎돼지풀의 무료 스크리닝을 추진하고 있다( 2020)고 하였다. 제초제 저항성 단풍잎돼지풀 개체군도 옥시작용 저해제인 2,4-D 등 및 글루타민 합성효소 저해제인 glufosinate을 사용하면 효과적으로 방제된다고 하였다( University, 2020). 우리나라에서도 glyphosate, glufosinate 등과 같은 비선택성 경엽처리제 살포로 단풍잎돼지풀을 방제할 수 있다. 아직 국내에서는 이들 비선택성 제초제에 대한 저항성은 보고된 바는 없다. 그러나 향후 비선택성 제초제에 대한 저항성을 조기에 확인하고 확산방지를 위한 연구추진이 필요하다.
생물학적 방제: 단풍잎돼지풀에 대한 생물적 방제 인자에 대한 연구는 1967년 미국 캘리포니아에서 시작되었다(Goeden, 1978). Euaresta bella과 E. festiva는 1976년부터 러시아에서 방출했으나(Batra, 1979) 관련 연구성과는 현재 알려진 것이 없다고 하였다(Julien and Griffiths, 1998). 우리나라에서는 돼지풀잎벌레(Ophraella communa)를 이용한 단풍잎돼지풀의 생물학적 방제연구는 진행되었으나(Lee et al., 2007; Lee and You, 2018), 실용적인 결과는 얻지 못했다.
단풍잎돼지풀 확산방지를 위한 종합방제 모형
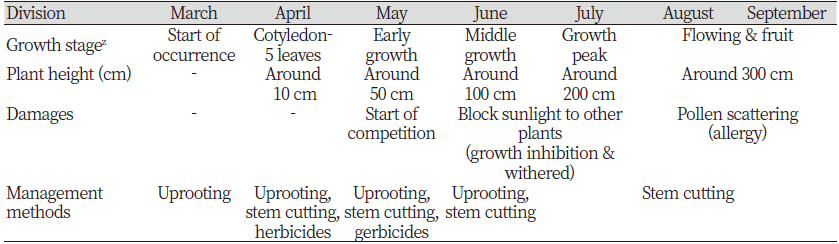
단풍잎돼지풀은 경기 북부의 율무밭, 과수원, 도로변, 하천변에 많이 발생하고 있다. 이 단풍잎돼지풀의 종자는 종피가 두꺼워서 토양처리제에 대한 효과가 저조하다. 그러므로 발생초기인 4월경에는 뿌리뽑기나 줄기를 절단하는 방법이 유효하다(Table 3). 율무밭에 발생한 단풍잎돼지풀은 생육초기(초장 30 cm 내외)에 광엽잡초 방제용 제초제 살포가 가능하나, 적용여부를 확인하여야 한다. 도로변에서는 5월 중·하순경에 단풍잎돼지풀이 30 cm 내외일 때 비선택성 경엽처리제를 처리하여 방제한다. 그러나 단풍잎돼지풀의 초장이 커서 주변작물에 비산에서 약해가 발생될 수 있으므로, 이때는 줄기를 절단하는 물리적 방제방법도 고려하여야 한다. 6월부터 단풍잎돼지풀이 급격히 신장하여 초장이 100 cm 내외이기 때문에 주변식물에 햇빛을 차단하여 생육억제 및 고사를 유발하므로 예초기를 이용하여 줄기를 절단하는 것이 확산방지를 위해 효과적이다.
환삼덩굴(Humulus japonicus, Japanese Hop)의 생태와 관리
형태와 분포
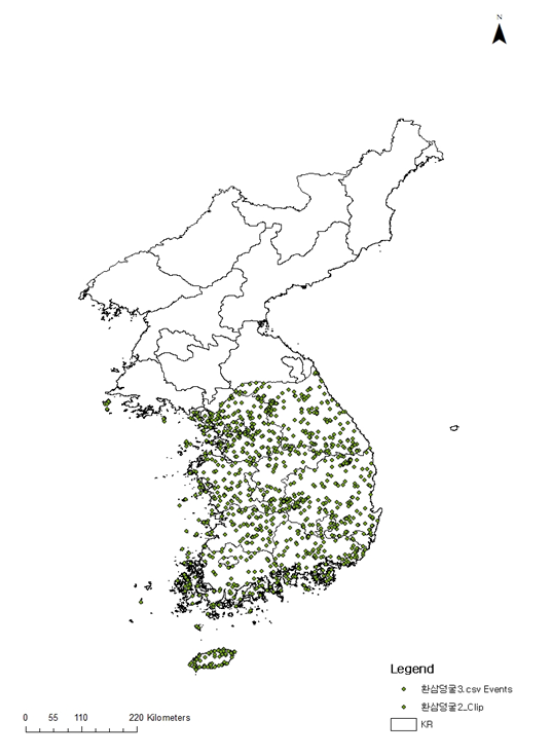
환삼덩굴속 식물은 북반구에 3종이 있으며 국내에는 2종이 있다(Kim and Park, 2009a). 환삼덩굴은 덩굴성 일년생으로 꽃은 암수딴그루(자웅이주[雌雄異株], dioecism)이며, 수꽃 이삭은 원추화서, 암꽃은 짧은 수상화서가 달리며, 8-9월에 개화한다. 전국 각처의 들, 빈터, 개천가 등에 집단으로 군생하며 길가의 축대, 아파트, 담장 밑 등 도시 및 근교 가릴 것 없이 도처에서 흔히 발견되는 생명력이 강한 잡초이다(Fig. 3). 서울에는 한강의 지천인 양재천, 중랑천, 안양천, 탄천 그리고 여의도와 난지도의 한강변에 집단으로 군락을 이루어 자생한다(NIMS, 2021). 미국 및 유럽 등지에서는 분포가 그리 많지 않아 화분증의 중요한 식물로 인식되지는 않으나 우리나라에서는 광범위한 분포지역 빠른 성장 및 강한 생명력 등을 고려할 때 돼지풀, 쑥, 명아주 등과 함께 가을철의 주요한 강한 알레르기 화분증의 원인으로 알레르기 발병률이 높아져 가고 있는 식물이다(NIMS, 2021). 환삼덩굴은 네모난 원줄기와 잎자루(엽병[(葉柄), leafstalk)에 밑을 향한 잔가시가 있어 거치며, 오른쪽 감기를 한다. 잎은 긴 잎자루에 잔가시가 많고 마주나기(대생[對生], dichotomy)하며, 잎은 손바닥 모양(장상[掌狀], palmated)으로 5-7개로 갈라져 있고 길이와 나비가 각각 5-12 cm이다(Kim and Park, 2009a).
생태적 위협
환삼덩굴은 넓은 땅이나 밑바닥 관목과 작은 나무를 포함한 낮은 초목을 덮을 수 있다. 이 잡초의 덩굴은 여름에 빠르게 자라며 생육 중에 있는 모든 것 위로 올라가며 수 cm 깊이의 밀도가 높은 매트를 형성하여 아래에 있는 식물에 빛을 차단하여, 관목과 나무 주위를 꼬아서 부서지거나 넘어지게 한다. 또 강변 및 범람원 서식지에 침입하여 토착 식물을 대체하고 새로운 식물의 출현을 방지하며 하천가 서식지 복원을 위해 설치된 새로 심은 나무를 죽인다(NPS, 2021). 환삼덩굴 서식지에서는 종다양성 지수와 균등도 지수는 상층식생이 높고 하층식생이 낮아 종양성에 영향을 미쳐 식물 서식지를 단순화시킨다고 하였다(Oh et al., 2008b).
생리·생태적 특성
환삼덩굴은 저온에서도 발아하는 잡초로 최초 출아 유효적산온도는 56.7℃이며, 최대 출아율 50%에 도달하는데 필요한 유효적산온도는 76.3℃이다. 최초 출아에 필요한 유효적산온도 56.7℃에 도달하는 시기는 대구가 3월 21일, 서울이 4월 1일이었다(Song et al., 2010). 환삼덩굴 종자의 생명은 대략 3년으로 처음 2년 동안은 이 잡초를 방제하는 시간이 많이 걸리나 그 이후로 급격하게 그 수가 감소한다(BUGWOODWiKi, 2021).
관리 및 방제기술
물리적 방제: 물리적으로 환삼덩굴은 종자가 맺히기 전(꽃 피는 시기는 8-9월)에 뿌리 채 뽑는 것이 좋다고 여러 문헌에서 언급하고 있다(BUGWOODWiKi, 2021; CABI, 2021b). 한편 차광막 2겹, 부직포, 검정비닐과 같은 것으로 땅을 피복함으로써 환삼덩굴을 100% 발생을 억제하였다(Lee et al., 2008).
화학적 방제: 비농경지에서 토양처리 제초제 중 simazine WP, dichlobenil+imazaquin GR 처리가 환삼덩굴에 대해 90-100%의 방제효과를 보였다. 특히 dichlobenil+imazaquin GR은 환삼덩굴의 초장이 150 cm 내외일 때 처리하여도 방제가 가능하였다(Lee et al., 2008). 비선택성 경엽처리제인 glyphosate를 처리하면 효과적으로 방제할 수 있다. 특히 연년생으로 자랄 경우에는 탄수화물이 축적되는 7-8월에 glyphosate를 적용하는 것이 좋다(BUGWOODWiKi, 2021; CABI, 2021b). 환삼덩굴은 비선택성 경엽처리제로 쉽게 방제할 수 있다. 그러나 덩굴성으로 다른 식물을 감고 올라가는 성질 때문에 환삼덩굴에만 경엽처리용 제초제를 살포할 수 없다. 따라서 토양처리제를 살포하는 것이 효과적이나, 제방이나 도로변 등에 환삼덩굴 발생 예방을 위해 미리 토양처리제를 살포하는 것은 비효율적일 수 있고, 환경에 대한 부담이 크다.
생물학적 방제: 환삼덩굴에는 곰팡이인 Pseudocercospora humuli, 곤충으로는 Epirrhoe sepergressa와 Chytonix segregata가 생물학적 방제 가능성이 있으나 기주범위가 좁다(CABI, 2021b). 우리나라에서 환삼덩굴을 생물학적으로 방제하는 연구는 진행된 적이 없다.
환삼덩굴 확산방지를 위한 종합방제 모형
환삼덩굴은 저온에서도 발아하는 잡초로 일반적으로 3월 중하순이면 발생하기 시작한다. 이들 환삼덩굴은 농경지 안에 발생하기 보다는 농경지 주변 식생의 밑에서 발생하여 5월 상순부터 덩굴을 형성하여 다른 식물을 덮기 시작한다. 그러므로 발생초기부터 뿌리뽑기를 시작하는 것이 확산방지를 위한 최선의 방책이 될 수 있다(Table 4). 덩굴이 다른 식생 위에 올라가면 덩굴을 걷어내는 것보다는 낫 등으로 뿌리부분 줄기를 절단하는 것이 좋다. 이런 방법은 개화(7-8월)하기 전까지 실시하여야 한다. 그러나 7월이 되면 날씨가 덥고 식생이 우거져서 줄기를 절단하는 방법은 쉽지 않다. 그렇다고 다른 식생위에서 자라고 있는 환삼덩굴 방제를 위해 비선택성 제초제를 살포하는 것은 약해 우려 때문에 바람직하지 않을 수 있다.
관리를 위한 종합적 제언
환경부에서 지정한 생태계교란야생식물 16종 중 꽃가루를 날려 사람에게는 화분병을 유발시키고, 환경에는 단일종 우점으로 인한 생물다양성을 저해시키는 돼지풀, 단풍잎돼지풀, 환삼덩굴은 우리나라에서는 대부분 도로변이나 하천변과 같은 비농경지에서 발생하고 있어 어떤 한 가지 관리방안으로는 확산을 막을 수는 없다. 유럽이나 미국에서는 옥수수밭, 콩밭, 밀밭 등에 발생하여 제초제를 이용한 화학적 방제방안이 제시되었으나(Bassett and Crompton, 1975; Gauvrit and Chauvel, 2010). 우리나라에서는 발생하는 장소가 달라 실제 적용하기는 어렵다. 또 사용 가능한 토양처리용 제초제나 선택적으로 이용될 경엽처리제 종류가 적었다. 그리고 많이 사용된 비선택성 제초제는 주로 glyphosate이었다. 그러나 미국에서는 glyphosate를 연용할 경우 저항성잡초가 유발되어 또 다른 문제가 될 수도 있다고 하였다(Brewer and Oliver, 2009; Patzoldt et al., 2001; PUR University, 2020; Taylor et al., 2002). 그러나 생태계교란야생식물의 확산을 가장 빠르게 효과적으로 막을 수 있는 방안은 제초제를 이용하는 것이다. 따라서 사람이 접근하기 쉬운 도로변에서는 예초, 손제초와 같은 물리적 방제법을 도입하고 쉽게 접근할 수 없는 곳은 한시적이지만 제초제 사용을 허가하는 방안도 고려해 볼 수 있다. 우리나라에서는 하천법 33조 1항에 근거하여 국가가 관리하는 하천에서는 농약사용을 위한 농작물을 재배를 금지하고 있어 여러가지 문제점에 봉착될 수 있다. 그리고 천적이나 병원미생물을 이용한 생물적 방제를 실시하는 방안도 고려해야 하나 뚜렷하게 효과를 보이는 생물적 방제방안이 없는 것이 안타깝다. 따라서 생태계교란야생식물 확산을 막기 위해서는 물리적 방제와 한시적이지만 제초제 사용을 통한 빠른 확산을 저지하고, 생물적 방제방안을 찾는 등 종합적인 관리방안이 실천되었으면 한다. 여기에 생태계교란야생식물의 확산을 저지하기 위해 대국민 홍보도 중요할 것으로 사료된다. 대상 식물종에 대한 정보를 관련기관에 제공하고 가능한 생장 초기에 제거하는 것이 효과적이므로 체계적인 방제방법을 적극 안내 교육할 필요가 있다.
요 약
생태계교란야생식물 16종 중 꽃가루를 날려 인축에 피해를 주는 잡초는 돼지풀, 단풍잎돼지풀, 환삼덩굴 3종이다. 이들 3종에 대한 분포, 발생생태, 생태계 위협과 관리방법을 확인하였다. 이들 잡초는 전국의 모든 곳에서 발생하며, 거의 비농경지에 발생하기 때문에 경종적인 관리방안을 제시할 수는 없었다. 물리적인 관리방안으로는 뿌리채 뽑는 것과 생육 중 줄기 절단방법 등이 우선적이었다. 제초제를 사용하는 화학적 관리방안은 다양하였다. 이들 3종은 토양처리제보다는 비선택성 제초제인 glyphosate를 처리하거나, glyphosate와 2,4-D 또는 glyphosat와 dicamba를 혼용살포하는 방법이 추천되었다. 그러나 glyphosate 연용으로 저항성 잡초를 발생시키거나 주변의 비표적식물에게 피해를 줄 수 있는 등 또 다른 생태적 문제를 유발할 수 있으므로 가급적 비선택성 제초제 보다는 옥신계 등 비표적 식물에 미치는 영향이 적은 제초제 사용을 추천한다. 특히 제초제에만 의존하기 보다는 생육초기에 물리적방법을 적극 결합한 종합적관리 방안이 다각도로 모색되어 추진되어야 할 것으로 사료되며, 환경에 보다 안전한 생물학적 방법에 대한 지속적인 연구가 필요하다.
주요어: 단풍잎돼지풀, 돼지풀, 생태계교란야생식물, 환삼덩굴