서 언
신규 작용점을 갖는 새로운 제초제를 개발하는 방법 중 하나인 천연물로부터 모화합물 또는 살초활성물질을 개발하는 연구는 현재까지도 가장 활발하게 이루어지고 있다. 대표적인 예시로는 aspartate amino transferase 저해제인 cornexistin (Nakajima et al., 1991), glutamine synthetase 저해제인 phosphinothricin (Lydon and Duke, 1999), sorgoleone (Rimando et al., 1998), artemisinin (Tallez et al., 1999), cineole (Romagni et al., 2000), leptospermone (Mitchell et al., 2001), chrysophanic acid (Choi et al., 2010; Jang et al., 2010), shikimate pathway 저해제인 7-deoxy-sedoheptulose (Brillsauer et al., 2019), herbicidin (Won et al., 2015)와 같은 천연 살초물질들이 있으며, 제초제 개발에 이용되었다. 천연물로부터 얻어지는 살초활성물질은 Kim (2006a)이 제안한 것과 같이 재료의 소재지가 국내로 국한되고, 이에 관한 자료가 확보되어 제초제 개발 기술을 확보하고 있으면서도 자본 투입에 어려움을 겪고 있는 국내의 제초제 개발자들에게 좋은 재료가 될 수 있을 것이다.
강원대학교 김성문 교수 연구진은 국내 자생식물로부터 살초활성물질 탐색을 수행하여(Kim, 2006b; Kim et al., 2003a; 2004; 2005b), 족도리(Asarum sieboldii Miq.)로부터 elemicin (Kim et al., 2005a), 애기수영(Rumex acetosella L.)로부터 chrysophanic acid (Kim et al., 2003b), 할미꽃(Pulsatilla koreana Nakai)로부터 anemonin (Choi et al., 2003), 가시박(Sicyos angulatus)으로부터 3-Hydroxy-9H-xanthen-9-one (Cho et al., 2010a), 소리쟁이(Rumex crispus L.)로부터 angelicin을 분리 및 동정한 사례가 있다. 현재까지 강원대학교 연구진이 탐색한 살초활성식물은 국내의 자생식물 4,500여 종 중 약 1,000여 종에 미치지 않기에 미진한 종의 탐색이 이루어져야 한다고 판단된다.
본 연구는 우리나라 자생식물로부터 살초활성물질을 분리하여 새로운 제초제 개발의 모화합물로 삼기 위한 장기적인 연구의 일환으로 수행되었으며, 22과 63종 식물의 살초활성 결과를 얻었기에 보고하는 바이다.
재료 및 방법
시료 채취 및 조제
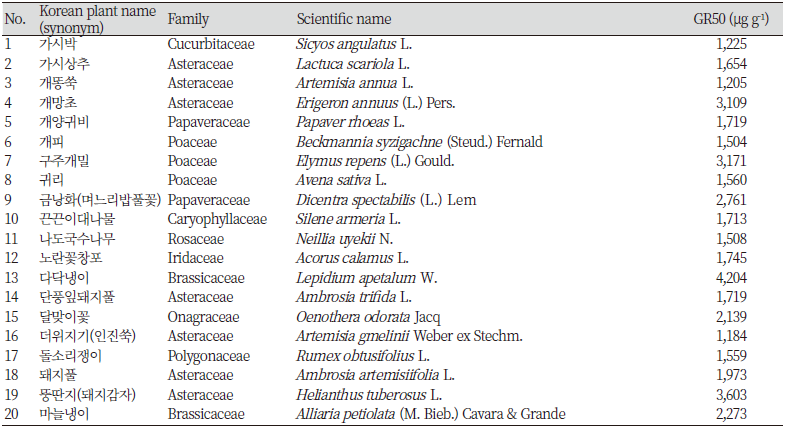
실험에 사용된 63종의 식물 시료는 모두 외래식물로 알려진 것들로 2020년 5월부터 11월까지 강원도 일원에서 채집하였다. 채집은 식물분류학 전공의 장근정 박사에 의해 수행되었으며, 분류학적으로 이상한 시료에 대해서는 Lee (2003)와 Lee (2006)의 식물도감을 참조하여 명확하게 하였다. 채집된 식물시료는 온도 25℃, 습도 50%가 유지되는 강원대학교 천연물 실험실에서 음건한 후, 분쇄기를 이용하여 0.6 mm 이하로 마쇄하였다. 본 연구에서 이용된 식물시료는 총 22과 63종이었으며, 가지과(Solanaceae) 1종, 국화과(Asteraceae) 19종, 대극과(Euphorbiaceae) 1종, 마디풀과(Polygonaceae) 3종, 명아주과(Chenopodiaceae) 1종, 무환자나무과(Sapindaceae) 2종, 미나리과(Apiaceae) 2종, 바늘꽃과(Onagraceae) 1종, 박과(Cucurbitaceae) 1종, 배추과(Brassicaceae) 6종, 벼과(Poaceae) 5종, 붓꽃과(Iridaceae) 1종, 비름과(Amaranthaceae) 1종, 석죽과(Caryophyllaceae) 1종, 양귀비과(Papaveraceae) 3종, 인동과(Caprifoliaceae) 1종, 자리공과(Phytolaccaceae) 1종, 장미과(Rosaceae) 1종, 지치과(Boraginaceae) 1종, 진달래과(Ericaceae) 1종, 질경이과(Plantaginaceae) 2종, 콩과(Fabaceae) 8종이었다. 수집된 식물시료의 일반명, 과명, 학명 및 채집장소는 Table 1에 나타내었다.
|
Table 1. Exotic plants in Korea that are used in this experiment. Sixty-three exotic plants were harvested, and their classification was performed by taxonomist Dr. Geun Jung Jang. (continued)) 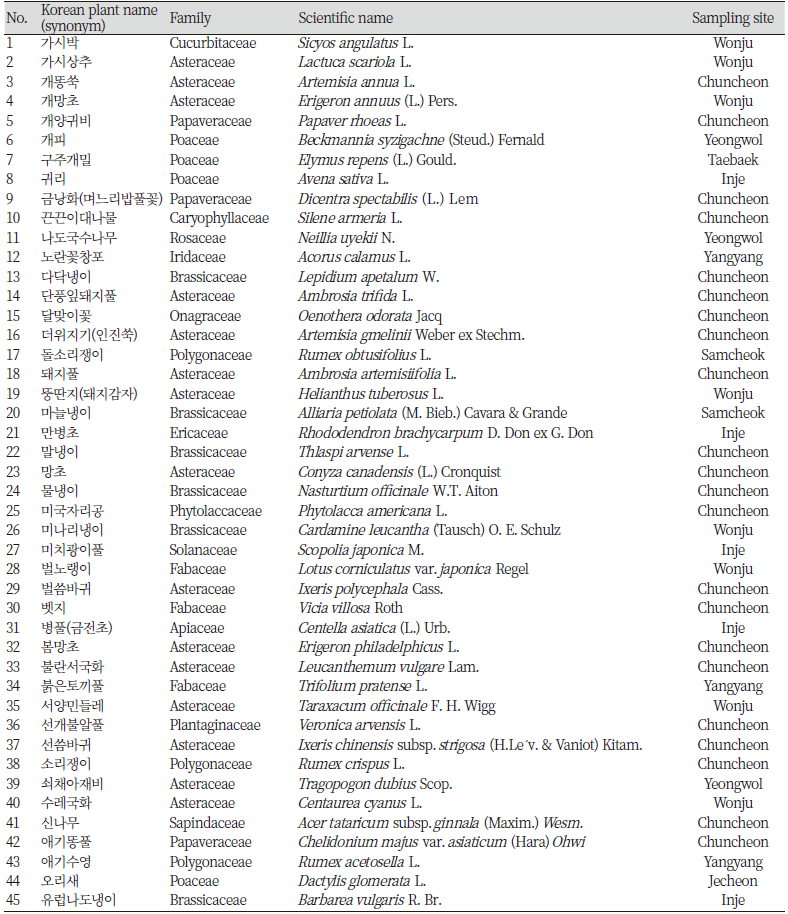
|
|
Table 1. Exotic plants in Korea that are used in this experiment. Sixty-three exotic plants were harvested, and their classification was performed by taxonomist Dr. Geun Jung Jang. 
|
MeOH 추출물
모든 식물시료는 Kim et al. (2003a)의 방법과 동일하게 MeOH 추출물을 제조하였다. 건조가 완료된 시료 100 g을 5 L Erlenmeyer flask에 넣고 methanol (MeOH) 2 L를 첨가한 후, 100 rpm의 진탕기에서 24시간, 2회 반복 추출하였다. MeOH 용액의 분획은 여과지가 깔려있는 Büchner-funnel을 통과시켜 잔재물을 제거하였다. 이후 rotary vacuum evaporator (EYELA NE-1101, Tokyo, Japan)로 완전 농축시킨 후, d-H2O를 50 mL 첨가하여 Flask 내의 건조물을 잘 용해시켰다. 최종적으로, d-H2O에 용해된 추출물은 동결건조기(ILSHIN LAB, Seoul, Korea)를 이용하여 건조시켰으며, 동결건조가 완료된 시료는 -4℃의 냉장고에 보관하면서 살초활성검정에 사용하였다.
살초력 검정
63종 식물 MeOH 추출물에 대한 살초력 검정은 실내실험과 온실시험을 수행하여 검정하였다.
in vitro seed bioassay
동결건조가 완료된 63종 식물 MeOH 추출물은 d-H2O로 희석하여 10,000 μg g-1 농도인 저장용액(stock solution)을 조제한 후, 이 용액으로부터 농도를 달리하는 처리액(working solution; 0, 2,000, 4,000, 6,000, 8,000, 10,000 ppm)을 제조하였다. 이후 sea sand 1 g 위에 각각 5립의 유채 종자와 3립의 나팔꽃 종자가 치상된 24-well tissue culture plate에 처리액을 처리한 뒤, 온도 25℃, 습도 70%, 광도 250 μmol m-2 s-1 조건의 환경에서 생장시켰다. 모든 실험은 3반복 수행되었으며, 나팔꽃 종자는 처리액 처리 3일 후, 유채 종자는 처리 5일 후 유식물의 생체중 및 신초길이를 측정하여 각 종자 대한 생장을 50% 저해할 수 있는 약량인 GR50값을 구하였다.
Greenhouse experiment
살초활성 평가를 위한 온실시험은 대전 소재의 ㈜목우연구소 온실에서 수행하였다. 본실험에 이용된 작물인 옥수수(Zea mays), 콩(Glycine max), 목화(Gossypium indicum), 밀(Triticum aestivum), 벼(Oryza sativa)와 잡초인 물피(Echinochloa crus-galli var. echinata), 바랭이(Digitaria sanguinalis), 쥐꼬리뚝새풀(Alopecurus myosuroides), 호밀풀(Lolium perenne), 둥근잎유홍초(Quamoclit coccinea) 어저귀(Abutilon theophrasti), 털비름(Kochia scoparia), 도꼬마리(Xanthium strumarium)는 일반 밭토양(sandy loam, Daejeon), 수도용 상토(Bunong Horticulture Mix #2; Bunong Industry, Gyeongju, Korea), 원예용상토(Bunong rice nursery media; Bunong Industry, Gyeongju, Korea)가 1:1:1 (v/v/v) 비율로 담겨 있는 넓이 357 cm2와 높이 7 cm인 사각플라스크에 1 cm 깊이로 파종하였으며, 종자에서 발생한 유식물은 실험기간동안 일정 온도(낮 25-30℃, 밤 15-20℃)가 유지되는 온실에서 생육하였다. 각각의 식물 MeOH 추출물은 50% acetone 수용액(0.1% Tween 20 첨가)으로 용해하여 1, 4 kg ai ha-1 약량으로 조제하였으며, 토양처리구는 약제 처리 하루 전 종자를 파종한 다음에 처리하였고, 경엽처리구는 파종 2-3주 후에 처리하였다. 처리는 flat fan nozzle (Teeget 8002EVS; spraying Systems Co., Rosweel, USA)이 장착된 CO2 track sprayer (Korea Plant and Environmental Research Station, Suwon, Korea)으로 살포물량을 1,000 L ha-1의 조건으로 보정하여 처리하였다. 처리가 완료된 포트는 온실에서 생육하였으며, 약제 처리 후, 7일과 14일에 달관평가(0-10, 0: 효과없음, 10: 완전고사)를 실시하여 평가하였다.
결과 및 고찰
in vitro seed bioassay
총 63종 식물 MeOH 추출물 처리액을 각각 농도를 달리하여 나팔꽃 및 유채 종자에 처리한 후 유식물의 생체중과 신초길이를 측정하였다. 나팔꽃과 유채 종자의 발아율은 95% 이상이었으며, 통계분석을 위한 데이터를 얻기에 충분하였기에 이를 바탕으로 GR50 (growth inhibition 50%)값을 얻어 추출물의 살초력을 평가하였다. in vitro 실험 결과, 식물 MeOH 추출물의 살초활성 평가에는 생체중보다 신초길이 데이터가 훨씬 효과적인 것으로 나타났다. 예를 들어, 토끼풀 추출물의 나팔꽃에 대한 신초길이 GR50값은 3,469 μg g-1이었으나 생체중 GR50값은 >10,000 μg g-1이었으며, 유채에 대한 신초길이 GR50값은 1,479 μg g-1인 반면, 생체중 GR50값은 2,511 μg g-1이었다. 본 실험에서 사용된 다른 식물 추출물들도 유채에 대한 토끼풀 추출물의 GR50값 결과와 유사한 경향을 보였다. 이러한 결과로부터 나팔꽃보다는 유채가 더 민감하게 반응하였고, 또 생체중보다는 신초길이가 더 민감하게 반응한다는 사실을 발견하였으며, 저자들은 유채의 신초길이 생장 억제를 살초활성 식물 탐색에 이용하였다.
유채 종자에 대한 63종 식물 MeOH추출물의 GR50값을 Table 2에 나타내었다. 본 연구에서 유채 유식물의 생장을 많이 시켰던 식물 추출물은 물냉이 추출물로 GR50값은 6,200 μg g-1으로 나타났으며, 유채 유식물의 생장을 가장 억제한 좀명아주 추출물의 GR50값은 1,264 μg g-1이었다.
이전의 보고에서 Kim (2006a)은 유채에 대한 박과의 가시박 추출물 GR50값을 328 μg g-1이라 보고하였던 반면, 본 연구에서는 1,225 μg g-1으로 나타났다. 그리고 마디풀과의 애기수영 추출물 GR50값은 >2,000 μg g-1인 것으로 보고된 반면(Kim, 2006a), 본 연구에서는 2,403 μg g-1으로 차이가 났는데, 이러한 차이는 Kim (2006a)이 언급한 것처럼 채집장소, 채집시기, 환경조건의 차이에 기인한다고 보여진다.
Greenhouse experiment
작물 5종과 잡초 8종이 파종된 발아 전(파종 후 1일)과 생육기(파종 후 2-3주) 포트에 식물 MeOH추출물들을 1, 4 kg ai ha-1약량으로 처리하고, 처리 후 7일 또는 14일에 달관평가를 실시하였다. 그 결과 발아 전 토양처리의 경우, 1, 4 kg ai ha-1 약량에서 작물 및 잡초에 대해 아무런 약해와 약효 증상이 발견되지 않았다. 온실에서 재배된 13종 식물(작물 5종, 잡초 8종)에 대해 63종 식물 추출물 처리액을 경엽처리한 결과, 금낭화(Dicentra spectabilis [L.] Lem), 말냉이(Thlaspi arvense L.), 소리쟁이(Rumex crispus L.), 참새귀리(Bromus japonicus Houtt) 추출물에서만 4 kg ai ha-1 약량에서 피의 생육 억제가 나타났으며, 약해 역시 발견되었다(Table 3). 나머지 추출물이 처리된 식물에서는 약해와 약효 모두 관찰되지 않았다. 금낭화, 말냉이, 소리쟁이, 참새귀리 추출물이 처리된 피의 잎에서는 Fig. 1과 같이 엽색이 진녹색으로 변하면서 잎이 기형적으로 뒤틀리는(twisting) 증상이 관찰되었다. 본 연구의 온실실험에서 살초활성이 관찰된 4종의 식물 중 소리쟁이에는 살초활성물질이 단리되어 angelicin (2H-furo[2,3-H]-[1]-benzopyran-2-one)이라고 보고된 바가 있기에(Cho et al., 2010b), 향후 angelicin에 대한 후속 연구가 진행되기를 기대한다.

Fig. 1. (A) Effect of foliar treatment of MeOH extracts on several plants in a greenhouse condition. Plant growth is retarded by the application of MeOH extract. (B) Symptoms of MeOH extracts (4 kg ai ha-1) on banrnyardgrass (Echinochloa crus-galli) at 7 days after treatment. The several plants (from front left in pot) are banrnyardgrass (Echinochloa crus-galli), crabgrass (Digitaria sanguinalis), black grass (Alopecurus myrosuroides), perennial ryegrass (Lolium perenne), (from behind left) red morningglory (Quamoclit coccinea), velvetleaf (Abutilon theophrasti), pig weed (Amaranthus retroflexus), cocklebur (Xanthium strumarium).
본 연구의 결과, in vitro 실험과 온실시험간에는 상이한 살초효과 결과가 나타났다. 온실시험의 경우 in vitro 실험보다 살초효과가 낮게 나타났는데, 이는 온실에서 주위 환경에 의한 약효 변동 요인으로 인해 약효가 경감되는 것으로 추론된다. 실험에 영향을 미친 요인으로는 관수에 의한 용탈, 광분해, 토양 미생물에 의한 생물학적 분해를 들 수 있겠으나, 본 실험에서는 이에 대한 추가 실험이 이루어지지 않았으므로 명확한 결론을 내릴 수가 없었다.
고찰
국내의 제초제 개발회사에서는 기존에 개발된 작용점과는 다른 작용점을 공격하는 화학물질을 탐색하기 위하여 모든 역량을 집중하고 있다. 새로운 작용점을 갖는 신규 제초제를 개발하는 방법으로는 1)무작위로 유기합성된 살초활성물질을 스크리닝하는 방법, 2)개발되어 있는 제초제의 구조를 모방하는 방법, 3)작용점 저해 화합물을 컴퓨터를 이용하여 설계하고 고활성의 제초활성물질을 합성하는 생합리적 방법과 4)천연물로부터 살초활성물질을 탐색하는 방법이 있다(Duke et al., 2000). 이러한 방법들 중 천연물을 이용하는 방법은 주로 식물학자들을 주축으로 천연물에 함유된 살초활성을 탐색하고, 이에 함유된 살초활성물질을 모화합물로 삼아 살초활성을 지속적으로 높일 수 있기 때문에 phosphinothricin (glufosinate), 1,8-cineole (eucalyptol), leptospermone와 같은 성공적인 사례를 만들어 내기도 하였다(Kim, 2006a). 국내에서도 한국화학연구소와 강원대학교 연구진을 중심으로 국내 자생식물의 살초활성을 탐색하였고(Kim, 2006b; Kim et al., 2003a; 2004; 2005b;), 살초활성물질을 분리동정하여 보고한 바 있다(Choi et al., 2003; 2010; Jang et al., 2010; Kim et al., 2003b; 2005a). 비록 이러한 연구가 제초제 개발로는 진행되지 않았지만, 새로운 제초제 모화합물을 탐색하여 유기화학자들에게 정보를 제공한다는 점에서 국내 제초제 개발회사에서는 정보를 충분히 활용할만 하다고 평가된다.
본 연구에서 수집한 63종의 식물 대부분은 기존에 보고된 것과는 다른 종이었으나 같은 종도 포함되어 있었다. 이는 생리활성 검정을 위해서 중복 수집이 필요하다고 보고된 바가 있었기에(Kim, 2006b) 무작위로 수집하는 과정에서 중복 수집된 종이 포함되었다. 본 연구를 통해서 단풍잎돼지풀과 애기수영의 GR50값은 각각 1,719와 2,403 μg g-1인 것으로 평가되었던 반면(Table 2), Kim (2006a)의 보고에서는 모두 >2,000 μg g-1 이라고 보고되었는데, 이러한 연구결과는 식물의 생리활성이 채집시기와 채집위치에 따라 다르다는 것을 증명하는 것이라 할 수 있다.
본 연구를 통해 저자들은 국내 자생식물 63종의 살초활성을 in vitro에서 검정하였고, 또 토양처리실험과 경엽처리실험을 수행하였는데, 금낭화, 말냉이, 소리쟁이, 참새귀리 추출물을 피에 경엽 처리하였을 경우, 피의 생장 억제 및 잎이 기형적으로 휘는 증상을 발견하였다.
현재 저자들은 매년 살초활성이 있는 자생식물을 탐색하고 이를 바탕으로 살초활성물질을 탐색하고 있지만, 살초활성을 찾아내기 위해서라면 향후 그 대상을 토양방선균(Won et al., 2015)과 박테리아(Brillsauer et al., 2019)로까지 확대하는 것을 고려해 볼 수 있을 것이다. 한국화학연구소에서는 토양방선균인 Streptomyces scopuliridis에 함유된 살초활성물질인 herbicidins을 분리 및 동정하여 제초제 모화합물로써의 가능성을 제시하였다(Won et al., 2015). 또, Nature Communications에 발표된 논문(Brillsauer et al., 2019)에 따르면 시아노박테리아가 생산하는 광합성산물인 7-deoxy-sedoheptulose는 시킴산 경로(shikimate pathway)를 제어하여 광합성을 하는 식물의 생장을 억제한다고 보고하였다. 식물에만 존재하는 시킴산 경로를 통해서 aromatic amino acids (tyrosine, tryptophan, phenylalanine), plastoquinone, vitamine K, 식물 세포벽의 구성성분인 lignine은 물론, ubiquinone의 전구물질인 chorismate 등이 생성되기 때문에 시킴산 경로는 식물의 생존에 필수적인 것으로 알려져 있다(Herrmann and Weaver, 1999). 향후 방선균 또는 박테리아와 같은 미생물을 대상으로 살초활성을 지속적으로 탐색한다면 7-deoxy-sedoheptulose와 같은 독특한 살초활성물질을 발견할 수 있을 것이다.
요 약
전세계의 제초제 개발회사에서는 새로운 작용기작을 갖는 신규 화합물을 식물로부터 탐색하고 있다. 본 연구의 목적은 살초활성이 있는 국내의 자생식물을 선발하는데 있다. 국내의 자생식물 63종 시료로부터 MeOH 조추출물을 얻은 다음 24-well tissue culture plate에서 유채(Brassica napus L.)와 나팔꽃(Ipomoea nil [L.] Roth)의 신초길이와 생체중을 측정하여 in vitro살초검정을 수행하였고, 온실에서 토양처리 및 경엽처리 후 다양한 광엽식물과 화본과식물의 잎에서 나타나는 살초증상을 달관평가하였다. 자생식물 63종 중 전동싸리와 흰전동싸리 등 29종은 유채에 대하여 중정도의 살초활성을 나타내었으며(1,000 μg-1<GR50값<2,000 μg-1), 4종은 나팔꽃에 대하여 중정도의 살초활성을 나타내었다. 온실시험에서 추출물을 토양처리한 경우에는 살초효과가 전혀 발현되지 않았으나, 경엽처리의 경우, 금낭화, 말냉이, 소리쟁이, 참새귀리 추출물을 4 kg ai ha-1 약량으로 처리하였을 때 피의 잎이 뒤틀리면서 기형적으로 생장하였으며 생육이 억제되었다. 본 연구는 국내의 자생식물 중 살초활성을 나타낸 시료로부터 새로운 작용점을 갖는 살초활성물질을 탐색할 수 있을 것이다.
주요어: 살초 활성, 생물제초제, 종자 발아
Acknowledgment
This work was supported by the Korean Ministry of Environment (Grant no. 2018002270002). Authors thanks to Dr. Geun Jung Jang, at Kangwon National University for his support of sampling sixty-three plants.
Authors Information
Minji Hong, https://orcid.org/0000-0002-1310-5472
Nam-Kyu Cho, Moghu Research Center Ltd., Senior Researcher
Sela Bo, Kangwon National University, M.Sc. student
Hyejeong Jang, Kangwon National University, M.Sc. student
Ki Hwan Hwang, Moghu Research Center Ltd., Vice President
Sowndhrararjan Kandhasamy, https://orcid.org/0000-0002-8638-6025
Sun Hee Hong, https://orcid.org/0000-0001-7581-0604
Yong Ho Lee, Hankyong National University, Post-doctoral Fellow
Songmun Kim, https://orcid. org/0000-0002-8032-7569