서 언
현재 상업용 제초제의 작용점은 적어도 25개 이상이 되는 것으로 보고되고 있지만(WSSA, 2021), 제초제 산업에서 도전받고 있는 안전성 문제나 제초제 저항성 잡초의 급격한 증가와 같은 제반 문제점을 해결해 나가기 위해서는 신규 작용기작 또는 새로운 구조의 제초활성물질은 꾸준히 탐색되어야 한다(Duke, 2011; Kim and Kim, 2020b; Kraehmer et al., 2014). 이를 위해서는 식물기능에 대한 이해가 보다 심화되어야 하며 이를 바탕으로 목표기능 대사과정의 조절가능 지점 (작용점)의 탐색, 작용점 조절물질 탐색방법 구축 등이 선행되어야 할 것이다.
Kim et al. (2020)은 식물기능연구에 있어서 미개척 정도, 구조적 측면에서의 신규 화합물 개발가능 확률, 현재 개발되고 있는 화합물의 제초활성발현 특성 등의 여러가지 측면을 검토해 볼 때, 향후 신규 제초활성 화합물 개발가능성이 높다고 여겨지는 식물기능 중의 하나로서 세포벽 형성과정 중의 셀룰로오스 생합성 경로를 제안하고 있다. 식물세포의 셀룰로오스 생합성-세포벽 형성 과정은 여러 가지의 생리생화학적 반응이 상호연결되어 있어서(Lampugnani et al., 2018) 매우 복잡한 network system을 갖추고 있다고 알려져 있다. 따라서 이를 대상으로 연구를 진행할 경우, 어떤 한 작용점의 억제는 커다란 연쇄적 파급력을 가져올 수 있는 여지가 높겠지만 연구방법론 측면에서는 복잡성으로 인해 분명하고 효율적인 연구방법론을 구축하기에는 어려운 단점이 있을 것이다.
셀룰로오스 생합성 저해제(cellulose biosynthesis inhibitor, CBI) 탐색에 관한 그동안의 연구방법을 검토해 보면, in vitro 효소 수준의 생화학적 검정법은 시도되지 않았고 거의 모두 여러 가지 다양한 in vivo 방법에 의존하였으며 각각의 장단점이 있지만 개선의 여지가 많은 것으로 보고되고 있다(Kim et al., 2020). 그리고 앞으로의 개선방향은 셀룰로오스 생합성-세포벽 형성 과정의 복잡성으로 인해 이에 작용되는 일련의 화합물을 저비용으로 보다 신속하게 탐색하려면 in vitro 보다는 in vivo 시스템이 바람직하며, 단순하면서 저비용의 원스텝 스크리닝(one-step screening) 방법을 확보하는 것이 무엇보다 필요하다고 하였다(Kim et al., 2020). 즉 CBI에서만 나타내는 특이적인 증상을 토대로 단번에 신속검정할 수 있다면 이는 보다 저비용으로 빠르게 CBI를 발굴할 수 있는 실용적인 방법을 제공하는 것이다. 따라서 본 연구에서는 부유식물로서 제초활성물질 스크리닝(Jančula and Maršálek, 2012; Kumar and Han, 2010) 또는 생태독성평가의 모델식물로 전세계적으로 사용되고 있는 개구리밥과(Lemnaceae) 식물체를 대상으로(Baudo et al., 2015; Blinova et al., 2018; Cedergreen et al., 2004; Hong et al., 2000; Samaneh, 2016; Xu et al., 2010) CBI에서만 나타내는 특이적인 증상이 있다면 이를 토대로 one-step in vivo screening을 구현시킬 수 있을 것으로 판단하여, 제초발현특징과 조사방법을 면밀히 조사함과 동시에 이를 이용한 생물검정법 확립을 위한 제반 실험을 수행하였다.
재료 및 방법
실험 식물재료
본 실험에 사용된 개구리밥(Spirodela polyrhiza, 이하 SPIPO라고 함)과 좀개구리밥(Lemna paucicostata PC3033, 이하 LEMPA라고 함)은 일정 조건의 생육실(온도 25℃, 광주기 14시간, 광도 100-150 μmol m-2s-1조건)에서 1X mDM (MDM) 배지에(Kim and Kim, 2020b) 비멸균조건으로 계대배양중인 것을 사용하였다.
공시화합물
제초작용 증상구별이 까다로운 네가지 작용점의 화합물 그룹[Herbicide Resistance Action Committee/Weed Science Society of America (HRAC/WSSA) group 3, 14, 15, 29]을 대상으로 하였으며, 특히 셀룰로오스 생합성저해제의 경우에는 화합물 계열간의 증상차이도 존재하는지를 확인하기 위하여 5가지 다른 화학구조 계열의 화합물을 공시하였다. 실험에는 순도 90% 이상의 원제(technical grade)를 사용하였다(Table 1).
|
Table 1. Herbicidal compounds used in this study. 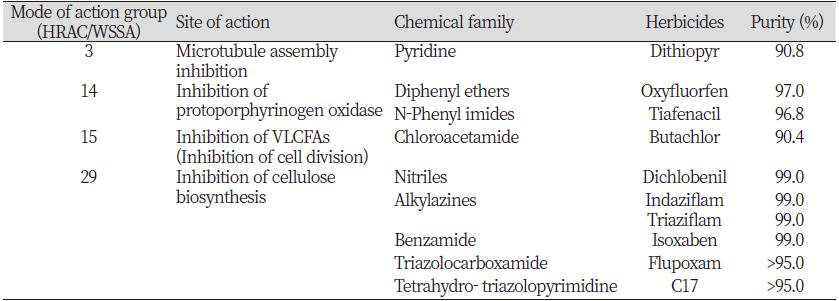
|
|
HRAC/WSSA: Herbicide Resistance Action Committee/Weed Science Society of America; VLCFAs: Very long chain fatty acids. |
시험용액 조제
계면활성제 Tween 20을 함유한 아세톤 또는 dimethyl sulfoxide (DMSO) 용매를 이용하여 시험화합물을 녹인 다음, 이를 수돗물로 조제된 MDM 배지에(Kim and Kim, 2020b) 희석하여 여러 농도의 시험용액을 만들었다. 이때 아세톤, DMSO, Tween 20의 최종농도는 각각 0.2%, 0.2%, 10 ppm 이었으며 이로 인한 약해는 관찰되지 않았다.
실험방법
좀개구리밥 및 개구리밥 배양실험의 기본방법
좀개구리밥(LEMPA)의 경우, 조제된 시험 화합물 용액을 투명 플라스틱 원형컵(직경: 상 52 mm-하 36 mm, 높이 60 mm, Sang Ji, Goyang, Korea)에 30 mL씩 3반복 분주한 후, 계대배양중인 좀개구리밥 중에서 생육단계가 2.8-3.2 frond 짜리인 것 7개를 골라 접종하였다. 한편 개구리밥(SPIPO)의 경우는 20 mL 시험 화합물 용액을 투명 플라스틱 원형컵에 3반복 분주하고 계대배양중인 개구리밥 중에서 생육단계가 2.1-2.3 frond 짜리인 것 2개를 골라 접종하였다. 그 후 이들을 물이 소량 담긴 플라스틱 박스에 옮긴 후, 증발 방지용 투명 필름으로 덮개를 하여 생육실 형광등 조건에 (26±1℃, 14 hr 광주기, 50 µmol m-2 s-1) 두고 5일간 배양하였다. 모든 실험은 비멸균 조건에서 수행되었다. 배양기간동안 경시적으로 제초반응사진을 촬영하면서 검정식물의 생육상태와 제초증상을 달관조사하였다. 배양종료 실험구의 달관조사 이후에는 LEMPA의 경우 엽상체 개수를 조사한 후 생장한 개체 모두를 수집하여 물기를 제거한 다음 생체중을 측정하였다. SPIPO의 경우엔 엽상체 개수를 조사하지는 않고 바로 생체중을 조사하였다. 생체중 측정이 완료된 시료는 10 mL methanol이 담긴 falcon tube에 침지시켜 1일 동안 실온 암조건에서 색소를 추출한 후 UV/VIS spectrophotometer (DU800, Beckman Coulter, USA)를 이용하여 470, 652.4, 665.2 nm에서의 흡광도 값을 측정, Lichtenthaler (1987)방법에 의해 광합성색소를 정량하였다. 색소가 추출된 잔여시료(residues)는 별도로 수집하여 90℃에 1일 이상 건조시킨 다음 건물중을 조사하였다. 필요에 따라서는 색소가 추출된 잔여시료(residues)를 건져서 메탄올에 침지시키거나 물에 띄운 다음 사진촬영을 실시하였다. 공시 화합물의 생육억제활성은 기본적으로 무처리구에 대한 상대 비율(%)로 나타내었다.
CBI에 의해 유도되는 흑갈색 발현정도에 미치는 여러 처리의 영향
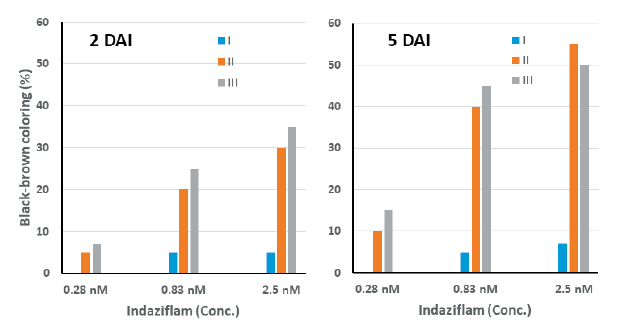
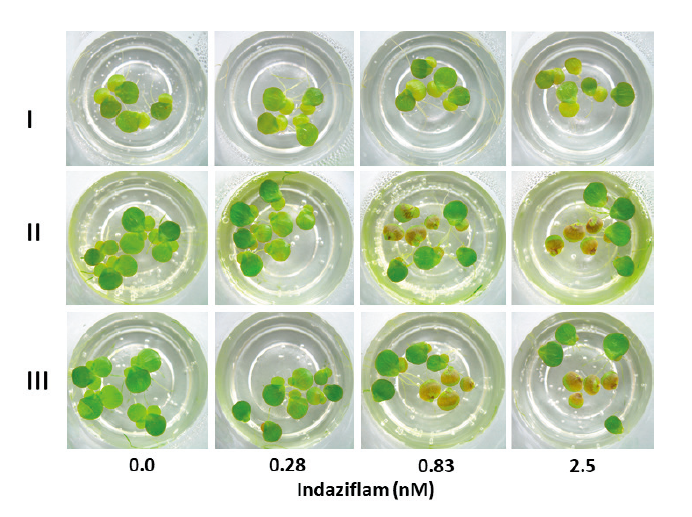
배양중의 광도가 CBI에 의해 유도되는 흑갈색 발현정도에 어떠한 영향을 미치는지를 알고자 실험하였다. Indaziflam (0.28-2.5 nM)을 처리한 SPIPO를 세가지 광도, 즉 0-20 µmol m-2s-1 (I), 30-40 µmol m-2s-1(II), 70-80 µmol m-2s-1(III) 광도조건에 배양하면서 처리후 5일까지의 흑갈색 발현 정도를 경시적으로 육안평가하였다. 기타 모든 방법은 사전 실험에서와 같다.
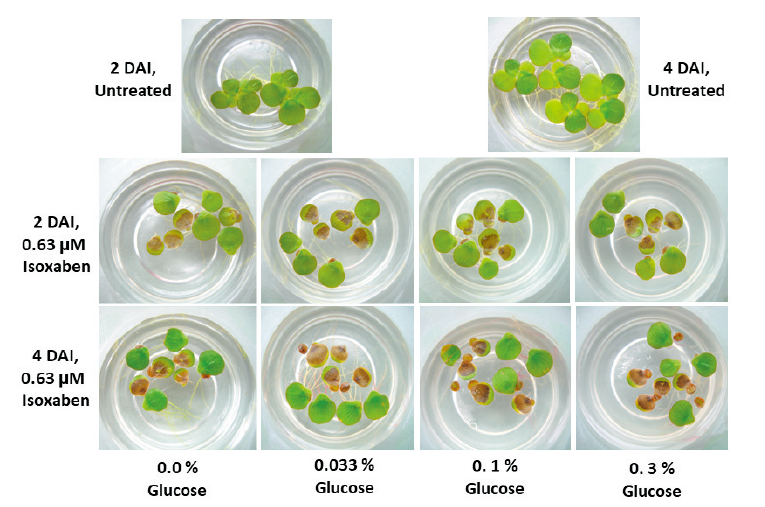
또한 기본 시험용액 내에 glucose를 비롯한 여러 가지 화합물의 추가가 흑갈색 발현정도에 어떠한 영향을 미치는지를 알아보고자 실험하였다. Isoxaben (0.04-2.5 µM)을 함유한 MDM 시험용액에 여러 농도의 glucose (0.033-0.3%), ascorbic acid (0.1, 1.0 mM), hydrogen peroxide (1.25-5.0 mM), 또는 dichlobenil (0.16-10 µM)을 함유한 MDM 시험용액에 여러 농도의 atrazine (0.16-10 µM), glyphosate(10-300 µM), bensulfuron-methyl (2.5-160 nM), oxadiagyl (3-100 nM)를 첨가한 후 이들을 기본 실험조건(26±1℃, 14 hr 광주기, 50 µmol m-2 s-1)에 배양하면서 처리후 5일까지의 흑갈색 발현 정도를 경시적으로 육안평가하였다. 기타 모든 방법은 사전 실험에서와 같다.
흑갈색 발현의 정량·정성분석 방법
이미지 색상분석
Triaziflam 및 isoxaben을 처리하여 흑갈색이 발현된 SPIPO 엽상체를 가지고 메탄올로 색소를 추출하기 전후의 엽상체 사진을 대상으로 이미지 색상분석 도구인 HTML Color Codes (2020) 또는 컴퓨터에 내장된 그림판 프로그램을 활용하여 black-brown color 점유비율을 비파괴적으로 조사해 보았다. 색상을 RGB값으로 나타내어 이들을 합산했을 때 낮은 값일수록 흑갈색 출현 정도가 증가된다,
Diffuse Reflectance-Ultraviolet/Visible Spectra (DR-UV/VIS Spectra)
Isoxaben 15 μM이 처리되어 흑갈색이 유도된 SPIPO 엽상체를 메탄올에 침지하여 색소를 추출한 다음 이를 건조시켜 마쇄하여 얻은 파우더를 가지고 DR-UV/VIS spectrophotometer (S-4100, SCINCO, Seoul, Korea)를 이용한 반사 스펙트럼을 조사하였다.
Ultraviolet / Visible Spectra (UV/VIS Spectra)
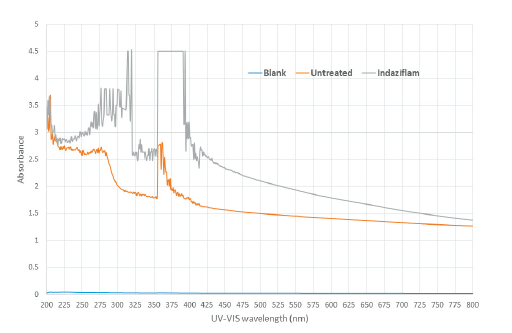
Indaziflam 0.04 μM이 처리되어 흑갈색이 유도된 SPIPO 엽상체를 메탄올에 침지하여 비파괴적으로 색소를 추출한 다음 이를 1회용 cuvette 내벽에 부착하여 UV/VIS spectrophotometer (DU800, Beckman Coulter, Brea, USA)를 이용하여 in vivo 흡광 스펙트럼을 조사하였다.
Fourier-transform infrared (FT-IR) spectroscopy
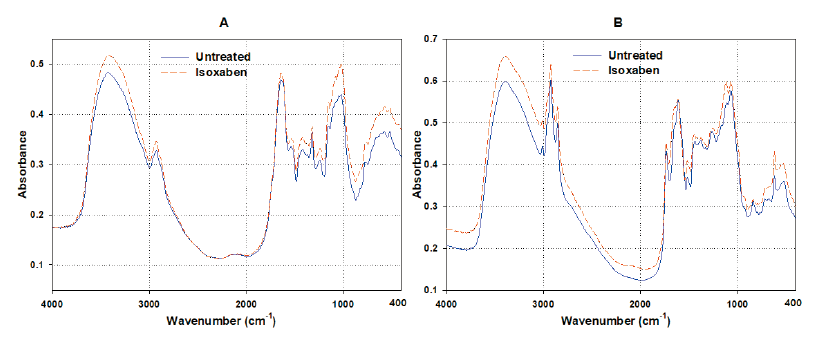
Isoxaben 15 μM이 처리되어 흑갈색이 유도된 SPIPO 엽상체를 메탄올에 침지하여 색소를 추출한 다음 이를 건조시켜 마쇄하여 얻은 파우더를 가지고 FT-IR spectrophotometer (Alpha Base Module, BRUKER, Berlin, Germany)를 이용한 흡광 스펙트럼을 조사하였다.
결과 및 고찰
개구리밥과 좀개구리밥에서의 화합물 처리에 따른 작용발현(증상) 특성
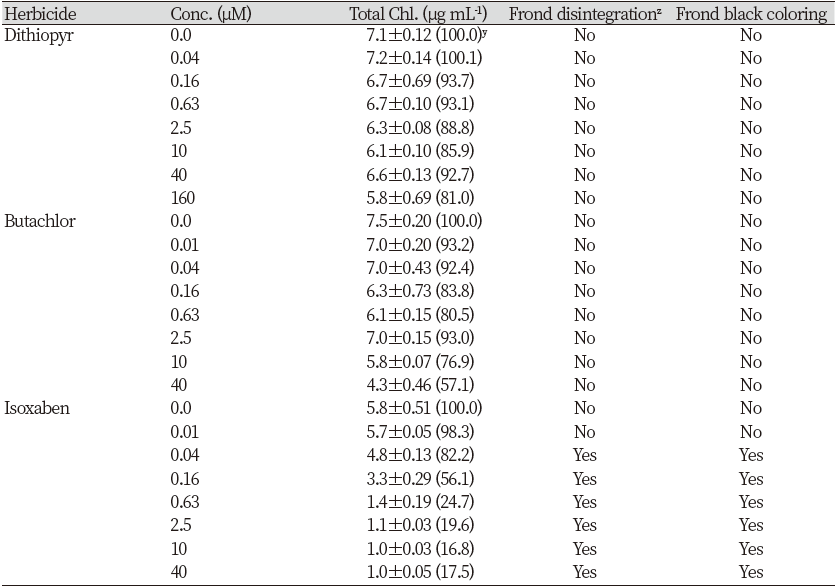
Kim et al. (2020)에 의하면 종자유묘 생장에 있어서 CBI와 가장 유사한 반응을 보이는 작용기작그룹으로서 VLCFAs (very long chain fatty acids) 저해제와 microtubule assembly 저해제를 들 수 있다고 하였다. 따라서 이들을 대표할 수 있는 각각의 화합물 butachlor, dithiopyr와 CBI로서 isoxaben을 가지고 SPIPO에 대한 작용발현양상을 상호비교하여 어떠한 차이가 있는지 알아보고자 실험하였다. 그 결과, 개구리밥(SPIPO)를 대상으로 처리된 공시 약제(butachlor, dithiopyr, isoxaben)는 모두 뚜렷한 생육저해를 일으켰다. 그러나 처리농도에 따른 건물중 감소정도는 isoxaben>butachlor>dithipyr 순으로 높은 경향을 보였다(Table 2). 한편 광합성색소 함량에 미치는 효과를 조사한 경우, 모든 약제에서 처리농도가 증가됨에 따라 색소함량(μg mL-1 기준)도 감소되었는데 그 경향은 건물중 감소정도와 유사하였다(Table 3). 이는 처리약제들이 광합성 색소 생합성 자체는 직접적으로 저해하지 않음을 시사해 주며 단순히 생장감소로 인해서 색소함량이 감소되었음을 보여준다. 그러나 처리약제에 따른 제초증상은 뚜렷히 다르게 나타났다(Fig. 1). Microtuble assembly 저해제로 알려진 dithiopyr는 신규 엽상체의 소형화와 탈리, 근 신장의 억제와 팽대(expansion), 하향굴곡 형태로의 생장 자세 변화가 나타났다. 그리고 고농도에서 엽상체 접합부를 중심으로 국부적인 색소축적이 관찰되었다. 특히 엽상체 탈리의 경우에는 배양후 3일째부터 농도의존적으로 부분해체가 일어나다가 4-5일째에는 고농도처리에서 해체정도가 심하게 나타나는(어린 엽상체의 탈리) 경향이었다, VLCFAs 저해제로 알려진 butacholr에서는 신규 엽상체의 소형화는 일어나나 해체(탈리)가 미약하게 일어나는 모습이었으며, 근 신장의 억제는 뚜렷하나 팽대는 일어나지 않았다. 그리고 dithiopyr에서처럼 엽상체 접합부를 중심으로 국부적인 색소축적이 관찰되었다. 한편 CBI로 알려진 isoxaben 처리에서는 엽상체의 신속한 해체(탈리) 및 신규 엽상체의 소형화와 함께 엽상체 분열부를 시작으로 흑갈색 색소 침착이 전면에 뚜렷하게 발현되면서 괴사가 진행되었고 근 말단의 팽대(expansion)도 관찰되었다. 특히 엽상체 탈리의 경우에는 배양후 1일째부터 농도의존적으로 완전히 해체되는 경향을 보였다. 따라서 공시된 세 화합물간의 비교에 있어서 isoxaben의 가장 독특한 증상차이는 엽상체의 신속한(1일 이내) 해체와 더불어 엽상체가 분열부 중심으로 괴사되면서 흑갈색 색소가 축적되는 것이었다(Fig. 1).
|
Table 2. Effect of several herbicides on the growth of Spirodela polyrhiza. 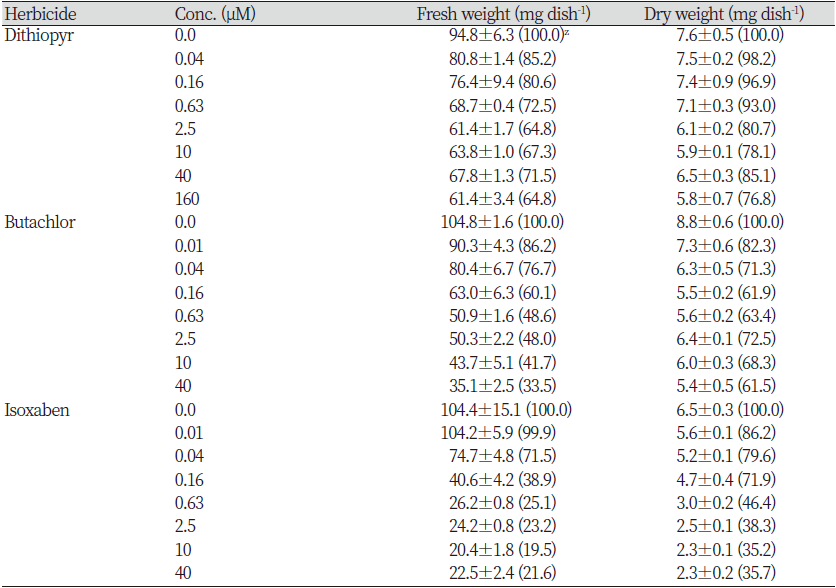
|
|
Conc.: Concentration. z Values of parenthesis represent relative % of untreated control. |
한편 CBI로 알려진 여러 화학구조의 화합물이 개구리밥(SPIPO)에 대해 동일한 제초증상을 나타내는지 알아보기 위한 실험 결과에서는 처리된 6가지 화합물 모두에서 일치된 제초증상을 나타내었다. 즉, 전체적인 생육저해(소형화), 뿌리 선단부의 팽대, 엽상체 완전해체와 함께 엽상체 분열부 중심으로 흑갈색 색소 침착이 뚜렷하게 발현되면서 괴사되는 증상이 관찰되었다(Fig. 2). 그리고 개구리밥 엽상체에 축적된 흑갈색 색소는 메탄올에 의해 전혀 추출되지 않는 특징을 보였다(Fig. 3). 즉 개구리밥 엽상체내 광합성 색소와 안토시아닌은 메탄올에 의해 용이하게 추출되어 무처리구의 엽상체가 흰색을 띠지만 CBI가 처리된 엽상체는 흰색 바탕에 흑갈색 색소가 그대로 남아있어 보다 선명하게 증상발현을 확인할 수 있었다.
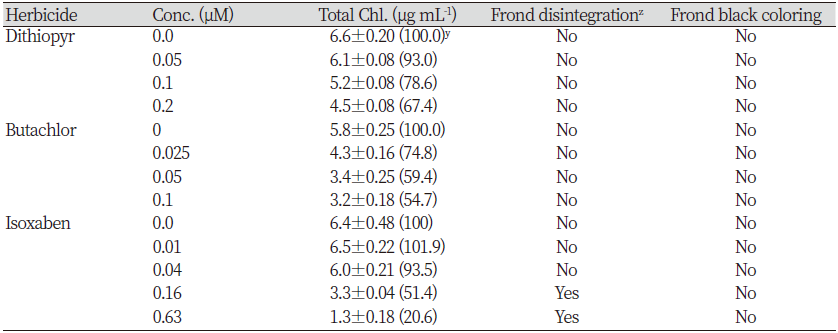
좀개구리밥(LEMPA)에서도 SPIPO와 유사한 경향을 나타내는지 조사해 보았다. 그 결과, LEMPA를 대상으로 처리된 공시 약제(butachlor, dithiopyr, isoxaben)는 모두 뚜렷한 생육저해를 일으켰다. 그러나 처리농도에 따른 건물중 감소정도는 SPIPO에서와 같이 isoxaben>butachlor>dithipyr 순으로 높은 경향을 보였다(Table 4). 한편 광합성색소 함량에 미치는 효과를 조사한 경우에서도, 모든 약제에서 처리농도가 증가됨에 따라 색소함량(µg mL-1 기준)이 감소되었는데 그 경향은 건물중 감소정도와 유사하였다(Table 5). 이는 처리약제들이 광합성 색소 생합성 자체는 직접적으로 저해하지 않음을 시사해 주며 단순히 생장감소로 인해서 색소함량이 감소되었음을 보여준다. 그러나 처리약제에 따른 제초증상은 화합물간 약간씩 다르게 나타났을 뿐만아니라 isoxaben 경우에는 SPIPO와도 뚜렷히 다른 결과를 보여주었다(Fig. 4). Microtuble assembly 저해제로 알려진 dithiopyr는 엽상체의 생장억제와 탈리, 근 신장의 억제가 나타났다. 특히 엽상체 탈리의 경우에는 배양후 1일째에는 관찰되지 않았지만 2-3일째부터 농도의존적으로 뚜렷하게 나타나는 경향이었다. VLCFAs 저해제로 알려진 butacholr에서는 분열억제, 신규 엽상체의 소형화, 엽상체의 chlorosis가 관찰되었으며 엽상체 해체(탈리)는 거의 일어나지 않는 모습이었고, 근 신장의 억제도 뚜렷하였다. 한편 CBI로 알려진 isoxaben 처리에서는 엽상체의 신속한 해체(탈리), 신규 엽상체 및 접합부를 중심으로 엽록소 파괴와 함께 침윤/괴사 증상이 일어났지만 SPIPO에서와 같은 흑갈색 색소 침착은 관찰되지 않았다(Fig. 4). 특히 엽상체 탈리의 경우에는 배양후 1일째부터 농도의존적으로 완전히 해체되는 경향을 보였다. 따라서 공시된 세 화합물간의 비교에 있어서 isoxaben의 가장 독특한 증상차이는 엽상체의 신속한(1일 이내) 해체와 더불어 엽상체의 탈색과 괴사이었다(Fig. 4). 그러나 여기에서 나타나는 엽상체 탈색/괴사는 외견상 세포막파괴를 일으키는 기타 화합물들에서도 유사하게 관찰되는 증상이기 때문에(데이터 제시 생략) CBI만의 고유 증상지표로 삼기에는 곤란하였다.
이들의 실험결과를 종합해 볼 때, 같은 개구리밥과에 속할지라도 SPIPO와 LEMPA간에는 CBI에 대한 증상차이가 있었으며, 약제처리후 신속히 발현되는 엽상체 해체와 흑갈색 침착을 나타내는 SPIPO에서의 증상이 다른 작용기작의 화합물들과 뚜렷하게 구분되는 CBI의 지표가 될 수 있음을 발견하였다. CBI에서 이러한 증상이 나타나는 이유는 셀룰로스 생합성이 저해됨으로 인해 엽상체의 연결조직(stipule)이 가장 민감하게 파괴되어 해체가 일어나는 것으로 추정되며, 한편 흑갈색 침착은 셀룰로오스 생합성 저해로 인해 UDP-glucose의 cellulose로의 유입이 억제되면서 이로 인해 당성분들이 축적되고 아울러 세포벽 생합성복잡계 균형이(Barrosy et al., 2015; Haigler et al., 2001; Kumar et al., 2016; Meents et al., 2018; Polko and Kieber, 2019; Tateno et al., 2016; Yeats et al., 2016) 파괴되어 리그닌, 활성산소 및 기타 당결합 성분 등이 축적되면서 마이야르 반응(Everts, 2012) 또는 미지의 반응으로 세포내 흑갈색 색소침착이 일어나는 것으로 추정된다. 특히 이러한 색소침착은 LEMPA에서는 보여지지 않지만 안토시아닌 색소생합성 대사가 보다 발달된 SPIPO에서만 관찰되는 것으로 보아 안토시아닌 색소대사가 밀접히 연관된 독특한 현상인 것으로 판단된다. 보다 정확한 구명을 위해서는 향후 별도의 생화학적 연구가 진행되어야 하겠다.
|
Table 4. Effect of several herbicides on the growth of Lemna paucicostata. 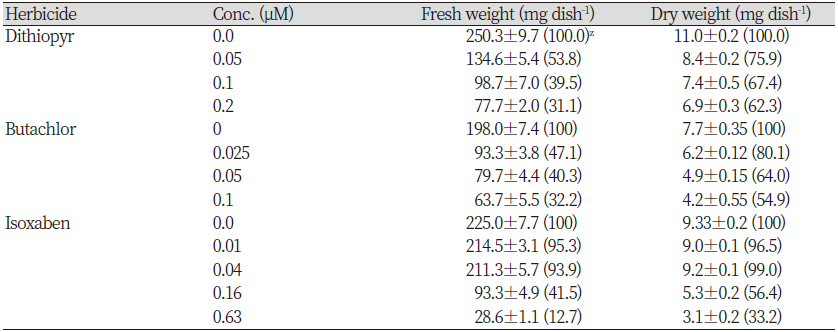
|
|
Conc.: Concentration. zValues of parenthesis represent relative % of untreated control. |
CBI에 의해 유도되는 흑갈색 발현정도에 미치는 여러 처리의 영향
SPIPO에서 나타나는 CBI의 독특한 증상, 즉 흑갈변 증상이 어떠한 요인들에 의해 영향을 받는지를 파악하는 것은 CBI의 살초기작을 이해하는데 중요한 단서를 제공해 줄 수 있을 뿐만 아니라 본 증상이 민감하게 가장 잘 발현될 수 있는 조건이 있다면 CBI의 보다 효율적인 탐색을 위한 생물검정법 신규 개발에 응용될 수 있을 것이다.
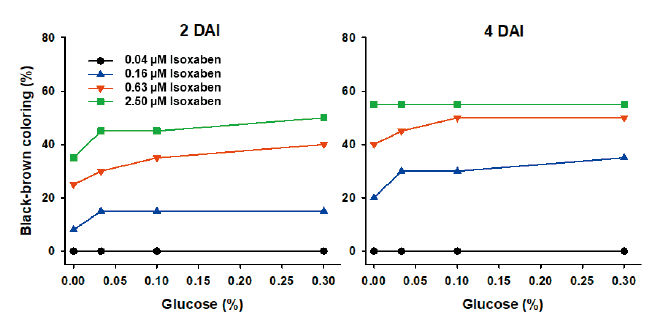
본 연구에서 몇 가지 요인에 대해 검토한 결과, 배양중의 광도와 배양액내에 glucose 첨가가 흑갈색 발현을 보다 증진시킨다는 사실을 발견하였다. Indaziflam을 처리한 광도실험의 경우, SPIPO 배양 광도가 낮을수록 흑갈색 발현정도가 낮은 경향을 보였는데(Fig. 5 and Fig. 6) 이는 광합성 작용에 의해 생산된 glucose가 셀룰로오스 생합성에 이용되는 것(광합성 정도)과 관련이 있을 것으로 생각된다. 그런데 indaziflam 고농도(2.5 nM)에서는 30-40 μmol m-2s-1보다 70-80 μmol m-2 s-1에서 오히려 흑갈변 정도가 낮았는데 이는 광도가 높아질수록 photoinhibition에 의한 생장저해가 동반되어(Wedge and Burris, 1982) 흑갈변 발현이 진전되지 못하기 때문으로 여겨진다. 따라서 흑갈변 증상을 지표로 하여 생물검정을 시도할 경우에는 30-100 μmol m-2s-1범위의 광도에서 실험하는 것이 바람직 할 것으로 여겨졌다(본 연구에서의 SPIPO는 100-150 μmol m-2s-1광도에 계대배양중인 식물이었음). 한편 glucose의 영향 실험에서는 기본 배지(MDM)에 glucose를 0.33%까지 추가할 경우, isoxaben에 의한 흑갈색 뱔현 정도가 농도에 의존하여 증가되었는데 그 정도는 배양 개시후 초기 1-3일째에 뚜렷하였으며 4일 이후에는 그 차이가 감소되었다(Fig. 7 and Fig. 8). 그런데 1% glucose 농도에서는 흑갈색 발현이 오히려 감소되는 경향을 나타냈다(데이터 제시 생략). 이는 glucose가 cellulose 생합성의 초기 기질성분 인 것과 관련이 있는 바, 적정농도까지의 glucose 첨가는 cellulose 생합성을 보다 활성화 시키기 때문에 CBI 처리로 인해 흑갈색소 침착이 증가되다가 glucose가 보다 높아지면 glucose 자체의 생리억제작용 때문에 각종 대사물질 생산이 중지되어 흑갈색 발현도 감소되는 것으로 추측된다. 이와는 반대로 ascorbic acid, hydrogen peroxide, atrazine, bensulfuron-methyl, oxyfluorfen 등의 화합물 처리에 의해서는 CBI (isoxaben, dichlorbenil, indaziflam)로 인한 초기의 흑갈색 색소침착이 오히려 감소되는 경향을 보였는데(데이타 제시 생략), 이들의 결과를 토대로 추정해 볼 때, 흑갈색 색소발현에는 glucose 생성정도, 항산화 효과, 세포생장속도(대사물질 생성정도)등과 깊은 연관이 있는 것으로 추정되었다.
흑갈색 발현의 정량 정성분석 방법
CBI로 인해 나타나는 독특한 증상인 흑갈색 발현을 어떻게 효율적으로 조사하느냐도 작용생리연구 및 생물검정과정상의 효율성에 중요한 역할을 할 것이다. 예비실험에서 흑갈색 침전물은 일반용매에는 용이하게 잘 추출되지 않았기 때문에 고온, 강산, 강알카리 등을 사용해서 색소추출을 시도해 볼 수도 있겠으나 이렇게 하면 다량의 시료를 안전하게 조사하기에는 어려움이 따를 것이다. 따라서 보다 간편한 작업을 통해서 정성 또는 정량분석할 수 있는 방안을 모색하고자 몇가지 방법을 시도해 보았다.
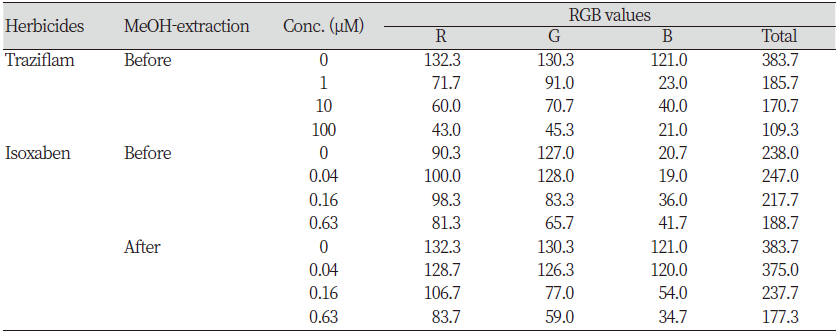
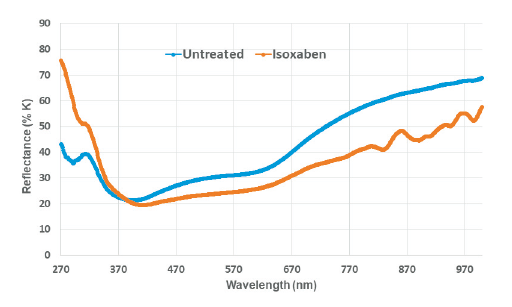
첫째, triaziflam 및 isoxaben을 처리하여 흑갈색이 발현된 SPIPO 엽상체를 가지고 메탄올로 색소를 추출하기 전후의 엽상체 사진을 대상으로 이미지 색상분석 도구를 활용하여 black-brown color 점유비율을 비파괴적으로 조사해 보았다. 색상을 RGB값으로 나타내어 이들을 합산해 보았을 때 약제 처리농도가 증가할수록 RGB 합산값이 낮아지는 경향을 나타내어 흑갈색 출현 정도가 증가됨을 나타내 주었다(Table 6). 둘째는 isoxaben이 처리되어 흑갈색이 유도된 SPIPO 엽상체를 메탄올에 침지하여 비파괴적으로 색소를 추출한 다음 이를 마쇄하여 얻은 파우더를 가지고 반사 스펙트럼(reflectance spectrum)을 조사해 보았다. 그 결과 흑갈색이 발현된 조직에서는 무처리의 백색조직에 비해 370 nm 이하의 반사율은 상대적으로 더 높고, 400 nm 이상의 스펙트럼에서는 상대적으로 낮은 반사값을 나타내었다. 그리고 800 nm 이상에서 몇 번의 굴곡패턴을 보임으로써 무처리 시료와 차별되는 스펙트럼을 보였다(Fig. 9). 셋째, indaziflam이 처리되어 흑갈색이 유도된 SPIPO 엽상체를 메탄올에 침지하여 비파괴적으로 색소를 추출한 다음 이를 1회용 cuvette 내벽에 시료를 부착하여 in vivo 흡광 스펙트럼을 조사해 보았다. 그 결과 흑갈색이 발현된 조직은 무처리의 백색조직에 비해 225-700 nm 파장대에서 흡광도가 전반적으로 상대적으로 더 높았다. 그 중에서 가장 큰 차이를 나타내는 파장대는 350-400 nm와 250-325 nm 이었다(Fig. 10). 넷째, isoxaben이 처리되어 흑갈색이 유도된 SPIPO 엽상체와 이를 메탄올에 침지하여 비파괴적으로 광합성 색소가 제거된 엽상체 조직을 각각 마쇄하여 파우더를 얻었으며 이를 가지고 FT-IR 스펙트럼을 조사해 보았다. 그 결과, 광합성 색소가 포함된 시료의 경우, isoxaben 처리에 의해 1067.9 cm-1 wavenumber에서의 피크가 형성되는 특징을 보였고(Fig. 11A), 한편 광합성 색소가 제거된 시료에서는 isoxaben 처리에 의해 1093.7과 1113.7 cm-1 wavenumber에서의 피크가 보다 높게 형성되는 특징을 보였다(Fig. 11B). 이들의 결과를 고려해 볼 때, CBI로 인해 나타나는 독특한 증상인 흑갈색 발현의 정성평가는 UV/VIS 분광광도계를 이용한 in vivo 흡광 스펙트럼과 반사스펙트럼, 또는 FT-IR 스펙트럼을 통해서 가능할 것으로 보였지만 이들의 방법을 가지고 정량평가를 하기에는 어려울 것 같았다. 그러나 이미지 색상분석 프로그램를 활용한다면 약제처리농도 증가에 따른 RGB 값의 차이를 가지고 어느 정도는 정량할 수 있을 것 같았으나 정밀한 결과를 얻기에는 한계가 있을 것 같았다. 따라서 흑갈변 증상의 지표는 CBI 활성을 정량적으로 나타내기보다는 CBI 여부의 판단, 즉 미지의 화합물이 CBI인지 여부를 분별하는데에 유용할 것으로 여겨졌다.
SPIPO를 이용한 새로운 in vivo CBI 검정법 확립
이상의 실험결과를 종합해 볼 때, 개구리밥(SPIPO)에서 CBI 처리에 의해 나타나는 고유의 증상은 다른 작용기작의 제초제 증상들과 쉽게 구별되기 때문에, 이들 현상과 제반 특징을 활용하면 CBI를 보다 간편하고 손쉽게 고효율로 선발하기 위한 유용한 수단으로 활용될 수 있을 것이다. 기본적인 프로토콜을 제안하면 Fig. 12와 같다.
○ 시험화합물을 DMSO 용매(0.5% Tween 20 함유)로 녹여 여러 농도의 stock solution을 준비한다.
○ 직경 52-36 mm, 높이 60 mm의 투명 플라스틱 원형컵에 glucose 0.1-0.3%가 포함된 MDM 용액 20 ml를 분주한 후 시험화합물 stock solution을 20 μL 첨가한다.
○ 계대 배양중인 개구리밥 중 생육 단계가 2.1-2.3 엽상체(frond)인 2개씩을 골라 각 원형컵에 접종한다. 접종이 완료된 원형컵을 플라스틱 박스에 옮겨 증발 방지용 투명 필름을 덮고 26±1℃의 생육실에서 14 시간의 광주기 및 30-100 μmol m-2s-1의 광도로 5일 동안 배양한다. 이 때 모든 실험은 비멸균 조건 하에서 수행한다.
○ 배양하는 동안 경시적으로 제초증상을 관찰하면서 배양개시후 1일째에 엽상체의 완전해체와 더불어 어린 분열조직을 중심으로 흑갈색 침착을 유도시키면서 근 선단부의 팽대를 일으키는 화합물을 선별한다. 배양 종료 후, 각 실험군에 대해 제초반응 사진을 촬영해 둔 다음 생체중, 건물중, 광합성 색소 등을 조사하고, 필요에 따라 잔존시료를 가지고 흑갈색 색소의 특징을 기기분석한다.
이상의 방법으로 검정하면 기존의 여러 가지 작용기작을 가진 화합물들로부터 CBI를 단기간에 저비용으로 손쉽게 선별할 수 있을 것으로 판단되었다. 그런데 본 지표로 검정하였을 때, oxyfluorfen, tiafenacil과 같은 protoporphyrinogen IX oxidase (PPO) 저해제는 SPIPO 엽상체 괴사와 함께 자색축적이 일어나 경험이 없거나 화합물 비교실험을 하지 않고서는 이들을 용이하게 구별하지 못할 수도 있다. 그렇지만 자세히 살펴보면 PPO저해제의 경우는 new frond의 탈색과 old frond에서의 외연부 중심의 갈변(자색화)이 주로 나타지만 CBI의 경우에는 반대로 new frond의 흑갈변, old frond에서의 분열부 중심의 흑갈변이 발현된다(Fig. 3). 그리고 이들 엽상체를 메탄올로 색소 추출했을 때 PPO저해제 처리 조직은 자색색소가 용매에 비교적 많이 추출되지만 CBI처리 조직에서는 흑갈색 색소는 거의 그대로 남아있는 경향을 보여(Fig. 3) 이를 통해 충분히 구별 가능하였다.
본 저자들은 특정의 일반종자(들깨, 자귀풀, 바질, 상추 등)를 가지고 유묘생장억제+하배축/뿌리 팽대+하배축/뿌리의 갈변이라는 세가지 지표를 기준으로 하여 CBI를 보다 손쉽게 선별할 수 있는 종자유묘생장법을 보고한 바 있다(Kim et al., 2020). 본 연구결과는 이들과 비교해 볼 때, 보다 단기간에 검정할 수 있다는 장점이 있지만 검정에 사용할 SPIPO의 계대배양을 지속적으로 수행해야한다는 불편함이 있다. SPIPO는 전세계에 널리 분포하는 가장 작은 식물 중 하나로 빠르게 생육하며(Gordon et al., 2001), 영양번식을 주로 하기 때문에 유전적/생리적 균일성이 우수하고 최근 유전체 해독이 완료되어 단자엽식물의 모델식물로써 활용될 가능성이 높다(Kim and Kim, 2020a; Wang et al., 2011; 2014). 그리고 현재 제초제의 독성 및 수생환경에 미치는 영향(Baudo et al., 2015; Cedergreen et al., 2004), 폐수 또는 하수에 포함된 중금속 및 유해물질의 생태독성 평가(Blinova et al., 2018; Samaneh, 2016; Xu et al., 2010), 신규제초활성물질 탐색을 위한 연구재료로 활용되고 있다(Kim et al., 2020). 따라서 본 연구의 검정법은 종자유묘생장법에 비하여 적용 보편성이 보다 우수하고, 보다 진전된 작용생리연구와의 연결성도 용이할 것으로 여겨지며 표현형을 기본으로 한 신규화합물 개발 전략(Dejonghe and Russinova, 2017)의 새로운 기법으로 활용될 수 있을 것으로 기대된다.
요 약
본 연구는 개구리밥(Lemnaceae)과 식물을 가지고 셀룰로오스 생합성 저해제(CBI)에서만 나타내는 특이적인 증상이 있는지를 파악하고, 이들 증상을 지표로 CBI를 단번에 분별할 수 있는 방법을 확립하고자 제반실험을 수행하였다. 그 결과, 같은 개구리밥과에 속할지라도 개구리밥(Spirodela polyrhiza, SPIPO)과 좀개구리밥(Lemna paucicostata, LEMPA)간에는 CBI에 대한 증상차이가 있었으며, 약제처리후 1일 이내에 신속히 발현되는 엽상체 해체와 엽상체 분열부 중심으로 발현되는 흑갈색 침착과 괴사를 나타내는 SPIPO에서의 증상이 다른 작용기작의 화합물들과(HRAC/WSSA group 3, 14, 15 등) 뚜렷하게 구분되는 CBI의 지표가 될 수 있음을 발견하였다. 엽상체의 흑갈변은 적당한 광도, glucose 처리에 의해 증진되었고, 메탄올과 같은 일반 용매에 의해서는 추출되지 않았다. 흑갈변 색소의 정성적 특징을 파악하고자 흑갈변색소가 침착된 조직을 가지고 FT-IR, UV-VIS, DU-UV/VIS spectra 등이 분석되었고, 흑갈변 정도의 간단한 평가를 위해서 RGB 색도분석 또는 육안평가가 추천되었다. 이들의 결과를 바탕으로 기존의 검정법에 비해 CBI를 보다 저비용으로 손쉽게 선별할 수 있도록 SPIPO를 이용한 in vivo one-step screening법을 확립하여 제안하였다.
주요어: 개구리밥, 셀룰로오스 생합성저해제, 제초제 작용기작별 특이적 증상, In vivo 생물검정