서론
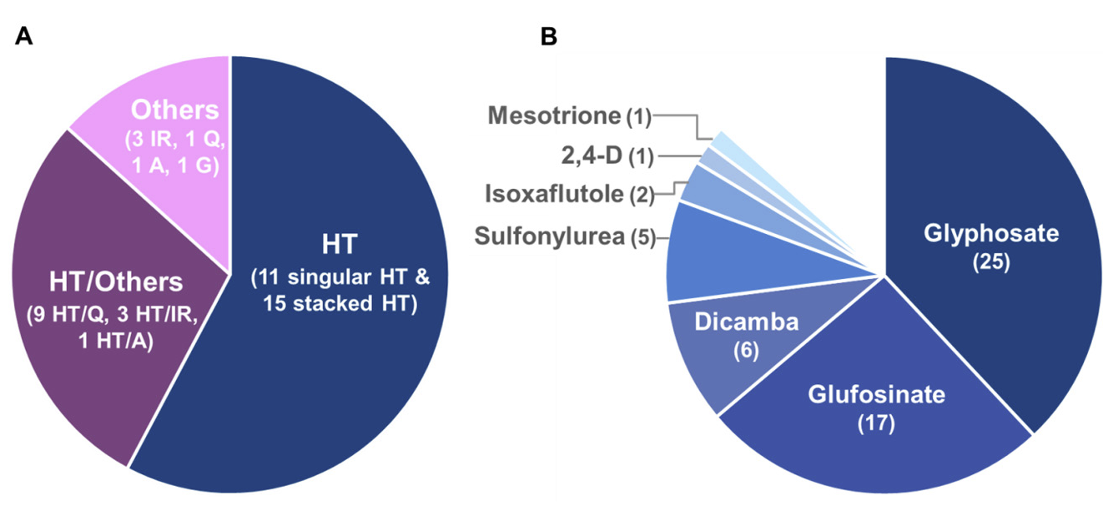
유전자변형(genetically modified, GM) 작물은 1996년 최초로 상업적 재배가 시작된 이래 작물 생산량과 재배 편의성을 획기적으로 증가시키고 작물보호제 사용을 감소시키는 데 기여해왔다. 특히 GM콩은 가장 성공적인 GM작물로서 지속적으로 재배면적이 확대되어 2019년에는 전세계 콩 생산지의 74%가 GM콩을 채택하여 GM작물 중 가장 넓은 9,190만 ha의 재배 면적을 차지하였다(ISAAA, 2019). GM콩의 상업적 승인도 꾸준히 증가하여 2023년 현재 EU 및 전세계 30개국에서 45건의 이벤트가 승인되었다. 이 중 86.7%의 이벤트는 제초제 내성 형질을 포함하는데 대부분에 비선택성 제초제인 glyphosate 또는 glufosinate 내성 유전자가 도입되었으며, 이외에도 옥신계인 dicamba와 ALS 저해제인 sulfonylurea 등 다양한 작용기작(mode of action)의 제초제 내성 유전자를 복합형질로 지닌 이벤트가 지속적으로 추가되고 있다(ISAAA, 2023; Fig. 1).
Fig. 1
Introduced traits of GM soybean in total approved events (A) and herbicide tolerance events (B) until 2023. HT, herbicide tolerance; IR, insect resistance; Q, modified product quality; A, abiotic stress tolerance; G, altered growth/yield. The values in parenthesis are number of events for each trait. The information used in the graph was extracted from the ISAAA database.
GM콩의 개발과 재배・유통 규모가 커지면서 환경유출 사고 역시 증가하고 있으며, 이에 따라 위해성 문제가 꾸준히 제기되고 있다(Price and Cotter, 2014). 지역별로 GM콩의 위해성을 평가하는 관점에 다소 차이가 있는데, 야생콩이 자생하지 않는 미국, 브라질, 유럽 등지는 GM콩의 환경방출에 따른 위해성보다는 종자 오염으로 인한 경제적 피해가 문제시되고 있다(Rostoks et al., 2019). 반면, GM콩과 자연교잡 가능한 일년생 야생콩인 돌콩(Glycine soja)이 자생하는 한국, 중국, 일본 등 동아시아 지역에서는 GM콩의 환경방출에 따른 생태계 교란과 생물종 다양성 감소에 대한 우려가 크다(Yook et al., 2021).
GM작물은 재배 및 이용 과정에서 다양한 경로로 환경에 방출될 수 있으며, 이후 GM작물 자체가 잡초화되거나 주변 근연종과 교잡하여 후대를 생산함으로써 도입유전자의 시공간적 확산이 가능하다(Liu et al., 2013; Fig. 2). 환경방출된 GM작물 또는 교잡후대가 잡초화되어 생태계 내 지속하려면 적응도가 클수록 유리하다(Lim et al., 2015). GM콩의 모본인 재배콩(Glycine max)은 종자의 휴면이 거의 없고 적응도가 낮아 다른 재배 식물이나 원래 식생과 경합하지 못하는데, 이러한 모본의 특성에 의해 GM콩 역시 낮은 적응도를 지니므로 환경방출된 GM콩 자체는 농업 및 자연 생태계 내에 지속하기 어렵다(Ko et al., 2016; OECD, 2000; Park et al., 2018). 그러나 화분을 매개로 GM콩과 야생콩이 교잡하여 생성된 교잡후대는 야생콩으로부터 유전적 배경을 획득하여 GM콩에 비해 더 높은 적응도를 지닐 것으로 예상된다(Park et al., 2018; Yook et al., 2021). 따라서 본 리뷰에서는 GM콩의 유전자이동성 연구와 교잡후대의 적응도 연구 결과를 종합하여 GM콩-야생콩 간 교잡후대가 생태계 내에서 잡초화될 가능성을 논하고자 한다.
GM콩의 유전자이동성
Glycine 속은 두 개의 아속, 즉 일년생 종이 속한 Soja 아속과 다년생 종을 아우르는 Glycine 아속으로 구성된다. Soja 아속에 속하는 재배콩(G. max)과 그의 직접적인 조상으로 여겨지는 일년생 야생콩 돌콩(G. soja) 및 반야생종인 G. gracilis는 2n = 4X = 40으로 염색체 수가 동일하고 유전체의 상동성이 높아 생식적 격리가 없으므로 자연교잡을 통해 정상적인 생육과 임성을 지닌 후대를 생산할 수 있다(Ratnaparkhe et al., 2010). 다만, 형태적으로 재배콩과 돌콩의 중간형인 G. gracilis는 유전적으로는 연구자에 따라 독립종으로 보기도 하고 돌콩의 변종으로 간주하기도 한다(Wu et al., 2001; Wang et al., 2015). Glycine 아속에 속한 26종의 다년생 야생콩은 38-80개의 염색체 수를 지니며, 형태나 유전적으로 높은 다양성을 보인다. 재배콩과 다년생 야생콩 사이의 교잡은 인공교잡이나 배 배양기술 없이는 거의 불가능하며, 인공적인 방법으로 교잡이 이루어지더라도 그 자손은 불량한 염색체 페어링으로 인해 임성을 지니지 못한다(Singh & Hymowitz, 1985; Singh et al., 1987). 따라서 GM콩의 유전자이동성 연구 사례 분석은 Soja 아속에 초점을 맞추어 수행되었으며, 비변형(non-GM) 재배콩은 재배콩으로 표기하였다. 선행 연구 사례를 종합하여 비교하고자 다양하게 표현된 유전자이동 지표(교잡율, 교잡 개체 수 등)를 교잡율(%)의 형태로 변환하였고, 품종이나 연차 등에 의한 편차가 있을 경우에는 최대 교잡율을 선택하여 표기하였다.
재배콩 및 야생콩의 종내교잡
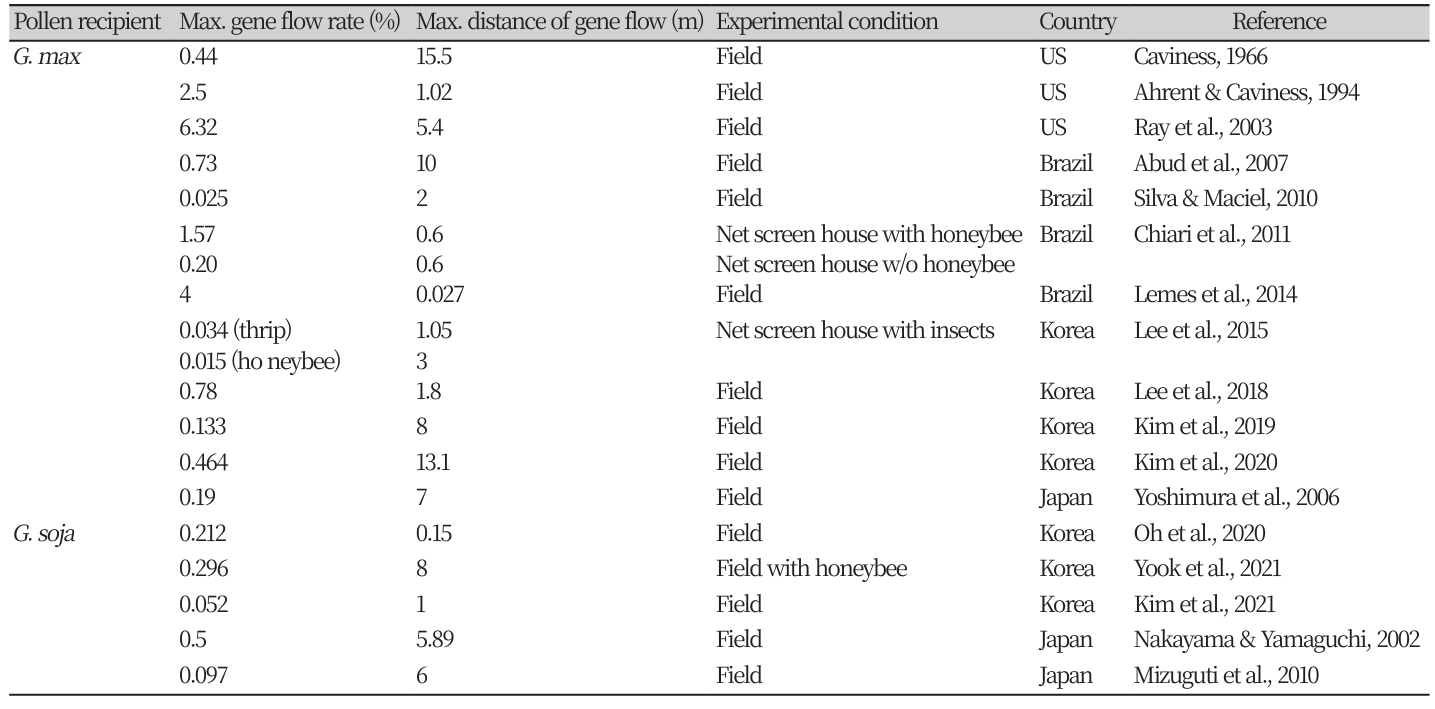
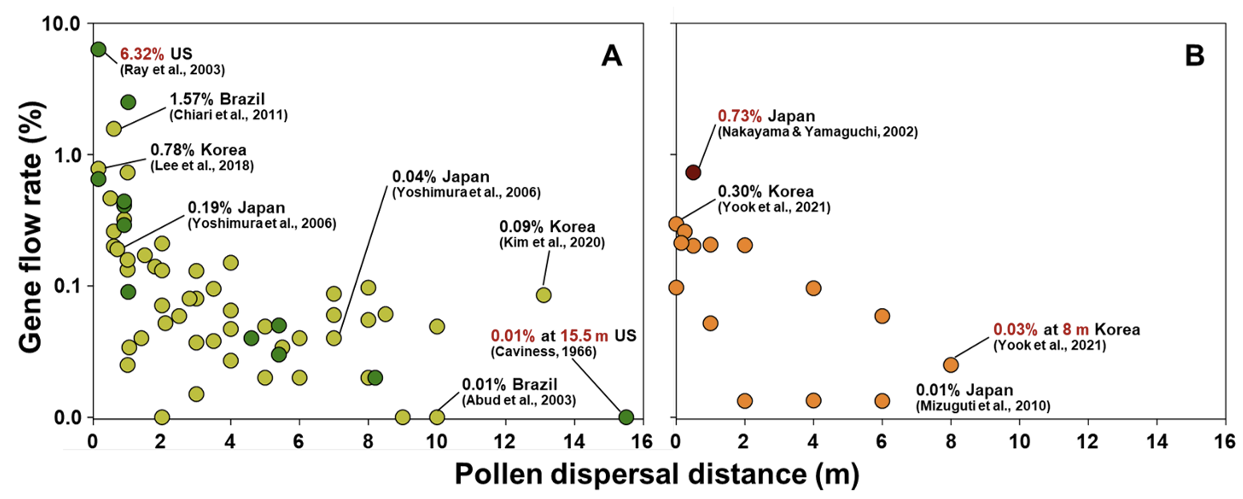
재배콩(G. max) 품종 간의 유전자이동성 연구는 미국, 브라질 등 주요 GM콩 재배・수출국과 Soja 아속의 기원지인 동북아시아 지역에서 수행되었으며, 이를 Table 1 및 Fig. 3A에 요약하여 제시하였다. 근접한 거리에서의 교잡율은 상대적으로 높았는데, 미국에서 약 15 cm 간격으로 교차 재식한 재배콩 품종 간 교잡율은 최대 6.32%에 달하였고 브라질에서는 GM콩으로부터 재배콩으로 1.57% (60 cm)의 유전자이동이 발생했다(Chiari et al., 2011; Ray et al., 2003). 조사된 연구 결과 중 가장 원거리에서 유전자이동이 발생한 경우는 미국에서 수행한 연구로 15.5 m 거리에서 0.1%의 교잡율을 보였다(Caviness, 1966). 한국과 일본에서는 각각 15 cm 거리에서 0.78%, 70 cm에서 0.19%의 최대 교잡이 발생하였고, 최장 13.1 m까지 유전자이동이 관측되었다(Kim et al., 2019; Lee et al., 2018; Yoshimura et al., 2006).
GM콩-재배콩 간 유전자이동에 미치는 수분매개자의 영향을 연구하고자 Yoshimura 등(2006)은 대기 중 화분을 포집하여 그 밀도가 매우 낮은 것을 확인하였고, Abud 등(2007)은 풍향에 따라 교잡율에 유의한 차이가 없으므로 풍매의 영향이 미미함을 밝혔다. 망실에서 수행한 유전자이동 실험에서는 수분매개충의 접근을 제한한 조건(0.20%)에 비해 꿀벌을 투입했을 때(1.57%) GM콩-재배콩 간 교잡율이 7배 이상 증가하였다(Chiari et al., 2011). 또한 Lee 등(2015)은 근거리(0.15~1.05 m)에서는 총채벌레가, 3 m 이상의 원거리에서는 꿀벌이 GM콩 화분을 매개했을 가능성을 제시하였다.
야생콩(G. soja) 간의 자연교잡율은 재배콩 간 교잡에 비해 상당히 높아 최대 19%에 달하였고, 야외포장 실험에서 최대 25 m까지 유전자이동이 발생하였다(Fujita et al., 1997; Kuroda et al., 2008). 중국의 Wang & Li (2012)는 Simple sequence repeat 마커를 활용하여 평균 0.7% (0~3.5%)의 야생콩 간 교잡율을 확인하였다. Kiang 등(1992)은 일본의 야생콩 자연집단에서의 평균 교잡율을 2.3%로 예측하였고, Fujita 등(1997)은 allozyme 변이를 통해 야생콩 집단의 유전적 구조를 분석하여 평균 13% (9.3~19%)의 자연교잡율을 제시하였다. 자생지에서 수집한 야생콩의 유전적 다양성을 분석한 연구에 따르면 한국 야생콩 집단은 다른 국가에 비해 높은 유전적 다양성을 지니므로 교잡율의 변이 폭도 클 것으로 예상된다(Kuroda et al., 2009; Lee et al., 2008).
재배콩으로부터 야생콩으로의 유전자이동성
GM콩으로부터 야생콩으로의 유전자이동성 평가는 드물게 수행되었다. GM콩-야생콩 간 교잡은 종간교잡이므로 교잡의 빈도가 매우 낮았다(Table 1). 재배콩과 야생콩 간 자연교잡에서는 개화기 일치 여부가 가장 큰 제한요인으로 작용하기 때문에 연구자들은 GM콩 또는 야생콩을 여러 번 파종하여 개화 시기를 중첩시키고자 하였다. 이러한 노력에도 불구하고 Mizuguti 등(2010)의 야외포장실험에서는 GM콩과 야생콩의 개화기 차이가 커서 혼합 재배구(0 m)에서도 0.097%의 매우 낮은 교잡율을 확인하였다. 심지어 개화 기간이 충분히 중첩된 경우에도 전혀 교잡후대를 얻지 못한 연구 사례도 있었다(Kim et al., 2019; Kim et al., 2021). 다만, GM콩과 야생콩의 거리가 멀어질수록 유전자이동이 감소하는 경향은 유지되었다(Fig. 3B). 조사된 모든 연구 사례 중 재배콩과 야생콩을 0.5 m 간격으로 교차 재식한 포장 실험에서 최대 0.73%의 교잡이 발생하였고(Nakayama & Yamaguchi, 2002), GM콩의 유전자이동은 최대 8 m까지에서 확인되었다(Yook et al., 2021).
한편, 재배콩 재배지 및 포장 경계에 인접한 야생콩 자연집단에서 각각 종자를 수집한 뒤 이를 실험포장에 전개하여 유전자이동을 평가한 결과, 화분공여자가 재배콩 또는 야생콩일 경우 각각 2.22%, 0.20%의 교잡이 확인되었다(Wang & Li, 2011). 이러한 교잡율 차이는 재배콩의 개체 수가 압도적으로 많기 때문에 나타난 것으로 보이며, 농업생태계에서 재배콩-야생콩 간 상호교잡(reciprocal cross)이 가능함이 증명되었다. 한편, 재배콩을 G. gracilis, G. soja와 상호교잡 시켜 얻은 교잡1세대(F1)는 모두 정상 임성을 지녔으며 중간형인 G. gracilis와의 교잡율이 G. soja와의 교잡율보다 높았다(Singh & Hymowitz, 1989).
선행 연구 결과를 종합하면, GM콩으로부터 재배콩 또는 야생콩으로의 유전자이동성이 확인되었다. 화분원 규모와 거리, 교배친의 유전자형, 개화기 중첩, 수분매개충 유무 등 다양한 요인에 의해 유전자이동성의 변이가 컸으며, 이는 방출 환경 조건에 따라 정도는 다르지만 GM콩으로부터 야생콩으로의 유전자이동 위험성이 있음을 시사한다.
GM콩-야생콩 간 교잡후대의 적응도 변화
적응도(fitness)란 생물이 선택압력 하에서 생존하여 번식하는 상대적인 능력을 의미한다(Jenczewski et al., 2003). 야생콩이 자생하는 동북아시아 지역에서 GM콩-야생콩 간 교잡후대가 잡초화되려면 가을에 탈립된 종자가 토양 중에서 휴면 상태로 월동하고, 이듬해 봄에 발아한 뒤 생활환을 따라가며 생존 및 세대진전 할 수 있어야 한다(Park et al., 2018; Fig. 2). 본 장에서는 콩의 주요 생육단계에서 적응도와 관련된 특성들을 평가하여 GM콩-야생콩 간 교잡후대의 적응도가 부모종에 비해 어떻게 변화하는지 연구한 사례들을 요약하여 제시하였으며, 보다 풍부한 정보를 얻고자 재배콩-야생콩 간 교잡후대를 대상으로 수행한 연구를 포함하였다(Table 2).
Table 2
Current status of studies on fitness changes in hybrids resulted from pollen-mediated gene flow between GM/non-GM Glycine max and G. soja..
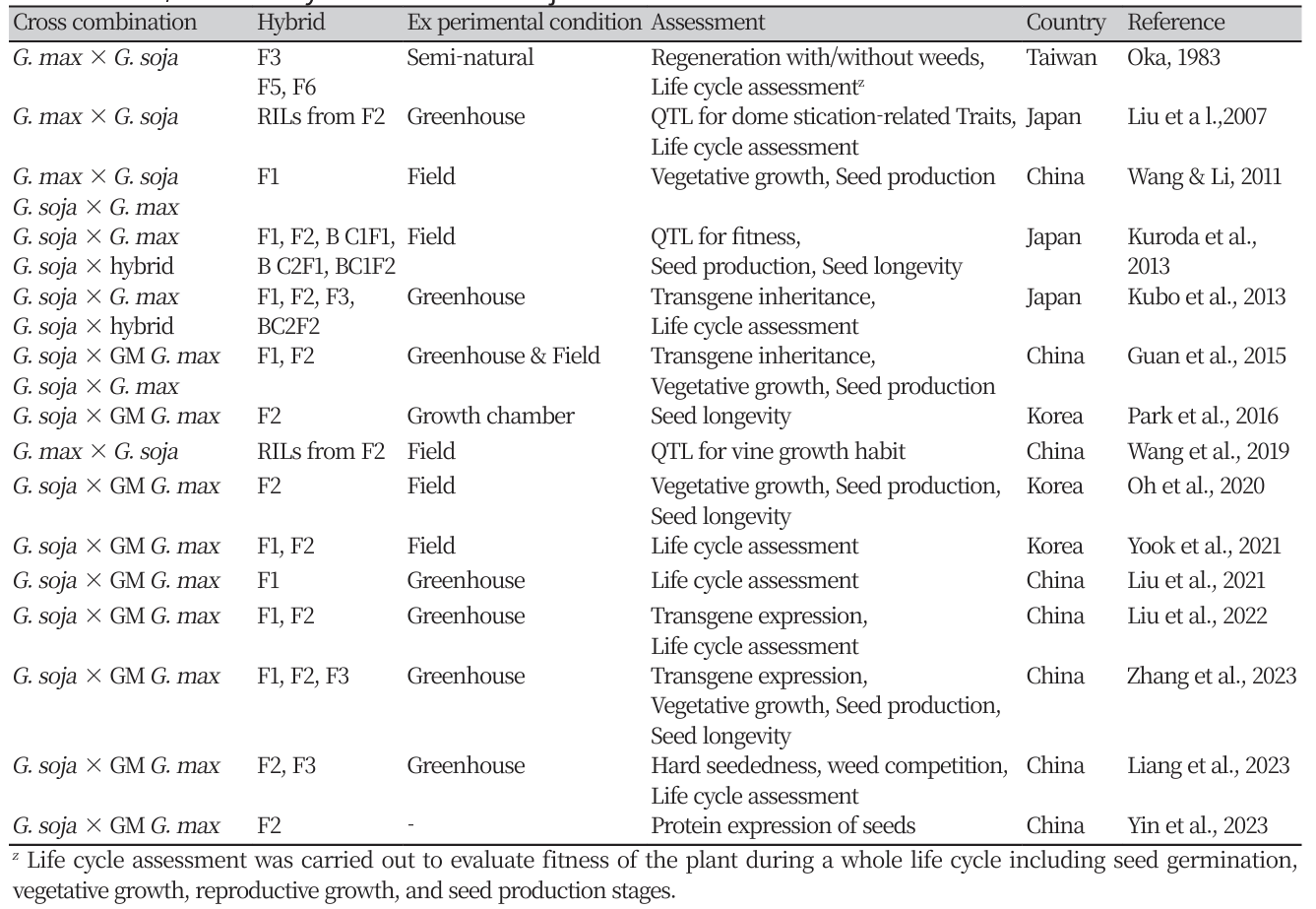
교잡후대의 생육단계별 적응도 연구
GM콩은 휴면이 거의 없는 반면, 야생콩은 두꺼운 종피로 인한 불투성으로 높은 휴면성을 지니고 있다. 한국과 일본에서 수행된 연구에 따르면, 대부분 교잡 2세대(F2) 종자는 중간 정도의 월동휴면성을 지니고 있었으며(Kuroda et al., 2013; Oh et al., 2020; Park et al., 2016; Yook et al., 2021), Kubo 등(2013)은 F2의 월동휴면성이 모본인 야생콩과 유의한 차이가 없다고 보고하였다. 한편, 야생콩을 여교배친으로 하여 얻은 BC1F2과 BC2F2 종자는 야생콩과 유사한 수준까지 월동휴면성이 증가하여 단 한 번의 여교배만으로도 교잡후대의 적응도가 높아질 수 있음을 시사하였다(Kubo et al., 2013; Kuroda et al., 2013).
GM콩은 유한신육형의 생장습성을 가지고 있으며, 직립형의 초형에 줄기가 두껍고 잎이 넓어 광 이용 효율이 높은 형태를 지닌다. 야생콩은 무한신육형으로 줄기가 가늘고 절간 길이가 길며 덩굴을 형성하는 것이 특징이다(Ohara & Shimamoto, 1994; Park et al., 2018). 이종 간 교잡후대의 영양생장특성은 전반적으로 부모종의 사이에 위치하거나 부모에 비해 다소 우세하였다. Oka (1983)는 재배콩-야생콩 간 교잡후대를 F6까지 전개하였는데 모든 교잡후대가 덩굴을 형성하였으며, 마찬가지로 조사된 연구 사례의 모든 교잡후대종이 덩굴을 형성하였다. 교잡1세대의 초관장, 초장, 경경, 엽면적은 모두 모본인 야생콩에 더 가까웠으나 세대가 진전함에 따라 F2는 잎이 커지고, 줄기가 두꺼워지는 등 부본인 GM콩의 특성을 많이 회복하였다(Yook et al., 2021). 재배콩과 야생콩 간 상호교잡에서 얻은 두 종류의 F1은 부모종보다 우세한 지상부 바이오매스를 나타냈고(Wang & Li, 2011), F2와 F3에서도 유사한 결과를 얻었다(Guan et al., 2015; Liu et al., 2022; Zhang et al., 2023). 이는 교잡후대가 획득한 야생콩의 무한신육 특성과 재배콩의 넓은 엽면적 특성이 상승 작용한 결과이다.
야생콩으로부터 유래한 무한신육형의 생장습성은 교잡후대의 생식생장특성 변화에도 큰 영향을 주었다. Yook 등(2021)은 F1, F2와 부모종의 화기 수를 비교하여 교잡후대의 화기 수가 GM콩에 비해 3배 이상 증가한 것을 확인하였는데, 화기 수는 꼬투리 형성 및 종자 생산과 밀접한 관련이 있으므로 교잡후대의 높은 종자 생산 가능성을 제시하였다. 교잡 후 초기세대(F1)의 화분 활력은 부모종에 비해 유의하게 감소하였으며, 감소 폭에는 변이가 있으나 모본으로 사용된 야생콩 대비 8~45%가 감소하였다. 그러나 여전히 50% 이상의 화분은 정상적인 임성을 나타내어 화분에 의한 유전자이동 가능성이 존재하였다. 또한 감소된 F1의 화분활력은 세대를 진전하며 빠르게 회복되어 F2에서는 모본인 야생콩 수준의 화분활력을 나타냈다(Liu et al., 2022; Yook et al., 2021).
교잡후대의 종자 크기는 연구에 따라 편차가 있었는데 F1 식물체에서 수확한 종자의 백립중은 대체로 모본인 야생콩 수준과 비슷하거나 약간 낮았으나(Liu et al., 2021; Yook et al., 2021; Zhang et al., 2023), 부본의 종류에 따라 증가하기도 하였다(Guan et al., 2015; Kuroda et al.,2013). 같은 연구에서 F2, F3 식물체로부터 얻은 종자의 백립중은 모두 증가하여 부모종의 사이에 위치하였으며 야생콩에 더 가까웠다. 재배콩은 종자 내 저장 양분이 많아 발아 후 초기 생장 속도가 빠르므로, 교잡후대의 종자 크기 증가는 생육 초반의 적응도를 높이는데 일조할 것으로 예상된다. 교잡후대의 개체 당 종자 수는 야생콩에서 유래한 무한신육 특성에 따라 증가하는 양상을 보였다. 야외포장 실험에서 F1 및 F2의 식물체 당 종자 수가 야생콩과 통계적으로 유사했으며 이는 재배콩에 비해 3배 이상 많은 수치였다(Yook et al., 2021). 온실 조건에서 수행한 여러 연구에서 F1의 종자 생산량은 적었으나, 세대진전하며 종자생산성이 크게 증가하여 F2와 F3 식물체가 생산한 종자는 야생콩 수준으로 많았다(Liang et al., 2023; Liu et al., 2021; Zhang et al., 2023). Kuroda 등(2013)은 다양한 교잡후대(F1, F2, BC1F1, BC1F2, BC2F1)에서 생산된 종자수량은 부모종에 비해 크다고 보고하였는데, 앞서 제시한 연구 사례들의 식물체 당 종자 수와 백립중으로 종자수량을 계산하여 유사한 결과를 얻을 수 있었다. 재배콩은 순화 과정에서 탈립성이 낮은 방향으로 선발되어 왔기 때문에 탈립성이 매우 낮은 반면, 야생콩의 탈립율은 80% 이상으로 높다. 교잡후대 F2, F3 및 F5 식물체는 부모종의 중간 정도의 탈립성을 지니고 있어 GM콩에 비해 토양 중으로 유입될 가능성이 높다(Liu et al., 2007; Oka, 1983; Yook et al., 2021).
한편, Liu 등(2022)은 F2에서 도입유전자의 분리에 따른 3가지 유전자형(RR, Rr, rr)의 적응도를 평가하여 유전자형이 다른 집단 간에 유의한 차이가 없다고 보고했는데, 이는 교잡후대의 적응도 변화가 도입유전자에 의한 것이 아니라 부모종의 유전적 배경으로 인한 것임을 시사한다.
다른 잡초와의 경합능력
Oka (1983)는 재배콩-야생콩 간 교잡후대의 생태계 내에서의 지속성을 평가하고자 세 가지 조건의 야외포장(A, normal field; B, weedy field; C, weedy margin)에서 3년 간의 세대진전 실험을 수행하였다. A, B포장은 경운 후, C포장은 경운하지 않은 상태 그대로 F3를 재식하였고 이후 인위적인 관리를 하지 않은 채로 F3 개체들의 생존율, F4 및 F5로의 세대진전을 조사하였다. 그 결과 A, B 포장에서는 F3 개체가 100% 생존하였으나 C포장에서는 평균 19%만 생존하였다. 이듬해부터 본래 식생을 구성하고 있는 잡초종과 본격적인 경합이 벌어졌는데, A와 B포장은 주로 일년생 쌍자엽 잡초가 발생하였고 우점종은 망초류(Erigeron species)와 쇠뜨기(Equisetum arvense)였다. 자연식생인 C포장은 잡초종의 다양성이 더 높았고 바이오매스의 72% 가량을 다년생 잡초가 차지하였으며, 우점종은 쑥(Artemisia princeps)이었다. 세 가지 포장에서 발생한 2년차의 F4 개체 밀도와 3년차 F5 개체 밀도를 비교했을 때 평균적으로 62%가 감소하여 대조종인 야생콩(23%)에 비해 낮은 적응도를 보였으며, 특히 C포장의 경우 교잡후대는 91%, 야생콩은 83%의 발생이 감소하였다. 이를 통해 GM콩과 비교했을 때 교잡후대의 적응도는 월등히 높아지나 자연생태계 내의 원식생에 비해서는 적응도가 상대적으로 낮음을 알 수 있다.
온실 조건에서 교잡후대 F2, F3과 4종의 잡초종(Digitaria sanguinalis, Echinochloa colona, Eleusine indica, Setaria viridis)을 혼합 파종하여 경합력을 평가한 결과, 교잡후대가 모본인 야생콩보다 높은 적응도를 보였으며 잡초에 대한 경합력도 컸다(Liang et al., 2023). 이는 Oka (1983)의 연구와 다소 상반된 결과이지만 경합에 사용된 초종이 모두 화본과였고, 종자 상태로 새로운 토양에 투입된 것이므로 초기 생육 조건이 GM콩-야생콩 간 교잡후대에 유리한 조건이었기 때문일 것으로 사료되며, 식생의 구성에 따라 교잡후대의 상대적인 적응도가 달라질 수 있음을 시사한다. 또한 자연생태계 내에 야생콩이 생육하고 있을 경우 유전자이동에 따른 새로운 교잡후대 형성과 잡초화 가능성은 여전히 존재할 것으로 판단된다.
오믹스를 활용한 적응도 연구
오믹스를 활용한 적응도 연구
Yin 등(2023)은 GM콩-야생콩 교잡후대의 적응도 변화를 설명하기 위하여 F2와 부모종 종자에서 단백질을 검출하고 영상화하여 비교하였다. 분석 결과 종자 내 당과 지방의 저장량을 늘리는 역할을 하는 자당합성효소는 GM콩과 F2에서만 검출되어 F2의 종자 크기 증가를 설명할 수 있었다. 한편, 야생콩 종자에서 많이 발현되는 방어기작과 관련된 단백질은 F2 종자에서 검출되지 않아 F2의 적응도가 야생콩보다 낮을 가능성을 제시하였다.
결론
본 리뷰에서는 GM콩-야생콩 간 교잡후대의 잡초화 가능성에 영향하는 주요 요인인 GM콩의 유전자이동성과 교잡후대의 적응도에 대한 다양한 연구 사례를 수집∙분석하여 제시하였다. GM콩은 같은 Soja 아속에 속하는 일년생 야생콩과 낮은 빈도지만 자연교잡이 가능하며, 일단 교잡후대가 생성된 후에는 자식, 여교배를 통해 세대진전할 가능성이 크다. GM콩-야생콩 간 교잡후대는 야생콩에서 유래한 높은 휴면성과 탈립성, 무한신육형 생장습성에 의해 GM콩에 비해 월등히 높은 적응도를 획득한다. 이에 더해 GM콩의 영향으로 엽면적과 종자 크기가 증가하여 지상부 바이오매스, 종자 생산성이 양친보다 우세하게 될 가능성이 크다. 다만 교잡후대의 적응도가 GM콩에 비해 높더라도 자연생태계의 원식생과의 경합력은 식생의 구성에 따라 큰 차이를 보이며, 특히 다년생 광엽잡초가 우점한 식생과 경합하여 잡초화되기에는 충분치 못하다고 판단된다. 그럼에도 불구하고 자식하는 교잡특성에 의해 교잡후대가 세대를 거듭하며 유지 확산되어 생태계에 지속할 우려가 있다. 또한 교잡후대가 자연생태계 내에 자생하는 야생콩과 교잡하면 적응도가 더욱 강화된 새로운 교잡후대를 형성하여 잡초화 될 가능성이 크다.
본 리뷰에서는 GM콩-야생콩 간 교잡후대의 잡초화 가능성에 영향하는 주요 요인인 GM콩의 유전자이동성과 교잡후대의 적응도에 대한 다양한 연구 사례를 수집∙분석하여 제시하였다. GM콩은 같은 Soja 아속에 속하는 일년생 야생콩과 낮은 빈도지만 자연교잡이 가능하며, 일단 교잡후대가 생성된 후에는 자식, 여교배를 통해 세대진전할 가능성이 크다. GM콩-야생콩 간 교잡후대는 야생콩에서 유래한 높은 휴면성과 탈립성, 무한신육형 생장습성에 의해 GM콩에 비해 월등히 높은 적응도를 획득한다. 이에 더해 GM콩의 영향으로 엽면적과 종자 크기가 증가하여 지상부 바이오매스, 종자 생산성이 양친보다 우세하게 될 가능성이 크다. 다만 교잡후대의 적응도가 GM콩에 비해 높더라도 자연생태계의 원식생과의 경합력은 식생의 구성에 따라 큰 차이를 보이며, 특히 다년생 광엽잡초가 우점한 식생과 경합하여 잡초화되기에는 충분치 못하다고 판단된다. 그럼에도 불구하고 자식하는 교잡특성에 의해 교잡후대가 세대를 거듭하며 유지 확산되어 생태계에 지속할 우려가 있다. 또한 교잡후대가 자연생태계 내에 자생하는 야생콩과 교잡하면 적응도가 더욱 강화된 새로운 교잡후대를 형성하여 잡초화 될 가능성이 크다.
요약
유전자변형 콩과 야생콩 간 자연교잡은 도입유전자가 생태계로 확산되는 시발점이 되어 교잡후대의 잡초화를 유도하고 궁극적으로 자생하는 야생콩의 유전적 오염을 유발한다. 본 리뷰는 GM콩-야생콩 간 교잡후대의 잡초화 가능성에 대한 이해와 관리전략 수립을 위한 정보를 제공하고자 수행되었으며, 이를 위해 GM콩의 도입유전자 이동성 연구와 교잡후대의 적응도 연구 사례를 수집・분석하여 고찰하였다. 재배콩은 직접적인 조상인 야생콩과 종간 교잡이 가능하며, 최대 교잡율은 0.73%, 최대 유전자이동 거리는 8 m로 보고되었다. GM콩-야생콩 간 교잡후대는 야생콩에서 유래한 형질에 의해 GM콩에 비해 월등한 적응도를 보였다. 교잡후대의 종자 휴면성, 영양생장특성, 생식생장특성은 대부분 부모종의 중간 정도였고, 지상부 바이오매스와 종자생산성은 부모종보다 우세하였다. 특히, 세대가 진전하며 교잡후대의 적응도가 증가하는 양상을 보이므로 GM콩의 환경방출사고 발생 시에는 초기 관리가 매우 중요하다. 또한 GM콩-야생콩 간 교잡후대가 자연생태계로 유입되었을 때에는 원식생의 구성에 따라 상대적인 경합력을 지니므로 한국을 비롯한 동아시아국가와 같이 야생콩이 자생하는 경우 교잡후대의 자가수분이나 다른 야생콩으로의 후속적인 유전자이동에 의해 잡초화될 가능성은 여전히 존재한다.