서 언
골프장의 잔디관리에서 미생물을 이용하는 것은 토양관리 및 잔디품질관리에 유용하게 이용될 수 있다(Kim et al., 2008). 토양 중에서 미생물은 유기물을 분해하고, 대취발생을 감소시키며, 토양 중 불용화된 양분을 가용화하는 등 토양의 이화학성을 개선할 뿐 아니라 식물생장촉진물질을 분비하여 잔디의 생육과 품질을 증대시킬 수 있다(Kim et al., 2019). 또한 근권에 존재하는 병원균과 길항성을 나타내거나 항진균 활성을 나타내어 잔디의 병해 발생을 억제하기도 한다(Ma et al., 2013). 최근 친환경적인 잔디관리가 이슈화되면서 유용미생물을 이용한 잔디 생육 및 병해 관리에 관한 요구도가 증가하고 있다(Kim et al., 2019).
유용미생물은 토양, 식물 및 부산물 등 다양한 원료로부터 유기물을 분해하는 효소활성, 식물생육 촉진 호르몬의 발생 및 병원균과의 길항성 등을 조사하여 선발하였다(Jeong et al., 2017; Kim et al., 2011b; You et al., 2011). 이러한 과정을 통해 선발된 미생물은 미생물학적 특성, 식물과의 상호작용 및 식물병원균과의 길항기작 등을 고려하여 제형화 과정을 거친 후 식물에 적용된다(Kim et al., 2015; Kim et al., 2021a). 친환경적인 잔디관리를 위해 미생물의 이용에 대한 요구는 증대되고 있으며, 잔디 생육 촉진뿐 아니라 병해 방지를 위해 이용하고 있다(Kim et al., 2019). 그러나 골프장은 주로 모래 토양으로 구성되어 토양 유기물이 낮고 태양광에 직접 노출되고 있으며, 토양수분의 변화가 크기 때문에 농약에 비해 환경조건에 대한 안정성 및 방제효과가 낮다(Kim et al., 2011b; Ku et al., 2021).
미생물의 병해 방지 효과를 개선하고, 환경 중 유기합성농약의 사용을 줄이기 위해 미생물비료와 유기합성농약을 혼용하여 사용하고자 하는 연구가 진행되었다. 작물의 경우는 고추 흰가루병(Hong et al., 2014), 고추 역병(Hong et al., 2013) 및 오이 흰가루병과 노균병(Kim et al., 2011a)에서 미생물과 살균제를 혼용하여 처리하는 경우 병해 발생이 감소하는 결과를 나타냈다. 이러한 결과는 잔디의 라이족토니아마름병 방제에서도 미생물비료와 살균제를 혼용하는 경우 약효 지속 기간이 증대되었고(Shim et al., 1997), 추천 반량에서도 추천량과 유사한 방제효과를 나타냈다(Kim et al., 2021b). 미생물비료와 살균제를 혼용하여 사용하기 위해서는 혼용 시 미생물의 효력을 검정하는 것이 중요하다(Shin et al., 2006).
토양 중에서 분리된 Bacillus subtilis SA-15는 토양의 유기물 분해능이 우수할 뿐 아니라 식물의 각종 병해에 대한 길항성을 나타냈다(Ahn, 2014). Kim et al. (2021b)은 B. subtilis SA-15이 식물병원균에 대해 길항성을 나타내는 것은 항진균 물질을 발생시켜 병원균의 균사생장을 억제하기 때문이며, 한국잔디에 처리하는 경우 방제효과를 나타내고, 농약과 혼용 시 상승효과가 나타난다고 보고하였다. 따라서 본 연구는 라이족토니아마름병의 방제효과를 나타낸 B. subtilis SA-15가 다른 잔디 병원균에 대한 항균력을 평가하고, 농약과 혼용하는 경우 미생물의 효력유지 여부를 검정하고자 시험을 수행하였다.
재료 및 방법
공시재료
연구에 이용된 미생물은 Kim et al. (2021b)의 연구에서 사용한 Bacillus subtilis SA-15를 유효균주로 하는 미생물비료(B. subtilis 1.0 × 109 cfu g-1; Hyosung O&B Co., Ltd., Asan, Korea)를 효성오앤비㈜로부터 공여받아 사용하였고, 농약은 살균제 3종과 살충제 2종을 구매하여 사용하였다. B. subtilis SA-15의 항균력 시험을 위해 사용된 병원균은 Sclerotinia homoeocarpa, Rhyzoctonia solani AG2-2 (IV) 및 R. solani AG2-2 (IIIB)였다. S. homoeocarpa는 SKY72 골프장에서 식재된 켄터키 블루그래스에서 분리하여 병원성 검정실험을 통해 접종 후 발병된 개체로부터 재분리하여 얻은 균주이며, no.40132 R. solani AG2-2 (IV)와 no.40151 R. solani AG2-2 (IIIB)는 KACC (Korean Agricultural Culture Collection)에서 분양 받아 실험에 이용하였다. 연구에 사용한 살균제는 펜사이큐론 액상수화제(pencycuron 25%, FarmHannong, Seoul, Korea), 플루톨라닐 유제(flutolanil 15%, Kyungnong, Seoul, Korea), 테부코나졸 유제(tebuconazole 25%, FarmHannong, Seoul, Korea) 및 테부코나졸 수화제(tebuconazole 25%, Bayel Crop Science, Seoul, Korea) 등을 사용하였다. 살충제는 클로르피리포스메틸 유제(chlorpyrifos-methyl 20%, FarmHannong, Seoul, Korea), 페니트로치온 유제(fenitrothion 50%, Dongbangagro, Seoul, Korea) 및 페니트로치온 수화제(fenitrothion 40%, Dongbangagro, Seoul, Korea) 등을 사용하였다.
B. subtilis SA-15의 잔디 병원균에 대한 항균력 조사
미생물비료에 포함된 유효 균주별 잔디병원균에 대한 생육억제여부를 검토하기 위해 항균력을 조사하였다. 미생물비료에서 순수 분리된 유효 균주 배양액을 paper disk에 20 μL씩 점적한 후 potato dextrose agar (PDA)배지 가장 자리에 치상하였고, 잔디병원균은 5 mm cork borer를 이용하여 균일하게 자른 후 중앙에 치상하였다. 25℃ 배양기에서 3-5일간 배양한 후 병원균의 균사생장억제율을 측정하였다. 균사생장억제율은 미생물 처리구의 병원균 균사생장길이와 대조구의 균사생장길이를 조사하여 아래의 식으로 계산하였다.
균사생장억제율(%)=(1-미생물 처리구의 균사생장길이 / 대조구의 균사생장길이)×100 (1)
살균제 혼용 후 B. subtilis SA-15의 효력 검정
살균제와 미생물비료 혼용 후 B. subtilis SA-15의 효력을 검정하기 위해 혼합 경과시간에 따른 생균수 변화를 조사하였다. 살균제는 B. subtilis SA-15가 방제효과를 나타냈던 라이족토니아마름병에 사용하는 살균제 중 펜사이큐론(pencycuron), 플루톨라닐(flutolanil) 및 테부코나졸(tebuconazole)을 선정하였다. 살균제는 작물보호제 지침서에 준하여 플루톨라닐 유제와 펜사이큐론 액상수화제는 멸균수에 각각 1,000배로 희석하여 각각 150 mg L-1과 250 mg L-1의 시험용액을(KCPA, 2022), 테부코나졸 유제와 수화제는 2,000배 희석하여 125 mg L-1의 시험용액을 만들고, 여기에 미생물비료를 1,000배 희석하여 미생물비료 1.0 g L-1의 혼합시험용액이 되도록 조제하였다. 살균제와 미생물비료의 혼합액은 25℃로 조절된 항온배양기(JSMI-02C, JSR, Gongju, Korea)에서 각각 0, 1, 2, 4 및 24시간씩 정치시켰다. 클린벤치에서 100 μL 혼합액을 nutrient agar (NA) 배지에 스프레딩하고 30℃로 조절된 항온배양기에서 48시간 배양 후 생균수를 조사하였다.
살충제 혼용 후 B. subtilis SA-15의 효력 검정
살충제와 미생물비료 혼용 후 B. subtilis SA-15의 효력을 검정하기 위해 살균제와 같이 처리후 생균수 변화를 조사하였다. 살충제는 라이족토니아마름병 발병 전후에 발생가능성이 있는 풍뎅이 유충의 방제를 위해 사용했던 페니트로치온(fenitrothion)과 클로르피리포스메틸(chlorpyrifos-methyl)을 선정하였다. 선정된 살충제는 작물보호제 지침서에 제시된 사용방법에 준하여 페니트로치온 유제, 페니트로치온 수화제 및 클로로피리포스메틸 유제는 멸균수에 각각 1,000, 800, 및 1,000배로 희석하여 fenitrothion과 chlorpyrifos-methyl은 각각 500 mg L-1와 200 mg L-1고(KCPA, 2022), 이 액에 미생물비료를 1,000배 희석하여 미생물비료 1.0 g L-1의 혼합시험용액이 되도록 조제하였다. 살충제와 미생물비료의 혼합액은 25℃로 조절된 항온배양기(JSMI-02C, JSR, Gongju, Korea)에서 각각 0, 1, 2, 4 및 24시간씩 정치시켰다. 클린벤치에서 100 μL 혼합액을 NA 배지에 스프레딩하고 30℃로 조절된 항온배양기에서 48시간 배양 후 생균수를 조사하였다.
결과 및 고찰
미생물비료 유효균주의 잔디병원균에 대한 항균력
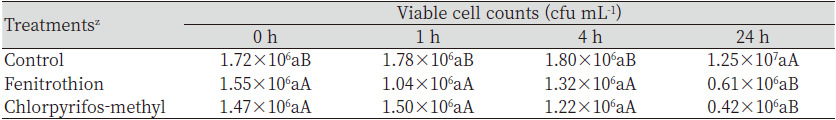
미생물비료 유효균주인 B. subtilis SA-15의 잔디에 발생하는 주요병원균(R. solani AG 2-2 [III B], brown patch; R. solani AG 2-2 [IV], large patch; S. homoeocarpa, dollar spot)을 대상으로 항균력을 조사한 결과 모든 병원균에 대해 항균력을 나타냈다 (Fig. 1). B. subtilis HS-B1의 균사생장 억제율은 R. solani AG 2-2 (III B), R. solani AG 2-2 (IV) 및 S. homoeocarpa에서 각각 62.3, 63.3, 58.0%로 조사되어 잔디병에 대해 생물학적 방제를 위해 사용할 수 있을 것으로 판단되었다. 부숙유기질 비료에서 선발된 Bacillus spp.에서도 R. solani AG 2-2 (III B), R. solani AG 2-2 (IV), S. homoeocarpa 및 Pythium spp. 등에 대해 항균력을 나타내는 것으로 잘 알려져 있다(Jeong et al., 2017; Lim et al., 2011). B. subtilis SA-15는 작물 병원균에 대해 다양한 길항성을 나타내고 있으며(Ahn, 2014), 잔디의 라이족토니아마름병에 대해 항균력을 나타내고 병방제효과를 나타냈다(Kim et al., 2021b). Kim et al. (2021b)은 B. subtilis SA-15이 lipopeptide계열의 휘발성 항진균 물질인 fengycin을 생성하기 때문이라고 보고하였다. Fengycin과 같은 휘발성 항진균 물질을 생성하는 Bacillus spp.는 다양한 식물병원균의 균사생장을 억제하는 것으로 잘 알려져 있다(Kim et al., 2021b; Lim et al., 2017).
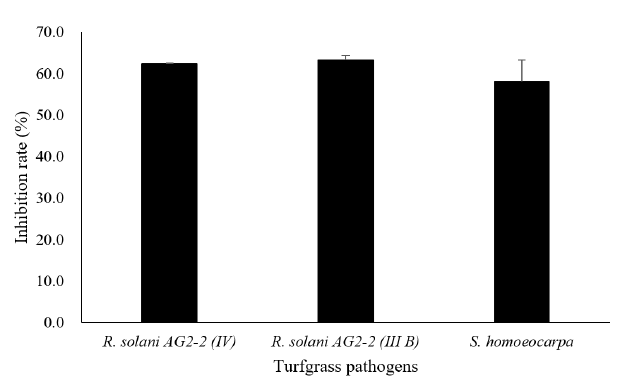
Fig. 1. The inhibition of mycelial growth of three turfgrass pathogens by Bacillus subtilis SA-15. The B. subtilis SA-15 was steaked on side of the potato dextrose agar (PDA) plate, and 48 h after incubation at 25℃ mycelia disk (φ 5 mm) of Rhizoctonia solani AG 2-2 (III B) was placed 25 mm distant from the antagonistic microbes, 72 h after incubation at 25℃ mycelia disk of R. solani AG 2-2 (IV), and 96 h after incubation at 25℃ mycelia disk of Sclerotinia homoeocarpa . Inhibition rate (%)=mycelia length of B. subtilis SA-15/ mycelia length of control×100.
살균제와 미생물비료 혼합용액의 미생물 생균수 변화
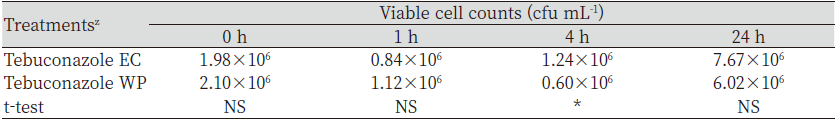
살균제 종류별 미생물비료 혼합액의 시간의 경과에 따른 B. subtilis SA-15의 생균수 변화를 조사하였다(Table 1). 살균제 종류별 미생물비료 혼합액 중 생균수의 변화는 tebuconazole과 pencycuron은 대조구와 통계적으로 유의적인 차이를 나타내지 않았으나 flutolanil은 대조구보다 생균수가 감소하였다.
시간의 경과에 따른 처리구별 미생물 생균수는 대조구는 0, 1, 및 4 시간 후에는 통계적으로 유의적인 차이를 나타내지 않았으나 24시간 후에는 감소하였고, tebuconazole과 pencycuron은 시간의 경과에 따라 통계적으로 유의적인 차이를 나타내지 않았으며, flutolanil은 시간의 경과에 따라 감소하였다. Shin et al. (2006)은 동전마름병 방제를 위해 선발한 B. subtilis을 살균제와 혼용 후 미생물의 생균수를 비교시 tebuconazole과 pencycuron은 혼용이 가능하다고 보고한 바 있어 본 연구결과와 유사한 결과를 나타냈다.
Tebuconazole 처리 후 토양 중 미생물의 다양성을 비교에서 진균수는 감소하지만 세균 중 Bacillus spp.의 밀도가 증가하는 것으로 알려져 있고(Baćmaga et al., 2021), 수중에서 tebuconazole의 처리 시 세균의 군집 구조나 조성에 미치는 영향은 적다고 알려져 있다(Pascault et al., 2014). 이와 같은 선행연구들은 본 연구의 결과에서 tebuconazole과 미생물비료 혼합액 중 B. subtilis SA-15의 감소가 적었던 결과와 유사한 결과를 확인할 수 있었다.
Pencycuron의 처리 시 침수된 토양에서 미생물은 감소하고, 처리 횟수가 증가할수록 미생물의 감소하는 경향을 나타내며(Pal et al., 2008), 토양세균의 대사활성에 짧은 시간동안 영향을 미친다(Yang et al., 2011). Pal et al. (2008)는 pencycuron을 처리하는 경우 xenobiotic 물질의 발생으로 토양 중 미생물은 감소하나 시간이 경과하면 다시 회복된다고 보고하였다. 본 연구에서는 처리구별 조사에서는 대조구와 차이를 보이지 않았으나 각 처리구별 미생물 생균수와 대조구와 t-검정결과 혼합 후 1시간 경과 시 생균수가 감소했으나 4시간과 24시간 조사에서는 통계적으로 유의적인 차이를 나타내지 않아 Pal et al. (2008)의 결과와 유사한 결과를 나타냈다.
Flutolanil은 pencycuron이나 tebuconazole과는 다르게 B. subtilis SA-15에 저해효과를 보였던 본 연구결과를 다르게 Kondoh et al. (2001)는 B. subtilis에 flutolanil을 처리하는 경우 미생물의 생육에는 영향을 미치지 않는다고 보고하여 본 연구와 다소 차이는 있었다. 이는 본 연구에서는 미생물 배양액이 아닌 제제 자체를 희석하여 사용하였으나 Kondoh et al. (2001)는 Luria-Bertani 배양액에서 시험이 진행되었기 때문으로 판단된다. 그러나 Kondoh et al. (2001)의 연구에서도 flutolanil을 처리한 경우 B. subtilis의 항진균 물질(iturin, surfactin)의 생성이 감소한다고 보고하여 flutolanil의 처리에 의한 미생물의 생육 및 대사에 영향을 미치는 것으로 판단된다. 이는 flutolanil의 작용기작이 진균의 호흡을 저해하여 살균효과를 나타내고 있기 때문에 세균의 생장 시 호흡작용에 영향을 미쳤기 때문으로 판단된다(Tomlin, 2009).
Kim et al. (2021b)은 B. subtilis SA-15가 라이족토니아마름병에 대한 길항성 및 생물학적 방제효과를 나타내며, pencycuron과 혼용 시 방제효과가 증가한다고 보고였으나, Ahn (2014)에 따르면 B. subtilis SA-15가 라이족토니아마름병 외에도 균핵병이나 탄저병 등에 대해서도 길항성을 나타낸다고 보고하였다. 본 연구에서도 B. subtilis SA-15는 라이족토니아마름병 외에 갈색잎마름병과 동전마름병에서도 길항성을 나타냈다(Fig. 1). 작물보호제 지침서(KCPA, 2022)에 따르면 3종의 살균제 중에서 tebuconazole은 라이족토니아마름병, 갈색잎마름병 및 동전마름병 등에도 사용할 수 있어 하고 있어 B. subtilis SA-15의 살균제 제형별 효력검정에 적절하였다.
Tebuconazole 제형별 처리 후 미생물비료 유효균주의 생균수을 조사한 결과는 Table 2와 같다. Tebuconazole 제형 중 잔디관리에 많이 이용하는 유제와 수화제를 미생물비료와 혼합한 용액에서 B. subtilis SA-15의 변화는 4시간 경과 시 유제 처리구에서 높게 나타났고, 0, 1 및 24시간에는 통계적으로 유의적인 차이를 나타내지 않았다. 비록 혼합액의 4시간 처리구에서 제형간 차이는 있었으나 미생물 생균수는 1×106 cfu mL-1을 나타내어 국내 농경지 토양의 세균수와 유사한 범위의 생균수를 나타내었으므로 농약과 혼용 시 적용이 가능할 것으로 판단되었다(Seo et al., 2010).
살충제와 미생물비료 혼합용액의 미생물 생균수 변화
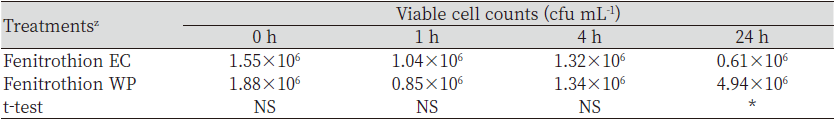
살충제와 미생물비료 혼합용액의 미생물 생균수 변화를 조사하였다(Table 3). Fenitrothion과 chloropyrifos-methyl 처리구의 생균수는 대조구와 비교할 때, 통계적으로 유의적인 차이를 나타내지 않았다. Fenitrothion과 chlorpyrifos-methyl은 24시간 경과 후 감소하였으나, 대조구는 24시간 경과 후 증가하는 경향을 보였다. Fenitrothion과 chlorpyrifos-methyl은 유기인계 살충제로서 cholinesterase 저해제로 알려져 있으며(Tomlin, 2009), 이들은 토양 중에서 Bacillus spp.를 저해하기도 한다(Jyothi et al., 2019). 본 연구에서도 살충제와 혼용 후 큰 차이를 나타내지 않았으나 24시간 경과 후에는 fenitrothion과 chlorpyrifos-methyl 처리구 모두 생균수가 감소하였다. 미생물의 처리는 유기인 유기인계 농약을 분해하는 유전자를 plasmid에 보유한 미생물에서만 분해하며, 분해 과정에서 페놀 및 퀴논계 물질이 발생하는 것으로 알려져 있다(Hayatsu et al., 2000). 이 중에서 페놀 및 그 유도체 화합물들은 쉽게 분해되지 않기 때문에 Bacillus spp. 등에 독성을 일으키고 미생물의 생장을 억제시킨다(Krastanov et al., 2013).
Fenitrothion과 chlorpyrifos-methyl은 잔디관리 시 피해를 주는 풍뎅이류와 나방류 유충의 방제를 위해 사용해 왔던 살충제로서 잔디병의 동시발생 시 살균제와 혼용하여 잔디 병해충방제를 위해 사용하게 된다. 그러나 최근 chlorpyrifos-methyl에 대한 안전성 문제가 제기되어 2021년 등록 취소되었다(Sunmai, 2021). 살충제의 제형별 미생물비료 혼합액 중 B. subtilis SA-15의 생균수 변화는 fenitrothion을 대상으로 수행하였다.Fenitrothion의 제형은 유제와 수화제를 처리한 미생물비료와의 혼합액 중에서 B. subtilis SA-15의 생균수를 비교하였다(Table 4). Fenitrothion 제형간 혼합액의 0, 1 및 4 시간 경과 시 살충제 제형은 통계적으로 유의적인 차이를 나타내지 않았으나 24 시간 경과 시에는 수화제 제형에서 높았다. Fenitrothion과 미생물비료 혼합액에서 B. subtilis SA-15의 생균수는4시간 경과 시까지 농업 토양 중 세균수과 유사하고, 제형별 차이를 나타내지 않아 혼용 후 약 4시간까지는 미생물의 생균수 변화에 영향을 미치지 않는 것으로 판단되었다(Seo et al., 2010).