서 언
단풍잎돼지풀(Ambrosia trifida L.)은 북아메리카 원산의 귀화식물로서 1년생이며 종자로 번식하고, 종자에는 휴면성이 있으며 발아는 20/30℃의 변온이 유효하다. 1년생 초본식물로 줄기는 곧추서며 높이 3 m 내외이고, 봄에 발생하여 여름과 가을에 걸쳐 개화(7-8월)하고 결실하며, 밭, 밭 주변, 길가, 초지, 하천 부지 등 도처에서 군생한다. 1년생 초본임에도 지하경이 뻗으며, 광합성능력이 뛰어나고 초형이 대형이어서 다른 식물에 미치는 차광작용이 매우 크다(Kim and Park, 2009). 단풍잎돼지풀은 생태계교란 잡초 중 돼지풀, 가시박 다음으로 넓은 면적에서 피해를 일으키며, 서울 월드컵공원, 충북 제천 장평천변, 경북 영천시 영천호 주변, 부산 사상구 낙동강변, 강원 화천군 지방도로변 등 전국 약 39개소에서 피해를 주고 있다(Choi, 2017).
외래생물은 생물다양성 보전 및 이용에 관한 법률 제2조 제7항에서 ‘외국으로부터 인위적 또는 자연적으로 유입되어 그 본래의 원산지 또는 서식지를 벗어난 존재’로 정의되어 있다. 2017년을 기준으로 국내에 유입된 외래생물 중 잡초는 43과 204속 387종으로 보고되어 있고(Kim, 2017), 그 중 국내에 유입된 외래식물에서 단풍잎돼지풀을 포함한 11종이 위해성평가 1등급이며, 14종이 생태계교란식물로 지정되어 있다. 이러한 생태계교란식물 제거를 위해 국내에서 주로 동원하는 수단은 예취와 같은 물리적 또는 생물학적 방제가 활용되고 있으나, 이러한 방법은 많은 노동력을 필요로 할 뿐만 아니라 완전한 제거가 불가능하며, 재생력이 강하여 제거속도보다 번식속도가 빠르기 때문에 일시적인 개체수 감소에 그치는 수준이므로 확산이 가속화되고 있는 실정이다(Choi, 2017).
생태계교란식물의 효율적인 제거와 관리에 있어서 국내의 경우 그 동안 체계적으로 관리할 수 있는 기술개발을 위한 정부 유관부처의 연구비 지원이 부족했던 관계로 그 기술이 매우 낮은 수준이라고 할 수 있으며, 그린바이오 기술기반의 환경친화적인 제거기술 개발 연구가 일부 시도되고 있으나, 소재 발굴부터 개발까지의 전주기적 성공사례는 없는 실정이다(Choi, 2017). 생태계교란식물 제거를 위한 국내 제거기술 현황으로는 곤충을 이용한 생물학적 방제(Lee et al., 2007; Na et al., 2008), 식물 정유 d-limonene 처리에 의한 온실 및 포장조건에서의 가시박 방제효과(Choi et al., 2012b) 등의 연구내용이 보고되어 있다. 외국의 경우에도 생태계교란식물의 제거기술은 기존 유기합성 경엽처리용 제초제를 사용하는 방법 이외에 뚜렷한 기술개발 성과는 없으며, 생태계교란식물에 대한 기초생태, 발생현황 및 분포 등의 연구내용이 보고되어 있는 정도이다(Choi, 2017).
생태계교란식물의 주요 분포 및 피해지역은 강변이나 도로변 또는 사람들이 활동하는 생활주변이기 때문에(Moon et al., 2008) 기존 유기합성 제초제를 이용한 제거는 현실적으로 제한적이다. 더구나 유기합성 제초제의 인축독성, 환경에 대한 영향, 저항성 잡초 출현 등의 글로벌 이슈로 인해 점차 사용이 규제되고 있는 추세이며, 그로 인해 인축독성이 낮고 생분해가 가능한 친환경 제초제에 대한 관심이 높아지고 있다(Hoagland, 1990). 특히 미생물 기반의 제초활성물질은 높은 효율성 등으로 큰 각광을 받고 있는데(Christy et al., 1993; Dayan et al., 2009), 미생물 기반의 제초활성물질의 예로서 세균으로는 Pseudomonas syringae (Bender et al., 1999), 곰팡이의 경우에는 Colletotrichum gloeosporides (Templeton et al., 1984) 또는 Phytophthora palmivora (Misra, 2005) 등이 알려져 있다. 방선균은 토양 미생물로서 항생물질 뿐만 아니라 다양한 종류의 유용한 2차 대사산물을 생산하기 때문에 특히 관심을 받고 있다(Joseph et al., 2012). 토양 방선균이 생산하는 2차 대사산물을 이용한 제초활성물질의 예로는 herbimycin (Li et al., 2003), bialaphos (Bayer et al., 2004; Duke et al., 1996), albucidin (Hahn et al., 2009), glufosinate-ammonium (Hoerlein, 1994) 등이 있다.
본 연구에서 활용하고자 하는 토양 방선균 N-29 균주의 모균주인 토양 방선균 Streptomyces scopuliridis KR-001 균주는 한국화학연구원에서 발굴한 천연제초활성 후보소재이다. 이 균주가 생산하는 2차 대사산물 herbicidin은 비선택성 제초제로서(Won et al., 2015)의 가능성을 확보하였고, 배양 여액 살포 시 농경지에 발생하는 주요 문제잡초뿐만 아니라 생태계교란식물 가시박 방제에도 활성이 매우 우수하였다(Lee et al., 2013).
본 연구팀에서는 기 논문 발표를 통해 토양 방선균 N-29 균주를 사용하여 생태계교란식물 돼지풀에 대한 방제효과 결과를 보고한 바 있다(Kim et al., 2018). 본 연구에서는 동일 균주인 토양 방선균 N-29를 생태계교란 광엽식물 단풍잎돼지풀을 대상으로 온실 및 포장조건에서의 활성평가를 통해 천연물 유래의 환경친화적인 생태계교란 광엽식물 방제제로서의 활용 가능성을 확인해 보고자 하였다.
재료 및 방법
시험 균주
토양 방선균 N-29 균주는 모균주인 S. scopuliridis KR-001 (Lee et al., 2013)로부터 UV 및 chemical mutation 기술을 활용하여 개량한 균주이다. 개량 균주 N-29는 모균주에 비해 유효 제초활성물질인 herbicidin A는 5.7배, herbicidin B는 12.7배 증가된 균주이며, 최적배양 조건의 배양일수는 7일, 배양온도 28℃, 배지조건(3% glucose, 2% soybean meal)에서 교반속도 250 rpm, pH 7.0 이었다.
식물 재료
본 연구에 사용한 단풍잎잎돼지풀 종자는 충북 청주시 상당구 현도면에 위치한 장승공원 일대에서 2017년 10-11월경에 채종하여 정선한 다음 6℃의 저온고에 건조상태로 보관해 두면서 충실한 종자를 선별하여 사용하였다. 실험에 필요한 균일한 개체를 선발하기 위해 먼저 표면적 350 cm2 사각 플라스틱 포트(가로 22×세로 16 cm)에 원예용 상토를 충진하여 저온고에 보관중인 단풍잎돼지풀 종자를 파종한 다음 떡잎이 지상부로 출현했을 때 초기 처리용은 표면적 40 cm2 (ø7.2 cm) 폴리스티렌 컵, 중기 처리용은 표면적 95 cm2 (ø11 cm) 컵, 후기 처리용은 표면적 314 cm2 (ø20 cm) 플라스틱 포트에 이식하여 시험 적정 엽기가 되었을 때 균일한 개체를 선정하여 사용하였다. 온실조건은 30/25±5℃, Light/Dark=14/10 h에서 관리하였다.
온실조건에서의 경엽처리 활성평가
이식 후 온실에서 생육중인 단풍잎돼지풀의 생육시기가 2-3엽(초기), 4-5엽(중기) 및 7-8엽(후기)이 되었을 때, N-29 균주 배양 여액을 희석하여(Tween-20®, 0.1% 포함) 처리하였다. 각 생육시기별 처리농도는 배양 원액, 2배 및 4배 희석액이었으며, 이때 처리물량은 각 처리 농도별로 초기처리는 포트당 3 mL, 중기처리는 5 mL, 후기처리는 20 mL를 사용하여 잎 표면이 충분히 젖을 정도가 되도록 처리하였다. 처리 후 동일한 온실조건에서 관리하였으며, 외형적인 증상 및 약효는 처리 5, 10, 및 15일 후에 기준표에 준해 달관조사(0; 효과 없음, 100; 완전고사)하였으며, 모든 처리는 3반복으로 수행하였다.
포장조건에서의 경엽처리 활성평가
포장시험은 2018년 5월 중-6월 하순경에 세종특별자치시 연서면 월하리 218-2번지의 단풍잎돼지풀이 균일하게 서식하고 있는 군락지를 선정하여 수행하였다. 처리시기는 5-6엽기로, 처리할 때 단풍잎돼지풀의 초장은 10개체 평균 292.2 mm이었다. 처리구획은 1 m×1 m (1 m2)로 하였으며, 처리농도는 배양 원액, 2배 및 4배 희석액이었고, 처리물량은 각 처리 농도별(Tween-20®, 0.1% 포함) 200 mL/m2이었으며, 나노 전동 핸드스프레이(nano electronic sprayer, BIO CHEM KOREA Co., LTD., Bucheon, Korea)를 사용하여 분무 처리하였다. 외형적인 증상 및 약효는 처리 7, 14 및 21일 후에 기준표에 준해 달관조사(0; 효과 없음, 100; 완전고사)하였으며, 모든 실험은 3반복으로 수행하였다.
결과 및 고찰
온실조건에서의 초기 경엽처리 효과
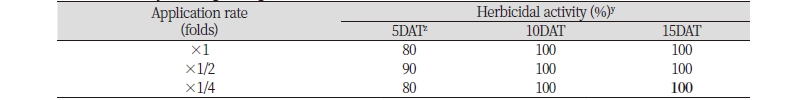
2-3엽기의 단풍잎돼지풀에 N-29 균주 배양 여액을 온실조건에서 처리하면 방제효과가 매우 우수하였다. 처리 5일 후에는 모든 처리 범위에서 단풍잎돼지풀 방제효과는 80-90%이었는데, 이후 지속적으로 약효가 증진되어 처리 10일 후에는 배양 원액, 2배 및 4배 희석액에서의 방제효과는 모두 100%로 증가되었으며, 처리 15일 후까지 그 살초력이 유지되었다(Table 1; Fig. 1). 배양 원액, 2배 및 4배 희석액의 경우 처리 초기에는 신엽이 고사되지 않았지만 이후 약효가 증가되어 처리 10일 후에는 신엽까지 완전 고사되어 방제효과가 100%가 되었다. N-29 균주 배양 여액의 단풍잎돼지풀에 대한 살초특성은 매우 속효성으로 처리 24시간 이내에 외형적으로 수침상(water soaked)의 반점이 형성되었으며, 약효지속기간도 3주 이상 길게 유지되고 있었다. 외형적으로 나타나는 주요 증상은 수침상 반점 형성 이후 황화(chlorosis) 증상을 보이다가 시간이 경과하면서 고사(leaf burn-down)로 진행되었다가 궁극적으로는 낙엽화(defoliation)되었다.

Fig. 1. Herbicidal activity of foliar application of the mutant N-29 broth filtrate of Streptomyces scopuliridis KR-001 to Ambrosia trifida with early leaf stage (2-3 Ls) in a greenhouse condition. Herbicidal activity was determined by visual injury (0: No injury, 100: Complete death) at 5, 10, and 15 days after treatment. The representative pictures were taken 15 days after foliar application. DAT: Days after treatment.
온실조건에서의 중기 경엽처리 효과
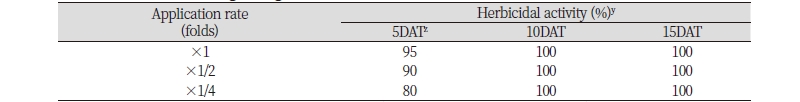
N-29 균주 배양 여액 처리는 4-5엽기의 중기 단풍잎돼지풀을 효과적으로 방제하였다(Table 2; Fig. 2). 처리 5일 후 원액, 2배 및 4배 희석액의 단풍잎돼지풀 방제효과는 각각 95, 90 및 80%이었다가 이후 지속적으로 약효가 증가되어 처리 10일 후에는 모든 처리농도에서 100%의 방제효과를 나타낸 후 15일 후에도 재생되는 개체 없이 완벽하게 방제되었다. N-29 처리에 의한 단풍잎돼지풀에서 발현되는 주요 증상은 초기 경엽처리와 비슷하였다. 처리초기에 약제가 살포된 잎은 수침상의 반점을 보이다가 황화로 진행되었고 결국에는 낙엽화되었다. 단풍잎돼지풀 중기 처리 시 N-29 배양 여액의 살초특성은 처리 1일이 지나면서 외형적인 증상이 발현되어 매우 속효성이고, 처리일수가 경과함에 따라 약효도 지속적으로 증가되어 처리 15일 후까지 재생되지 않아 약효지속성도 매우 우수하였다.
온실조건에서의 후기 경엽처리 효과
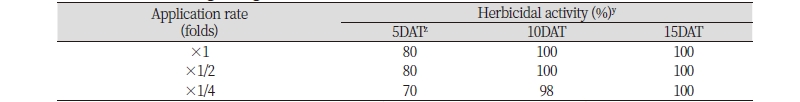
온실조건에서 7-8엽기의 단풍잎돼지풀에 토양 방선균 N-29 균주 배양 여액을처리하면 효과적으로 방제되었다(Table 3, Fig. 3). 처리 5일 후 배양 원액, 2배 및 4배 희석액에서의 단풍잎돼지풀 방제효과는 각각 80, 80, 70%이었는데, 처리일수가 지나면서 약효가 지속적으로 증가되어 처리 10일 후에는 동일한 처리농도에서 방제효과가 각각 100, 100 및 98%이었다. 처리 15일 후에는 4배 희석액 처리에서도 100%의 방제효과를 나타내었고, 처리 3주 이후까지 재생되는 개체 없이 살초력이 지속되었다. 7-8엽기 처리에서도 초기 및 중기 처리와 마찬가지로 처리 후 24시간 이내에 외형적인 증상이 발현되었으며, 4배 희석액 처리의 경우 생장점에서 신엽이 재생되는 듯 하였으나 15일 후에는 재생되던 신엽까지도 완전하게 고사되어 약효 지속효과도 매우 우수한 것으로 판단되었다.
단풍잎돼지풀은 1년생 초본임에도 지하경이 뻗으며, 광합성능력이 뛰어나고 초형이 대형이어서(Kim and Park, 2009) 다른 식물에 미치는 차광작용이 매우 크기 때문에 초기에 방제하지 않으면 식물 생태계에 큰 영향을 미치게 된다. 따라서 생육초기 단풍잎돼지풀 방제여부가 매우 중요하다고 할 수 있는데, 토양 방선균 N-29 균주 배양 여액은 온실조건에서 7-8엽기의 단풍잎돼지풀을 매우 효과적으로 방제하고 있기 때문에 친환경적으로 단풍잎돼지풀을 방제할 수 있는 후보소재로서의 가능성이 충분하다고 판단하였다.
포장조건에서의 경엽처리 효과
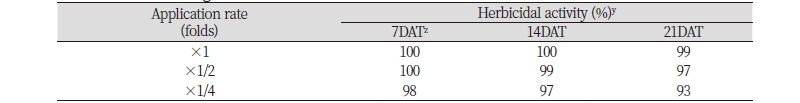
자연상태에서 발생하는 단풍잎돼지풀을 대상으로 토양 방선균 N-29 균주 배양 여액을 처리하였을 때, 처리 초기에는 약효가 매우 우수하였으나 처리 후 시간이 지남에 따라 일부 개체에서 신엽이 재생되었다(Table 4; Fig. 4). 자연상태에서 생육하고 있는 5-6엽기의 단풍잎돼지풀에 N-29 균주 배양 여액 처리 7일 후 원액, 2배 및 4배 희석액에서의 방제효과는 각각 100, 100 및 98%이었고, 처리 14일 후 동일한 농도에서의 방제효과는 각각 100, 99 및 97%로 매우 우수하였다. 그러다가 처리 21일 후에는 각각 99, 97, 93%로 방제효과가 약간 감소하는 경향이었는데, 이는 처리 14일 이후에 극히 일부 개체에서 신엽이 재생되었기 때문이다. 특히 4배 희석액의 경우에는 처리 7일째부터 이미 신엽이 재생되는 개체를 확인할 수 있었는데, 이후 처리일수가 지나면서 점차 신엽의 생육이 증진되어 처리 21일 후에는 뚜렷하게 재생된 신엽을 확인할 수 있는 개체가 발견되었다.

Fig. 4. Herbicidal activity of foliar application of the mutant N-29 broth filtrate of Streptomyces scopuliridis KR-001 to Ambrosia trifida with 5-6 leaf stage in field condition. Herbicidal activity was determined by visual injury (0: no injury, 100: complete death) at 7, 14, and 21 days after treatment. The representative pictures were taken 14 days after foliar application. DAT: Days after treatment.
이상과 같이 온실조건 및 자연상태에서 발생된 단풍잎돼지풀에 대한 토양 방선균 N-29 균주 배양 여액의 살초력은 매우 우수하였지만, 자연상태에서 7엽기 내외의 생육시기에 1회 처리로는 생장점이 완전히 고사되지 않고 재생될 가능성을 배제할 수 없었다. 따라서 토양 방선균 N-29 균주는 단풍잎돼지풀을 효과적으로 방제할 수 있는 후보소재이기는 하지만, 자연상태에서 발생되는 단풍잎돼지풀의 경우에 발생개체간 생육상황 또는 온도, 강우 등의 기상여건에 따라서 후보소재를 처리한 이후에 2-3회 정도의 체계처리를 하는 것이 바람직할 것으로 판단되었다
최근 보고에 의하면 단풍잎돼지풀은 경기 북부에 집중적으로 발생하고 있는데(Kim et al., 2017), 경기 북부지역의 축산농가와 군부대 인근지역, 특히 군작전 지역의 공터에서 대규모 군락을 형성하여 분포하기 때문에 지속적으로 농경지에 유입되고 있다고 한다(Kim, 2017). 단풍잎돼지풀은 싹이 나는 시기가 일정하지 않아 토양처리제로는 방제가 쉽지 않으며(Yoo et al., 2008), glufosinate와 같은 비선택성 제초제를 사용하거나 예취와 같은 물리적 방법을 동원하는 것이 효율적이라고 한다(NAIST, 2008). 그러나 단풍잎돼지풀의 주요 발생지가 축산농가나 군부대와 같은 생활주변이기 때문에 유기 합성 제초제 사용은 매우 제한적일 수 밖에 없다. 또한, 물리적 방법은 많은 노동력을 필요로 하고, 특히 생태계교란식물은 재생력이 강하여 제거속도보다 번식속도가 훨씬 빠르기 때문에 완전한 제거가 불가능하다(Choi, 2017). 따라서 예취와 같은 물리적 방법을 동원한 단풍잎돼지풀 방제는 일시적으로 개체수를 감소시키는 정도의 효과는 있지만, 지속적으로 보면 확산이 가속화되고 있는 실정이다. 이러한 상황에서 천연물 기반의 환경친화적인 단풍잎돼지풀 방제제 발굴 및 적용기술 개발은 절실히 필요하다고 할 것이다.
방선균은 다양한 종류의 유용한 2차 대사산물을 생산하는데(Joseph et al., 2012), 다양한 2차 대사산물 중 bialaphos와 같이 제초제로 개발되어 상업화 된 사례도 있다(Satoh et al., 1993). 이와 같이 토양 방선균은 지금까지 알려지지 않은 전혀 새로운 작용기작을 갖는 제초활성물질을 생산할 가능성이 있으며, 이러한 가능성은 기존 제초제와는 다른 메커니즘으로 살초력을 발휘할 수도 있기 때문에(Saxena and Pandey, 2001) 최근 들어 크게 주목을 받고 있다. 본 연구에서 사용한 토양 방선균 N-29 균주가 생산하는 herbicidin은 가시박(Lee et al., 2013)과 돼지풀(Kim et al., 2018)에 대하여 온실과 포장조건에서 만족할 만한 방제효과를 선행연구를 통해 확인한 바 있다. 본 실험 결과에서도 선발된 후보소재 N-29 방선균 배양 여액은 온실조건 및 자연상태에서 발생한 단풍잎돼지풀에 대하여 방제효과가 매우 우수하였기에 친환경적인 생태계교란식물 방제제 후보소재로 유용하게 활용할 수 있을 것으로 기대된다.
Acknowledgement
This work was carried out with the support of "Cooperative Research Program for Agriculture Science and Technology Development (Project No. PJ013479)" Rural Development Administration, Republic of Korea.Authors Information
Hwa-Sook Kwak, Korea Research Institute of Chemical Technology, Ph.D. student
Young-Sook Kim, Korea Research Institute of Chemical Technology, Researcher
Jae-Deok Kim, Korea Research Institute of Chemical Technology, Ph.D. student
Kyoung-Soo Jang, Korea Research Institute of Chemical Technology, Researcher
Kee-Woong Park, Chungnam National University, Professor
Kyong-mi Chon, National Institute of Agricultural Sciences, Researcher