서 언
1940년대 이후부터 사용되어 온 제초제 세계 시장은 2017년 기준 232.6억 달러 였으며 전체 작물보호제시장의 42.9%를 차지하고 있어(Phillips McDougall, 2018) 높은 성장을 이루고 있지만, 제초제가 지닌 인축독성, 꿀벌 등 자연생태계 영향, 장시간 잔류 등과 같은 안전성 문제나 제초제 저항성 잡초의 급격한 출현과 발생량 증가는 앞으로 지속적으로 해결해야 할 숙제로 도전 받고 있다(Kim and Kim, 2020). 따라서 독성이 낮고 친환경적이면서 저용량으로 높은 활성을 보이는 신규 작용기작 또는 새로운 구조의 제초활성물질은 꾸준히 개발되어야 할 것이다(Duke, 2011; Kim and Kim, 2020; Kraehmer et al., 2014).
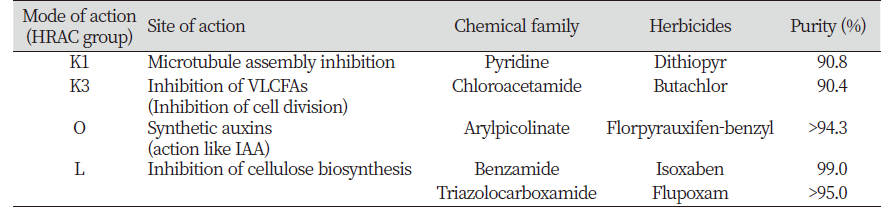
현재 상업용 제초제의 작용점은 적어도 25개 이상이 되는 것으로 보고되고 있는데(WSSA, 2020), 그 중에 셀룰로오스 생합성 과정은 근래 신규 제초제 개발에 있어서 매우 중요한 생리과정으로 인식되고 있다. 그 이유는 첫째, 셀룰로오스 생합성으로부터 세포벽 형성에 이르는 생리과정이 매우 복잡하여 다양한 작용점이 존재할 가능성이 있는데, 지금까지 개발된 cellulose biosynthesis inhibitors (CBI)의 화합물 구조는 그 다양성이 상대적으로 낮기 때문에(Tateno et al., 2016; WSSA, 2020) 향후 신규화합물 개발가능성이 높다고 여겨진다. 둘째, CBI는 자연계에서 저항성 잡초 출현지수가 매우 낮은 것으로 보고되고 있다(Heap, 2020; Tateno et al., 2016). 셋째, 활용되고 있는 CBI 제초제들의 활성 특징을 볼 때, 특히 indaziflam이란 약제에서 나타내는 바와 같이 제초스펙트럼 범위도 넓으며 토양처리뿐만 아니라 경엽처리 효과도 나타낼 수 있고, 또한 매우 저농도(pM 수준)에서도 제초효과를 발현시킬 수 있는 잠재력이 있어(Brabham et al., 2014; Clark et al., 2019; Sebastian et al., 2017) 소위 acetolactate synthase에서처럼 저농도 작용점 그룹에 속할 수 있다는 것이다. 현재 여러 연구그룹들이 다양한 화합물로부터 셀룰로오스 생합성 저해제를 탐색하기 위하여 노력중인데 지금까지의 성공사례로서는 acetobixan (Xia et al., 2014), CESTRIN (Worden et al., 2015), C17 (Hu et al., 2016), cellulosin (Zhang, 2019) 등을 들 수 있다.
CBI 탐색의 방법론적인 측면에서 볼 때, in vitro 수준의 생화학적 검정법은 없고, in vivo 방법에도 여러 가지가 사용되고 있지만 개선의 여지가 많다. 즉, 그동안 진행해 왔던 일반 식물 종자 또는 hypocotyl, fiber, callus, protoplast 등의 기관을 가지고 검정하는 방법은(García-Angulo et al., 2012; Heim et al., 1998; Montezinos and Delmer, 1980; Sabba and Vaughn, 1999; Tanaka et al., 1995; Tsuchiya et al., 1996; Vaughn and Turley, 2001; Zhang, 2019) 비특이적이며 방사성동위원소 취급을 위한 안전시설이 필요하거나 실험 조건이 까다로워 비교적 높은 숙련이 요구되는 점이 있다. 또한 최근에 가장 자주 사용되는 방법으로서 표지유전자 발현 애기장대 계통을 이용하는 경우(Brabham and DeBolt, 2013; Brabham et al., 2014; Drakakaki et al., 2011; Hu et al., 2016; Kuki et al., 2017; Tran et al., 2018; Worden et al., 2015; Xia et al., 2014) 이미지 분석을 위한 고가의 장비가 필요하다. 또한 감수성 애기장대와 CBI 저항성 유전자가 도입된 형질전환 애기장대 계통을 함께 스크리닝하는 방법은(Gutteridge and Kang, 2018; Hu et al., 2016) 두개의 라인을 사용해야 하기 때문에 작업량과 시간이 두 배로 소요된다. 그렇기 때문에 앞으로의 개선방향은 cellulose 생합성 이후 세포벽 형성에 이르는 과정에는 매우 복잡한 생리 및 생화학적 반응이 상호연결되어 있어서(Lampugnani et al., 2018) 이 과정에 작용되는 일련의 화합물을 함께 발굴하려면 in vitro 보다는 in vivo 실험이 바람직하다. 그리고 단순하면서 저비용의 원스텝 스크리닝(one-step screening) 방법을 확보하는 것이 무엇보다 필요하다고 여겨진다. 즉 CBIs에서만 나타내는 특이적인 증상을 토대로 일반 식물을 가지고 in vivo 상태에서 단번에 검정할 수 있다면 저비용, 고효율로 CBI를 개발하는데 매우 유용한 수단이 확보되는 것이다.
따라서 본 연구에서는 일반 식물 또는 기관을 가지고 CBIs에서만 나타내는 특이적인 증상이 있다면 이를 토대로 one-step in vivo screening을 구현시킬 수 있을 것으로 판단하여 이의 가능성을 검토하기 위하여 보다 손쉽게 접근할 수 있는 엽절편법, 유묘신초침지법, 종자유묘생장법을 대상으로 제반 실험을 수행하였다.
재료 및 방법
식물재료
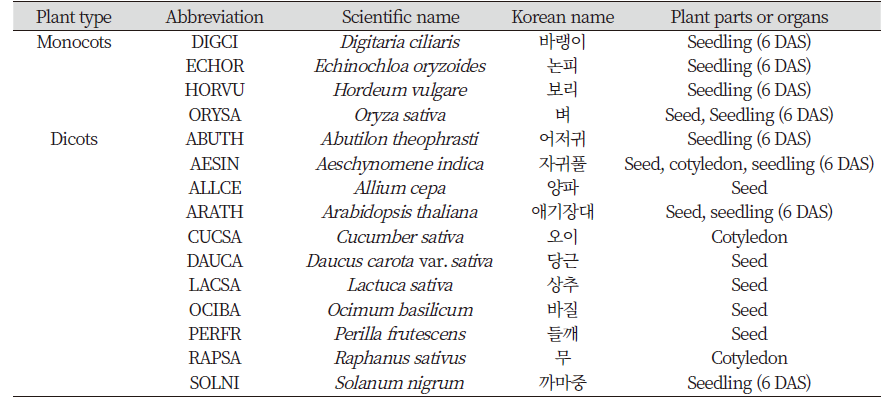
본 실험에 사용된 식물종은 구입과 취급이 비교적 용이한 단자엽식물 4종과 쌍자엽 식물 11종을 대상으로 하였다(Table 1).
공시화합물
사전연구에서 제초작용 증상구별이 매우 까다로운 네 가지 작용점(K1, K3, O, L)을 대상으로 대표되는 화합물 5종을 공시하였고, 순도 90% 이상의 원제를 사용하였다(Table 2).
Table 2. Herbicides tested in this study and their mode of action.
|
|
HRAC: Herbicide resistance action committee; VLCFAs: Very long chain fatty acids. |
시험용액 조제
계면활성제 Tween 20을 함유한 아세톤 또는 dimethyl sulfoxide (DMSO) 용매를 이용하여 시험화합물을 녹인 다음, 이를 수돗물로 조제된 1x modified DM (MDM) 배지(Kim and Kim, 2020)에 희석하여 여러 농도의 시험용액을 만들었다. 이때 아세톤, DMSO, Tween 20의 최종농도는 각각 0.2%, 0.2%, 10 ppm이었으며 이로 인한 약해는 관찰되지 않았다.
실험방법
엽절편 실험(leaf disc assay)
Isoxaben이 자엽 절편의 생장에 미치는 영향을 조사하기 위하여 토양에 실험종자를 파종한 후 온실조건에 자귀풀(Aeschynomene indica, AESIN) 6일, 오이(Cucumber sativa, CUCSA) 9일, 무(Raphanus sativa, RAPSA) 8일 키운 식물의 자엽으로부터 직경 4 mm 크기의 엽절편을 만든 다음, filter paper가 깔린 직경 15 cm Petri-dish에 시험 용액을 10 mL 분주한 후 8-20개의 엽절편을 치상하였다. 이를 26±1℃, 14 hr 광주기, 50-70 µmole m-2s-1의 생육실에 5일 동안 둔 다음 자엽절편의 괴사, 컬러변화 등을 육안조사하였다.
유묘 신초 침지 실험(shoot dipping assay)
토양에 실험종자를 파종한 후 온실조건에 약 6일간 키워 생장한 애기장대(Arabidopsis thaliana, ARATH), 까마중(Solanum nigrum, SOLNI), 어저귀(Abutilon theophrasti, ABUTH), 자귀풀 (Aeschynomene indica, AESIN) , 논피(Echinochloa oryzoides, ECHOR), 바랭이(Digitaria ciliaris, DIGCI), 벼(Oryza sativa, ORYSA), 보리(Hordeum vulgare, HORVU)의 유묘로부터 세포분열이 왕성한 정단부를 포함하는 신초(shoot)를 취하여 1x MDM에 조제된 isoxaben 15 µM 용액 10 mL를 함유한 투명 플라스틱 원형컵(ø: 52-36 mm, H: 60 mm, Sang Ji, Cheongju, Korea)에 침지시켰다. 애기장대의 경우에는 filter paper가 깔린 직경 5 cm Petri-dish에 isoxaben 시험 용액을 5 mL 분주한 후 어린 유묘(생장점 포함부위)를 치상하였다. 그 후 26±1℃, 항온실에 7일간 두면서 제초증상 발현을 육안으로 관찰하였다.
종자 유묘생장 실험(germination & seedling growth assay)
공시화합물들이 종자 발아, 근 및 유묘의 신장과 발달에 미치는 영향을 종합적으로 조사하기 위하여 애기장대(ARATH), 자귀풀(AESIN), 들깨(PEFRU), 바질(OCIBA), 당근(DAUCA), 양파(ALLCE), 상추(LACSA), 벼(ORYSA) 종자를 가지고 dithiopyr, butachlor, florpyrauxifen-benzyl, isoxaben, flupoxam 화합물을 대상으로 실험하였다. 애기장대의 경우, 직경 5.5 cm Petri-dish에 filter paper 1매를 깔고 화합물 용액 3-5 mL를 분주한 다음 소량의 종자를 치상하였다. 이를 20-23℃, 12 hr 광주기, 50 µmole m-2s-1의 생육실에 5일동안 두었다. 한편 들깨 등 기타 종자의 경우는 투명 플라스틱 원형컵(ø: 52-36 mm, H: 60 mm, Sang Ji, Cheongju, Korea)에 filter paper 1매를 깔로 시험용액 5 mL를 분주한 다음 실험종자를 10-25립 치상한 후 이를 상추는 20±1℃, 기타 종자는 26±1℃의 생육실(14 hr 광주기, 50 µmole m-2s-1)에 4-5일 동안 두었다.
종자발아 및 유묘생육에 미치는 화합물의 영향 평가는 전체적인 생장억제를 0-100% 등급표(0은 무영향, 100은 완전고사)에 준하여 육안조사하거나 근/하배축의 신장정도를 계측하였다. 아울러 하배축/근의 두께를 캘리퍼스(Model CD-15AX, Mitutoyo Corp., Kanagawa, Japan)로 측정하였고 기타 조직의 형태 및 컬러 변화유무도 상세히 조사 비교하였다.
결과 및 고찰
엽절편 실험(leaf disc assay)
Cellulose 생합성 저해제(CBI)로 알려진 isoxaben 15 µM 용액에 자귀풀(AESIN), 오이(CUCSA), 무(RAPSA) 엽절편을 치상하여 CBI 고유의 증상이 발현되는지를 알아보기 위하여 실험한 결과, 화합물처리에 따른 자엽의 변색은 식물종마다 차이를 나타내어 오이는 황색, 자귀풀은 적갈색, 무는 옅은 황갈색을 보이며 괴사되었다(Fig. 1). 보다 특징적으로 보였던 자귀풀 자엽 절편 변색의 경우, 약제 무처리구에서도 가끔씩 적갈색 축적이 일어나기도 하고(비멸균으로 인한 오염 때문으로 추정) 약제 처리된 일부 절편에서도 적갈색 대신 황색으로 변하는 경우가 관찰되어 일관성이 낮은 경향을 보였다. 아울러 절편 만드는데 시간이 꽤 걸리고, 실험중 부패가 자주 발생하며, 절편마다 반응차이가 불균일하여 본 방법으로 cellulose 생합성 저해제를 효율적으로 탐색하기에는 부적합할 것으로 판단되었다.
유묘 신초 침지 실험(shoot dipping assay)
까마중(SOLNI)을 비롯한 여러 식물종의 유묘를 대상으로 세포분열이 왕성한 정단부를 포함하는 신초(shoot)를 취하여 cellulose 생합성 저해제 isoxaben 용액에 침지하여 CBI 고유의 제초증상이 나타나는지를 확인해 보았다. 그 결과, 애기장대(ARATH)의 경우 생장억제와 함께 지상부의 황화가 나타나지만 갈변은 관찰되지 않았고, 까마중(SOLNI)과 어저귀(ABUTH)의 경우는 근 신장과 본엽 출현이 억제되면서 자엽이 황화 또는 옅은 황갈색으로 변색되었다. 자귀풀(AESIN)은 근 발생이 억제되었고 자엽병이 괴사되었다. 한편 논피(ECHOR)와 바랭이(DIGCI)에서는 생장억제와 함께 지제부 생장점이 팽대하면서 황갈색으로 변색되었다. 벼는 뚜렷한 변색없이 근 생장만 억제되었다. 한편 보리(HORVU)는 초엽 하단 절단부의 황화(엽맥 옅은 황갈색 동반함)와 함께 조직괴사가 진행되었다 (Table 3; Fig. 2). 전반적으로 검정공간이 상대적으로 넓게 소요되고, 개체마다 반응차이가 불균일하며, 실내에서의 낮은 생육속도로 인해 CBI 증상발현이 미약할 뿐만 아니라 효율적 분별이 어려웠다. 따라서 본 검정 방법을 가지고서는 cellulose 생합성 저해제를 고효율로 탐색하기에는 부적합할 것으로 판단되었다.
Table 3. Herbicidal symptoms observed after dipping of several plant seedlings in 15 μM isoxaben solution for 7
days.

|

Fig. 2.Herbicidal symptoms of several plant seedlings exhibited after the 4 d-incubation in 15 μM isoxaben solution. Tested plants were Arabidopsis thaliana (ARATH), Solanum nigrum (SOLNI), Abutilon theophrasti (ABUTH), Aeschynomene indica (AESIN), Echinochloa oryzoides (ECHOR), Digitaria ciliaris (DIGCI), Hordeum vulgare (HORVU), and Oryza sativa (ORYSA). Left photos: Untreated; Right photos: Herbicide-treated.
종자 유묘생장 실험(Germination & seedling growth assay)
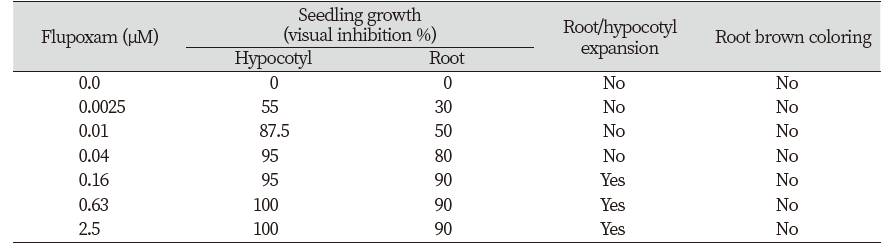
셀룰로오스 생합성 저해제 isoxaben과 flupoxam의 처리효과
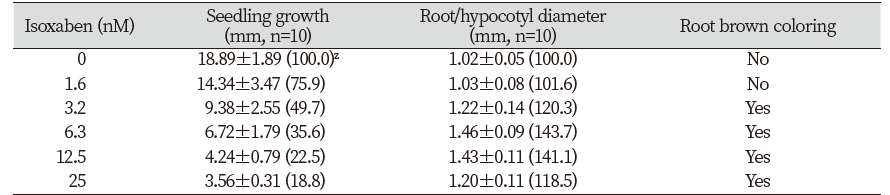
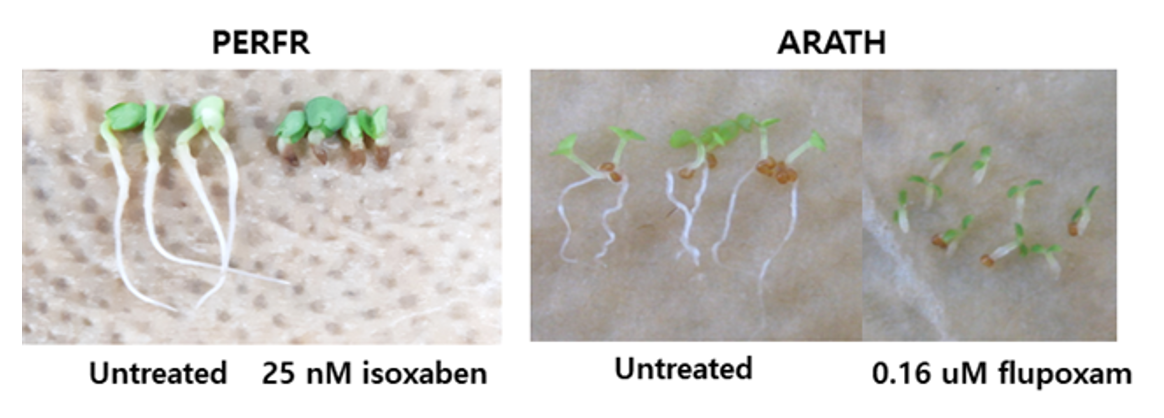
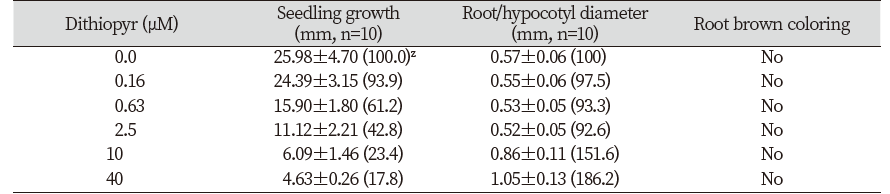
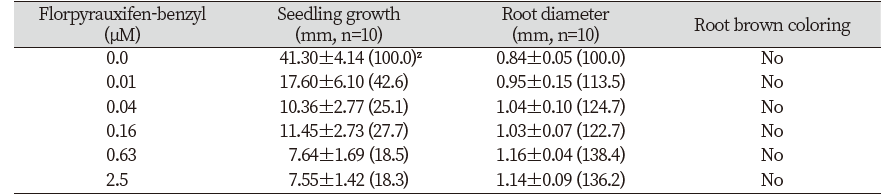
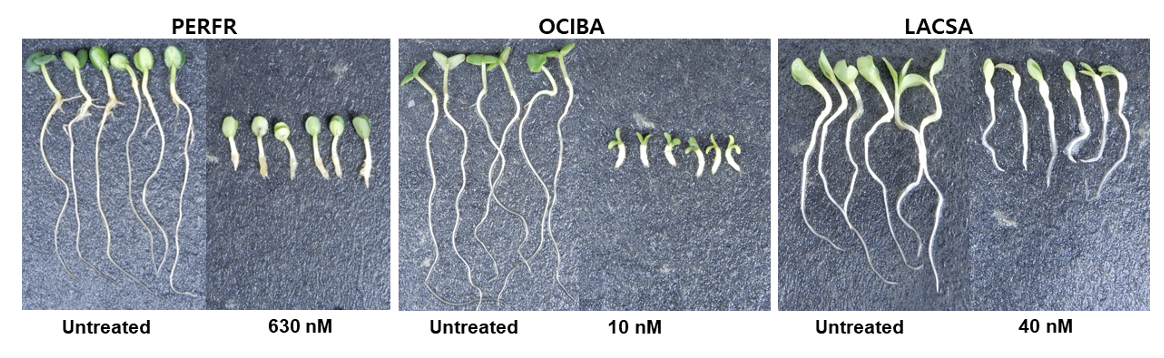
들깨 종자에 대한 isoxaben 처리효과를 조사한 경우, 유묘의 생장저해와 함께 3.2 nM 이상에서부터 근부위의 비대가 일어났으며(Table 4; Fig. 3) 특이하게도 근 선단부위의 갈변반응이 현저하게 나타났다(Fig. 3). 그런데 애기장대에 flupoxam을 처리한 경우에는 유묘의 생장저해와 함께 0.16 µM 이상부터 하배축/근 부위의 비대가 일어났지만(Table 5) 갈변증상은 전혀 발생되지 않는 경향을 나타내었다(Fig. 3). 다른 여러 종자를 가지고 실험해 보았을 때, 유묘의 생장저해와 함께 하배축/근 부위의 비대가 모든 종자에서 동일하게 일어났지만(데이타 제시 생략) 갈변발현은 실험종자마다 다르게 나타내었다. 즉 자귀풀, 바질, 상추에서는 들깨에서처럼 갈변증상이 있었지만(A group) 양파, 당근, 벼 등에서는 애기장대처럼 갈변증상이 발현되지 않아(B group) 식물종에 따라 두가지 타입으로 나뉘어지는 흥미로운 현상을 보였다(Fig. 4). 왜 이런 생리현상이 일어나는지에 대해선 불명확하며 추후연구가 필요하겠다.
Microtuble assembly 저해제 dithiopyr의 처리효과
Microtubule assembly를 저해하는 dithiopyr를(WSSA, 2020) 가지고 들깨 종자에 대해 실험해 본 결과, 유묘의 생장저해와 함께 10 µM 이상에서부터 근부위의 비대가 일어났지만 갈변증상은 전혀 관찰되지 않았으며(Table 6; Fig. 5) 다른 종자인 자귀풀이나 애기장대에서도 마찬가지 결과를 얻었다(Fig. 5).
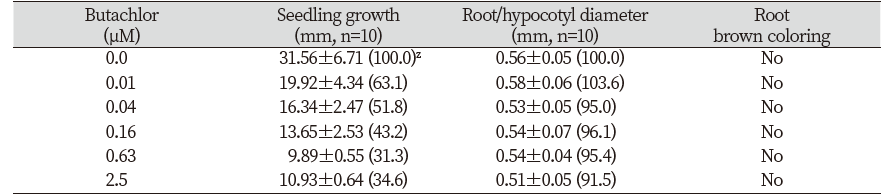
장쇄 지방산 생성 저해제 butachlor의 처리효과
Very long chain fatty acids (VLCFAs) 생성을 저해하는 butachlor (WSSA, 2020)를 가지고 들깨 종자에 대해 실험해 본 결과, 유묘의 생장저해는 있었지만 근부위의 비대와 갈변증상은 전혀 관찰되지 않았으며(Table 7; Fig. 6) 다른 종자인 자귀풀이나 애기장대에서도 마찬가지 결과를 얻었다(Fig. 6).
오옥신 유사작용을 나타내는 florpyrauxifen-benzyl의 처리효과
오옥신 유사작용을 나타내는 합성화합물 florpyrauxifen-benzyl를 가지고(Bell et al., 2015; WSSA, 2020) 들깨 종자에 대해 실험해 본 결과, 유묘의 생장저해와 함께 0.01 µM 이상에서부터 하배축/근 부위의 비대가 일어났지만 갈변증상은 거의 관찰되지 않았다(Table 8; Fig. 7). 다른 종자인 바질이나 상추에서도 마찬가지 결과를 얻었다(Fig. 7).
이상의 실험결과를 종합해 볼 때(Table 9), 공시된 약제에 대한 제초증상은 사용된 종자에 따라 약간 다르게 나타났다. 즉, 유묘신장은 모든 공시 종자와 약제에서 억제반응이 동일하게 나타났고, 유묘/근 팽대의 경우는 모든 공시 종자에서 microtubule assembly 저해제로 알려진 dithiopyr, 오옥신 유사작용을 나타내는 florpyrauxifen-benzyl, cellulose 생합성 저해제로 알려진 isoxaben, flupoxam에서 공히 나타났지만 VLCFAs 저해제로 알려진 butachlor에서는 일어나지 않았다. 반면에 근 및 하배축의 흑갈색 침착은 들깨, 자귀풀, 바질, 상추 종자에서 그리고 cellulose 생합성 저해제로 알려진 isoxaben, flupoxam 처리에서만 관찰되었다(Table 9). 한편 본 연구에서는 소개하지 않았지만 근/하배축 팽대 없이 흑갈색 침착만 일으키는 다른 작용기작의 화합물도 존재하였다. 따라서 이들 결과는 특이적으로 나타나는 제초증상, 즉 유묘생장억제+하배축/뿌리 팽대+하배축/뿌리의 갈변이라는 세가지 지표를 기준으로 하여, 특정의 일반종자(들깨, 자귀풀, 바질, 상추 등)를 가지고서 CBI를 보다 손쉽게 선별할 수 있음을 시사해 주었다.
그리하여 종자 유묘생장법을 통하여 셀룰로오스 생합성 저해제를 간단하게 탐색할 수 있는 프로토콜을 작성해 보았으며(Fig. 8), 이는 단순하면서 저비용의 원스텝 스크리닝(one-step screening)으로서 기능을 할 것으로 여겨지며, 앞으로 신규 CBI 제초제 개발에 보다 기여할 것으로 생각된다.
요 약
셀룰로오스 생합성 과정은 신규 제초제 개발에 있어서 매우 중요한 생리과정이다. 셀룰로오스 생합성 저해제(CBI)에서만 나타내는 특이적인 증상을 토대로 일반 식물을 가지고 in vivo 상태에서 CBI를 단번에 분별할 수 있는 방법이 확립된다면 저비용, 고효율로 CBI를 신속히 탐색할 수 있게 될 것이다. 본 연구에서는 이의 가능성을 확인하기 위하여 여러 식물재료와 여러 작용기작의 화합물을 가지고 엽절편법, 유묘신초침지법, 종자유묘생장법을 비교검토해 보았다. 그 결과, 엽절편법과 유묘신초침지법은 활용하기 어려울 것으로 판단되었고 종자유묘생장법에서는 본 목적에 적합한 결과를 얻었다. 종자유묘생장법에서의 공시약제에 대한 제초증상은 사용된 종자에 따라 달랐는데 유묘신장 억제의 경우는 모두에서 동일하게 나타났다. 그러나 근/하배축 팽대의 경우는 모든 공시 종자에서 microtuble assembly 저해제(K1)로 알려진 dithiopyr, cellulose 생합성 저해제(L)로 알려진 isoxaben과 flupoxam, 오옥신 유사작용(O)을 나타내는 florpyrauxifen-benzyl에서 공히 나타났으나 VLCFAs 저해제(K3)인 butachlor에서는 관찰되지 않았다. 근/하배축의 흑갈색 침착은 CBI로 알려진 isoxaben, flupoxam 처리에서만 특징적으로 관찰되었고 실험종자 중에서도 자귀풀, 들깨, 바질, 상추 등에서만 나타났다. 따라서 이들 결과는 특이적으로 나타나는 제초증상(화합물 반응패턴) 분석을 통하여, 특정의 일반종자를 가지고서 CBI를 보다 손쉽게 선별할 수 있음을 시사해 준다.
주요어: 셀룰로오스 생합성저해제, 제초제 작용기작별 특이적 증상, 종자유묘생장법, 화합물 반응패턴 분석. In vivo 생물검정