서 언
Methiozolin은 isoxazoline계열의 화합물로서 화본과 잡초에 대한 높은 살초활성을 가지면서 각종 작물에 안전성을 가지는데 특히 잔디에서 새포아풀, 바랭이 등을 잘 방제하는 성질을 이용하여 잔디 제초제로서 상업화에 성공하였다(Koo et al., 2010). 현재 잔디밭의 포아풀 전문방제 제초제(상표명 포아박사)로서 상업화되어 국내 뿐만 아니라 미국에도 2019년 등록되었다. Methiozolin은 뿌리 및 신초에서 쉽게 흡수되어 체관(phloem)보다는 주로 물관(xylem)을 통해 이동된다(Yu and McCullough, 2014). 피를 대상으로 한 발아전 처리의 경우 조직의 변형, 비틀림과 같은 증상은 전혀 없었으나 제1본엽의 생장정지가 일어나고 약간의 백화 탈색되는 현상을 보였으며, 옥수수 수경재배에서는 처리 6시간 이후부터 뿌리 신규 생장이 신속히 억제되어서 전반적으로 기존의 여러 제초제와는 작용양상이 뚜렷이 구분되기 때문에 신규 작용기작의 제초제일 것으로 추정되었다(Koo et al., 2010).
그동안 methiozolin의 작용기작에 관한 주요 연구내용으로서는 세포벽 생합성의 직·간접적 억제 가능성(Lee et al., 2007), plastoquinone/tocopherol 생합성 과정에서의 tyrosine aminotransferase를 억제한다는 보고(Grossmann et al., 2012)가 있었으며, 최근 본 연구의 실험결과를 가지고 논문을 작성하는 중에 지방산 생합성 과정의 fatty acid thioesterase (FAT)가 methiozolin의 일차 작용점일 것이라는 연구결과(Brabham et al., 2021)가 보고되었다. 한편 methiozolin과 동일한 isoxazoline 계열의 화합물인 cinmethylin은 천연물질인 1,8-cineole 유도체로서 단자엽 잡초 방제 효능을 가지며(Russell et al., 1991) 세포분열을 억제하는 작용이 뚜렷하였다(El-Derek and Hess, 1986). 1985년 개발되어 상업적으로 사용된지 수십년 지났지만 작용점이 불명확한 상태로 있다가(DiTomaso and Duke, 1991; Yang et al., 2010) 2018년 fatty acid thioesterase가 이의 작용점이라는 사실이 Campe et al. (2018)에 의해 구명되었다. 그러나 methiozolin을 비롯한 이들 화합물의 작용생리를 보다 잘 이해하려면 앞으로 더욱 많은 연구결과들이 축적되어야 할 것이다.
본 연구는 methiozolin의 작용점과 살초기작에 대한 이해를 진일보시키기 위해서 수행하였다. 먼저 좀개구리밥(Lemna pausicostata)을 대상으로 발현되는 제초증상을 통해 methiozolin과 cinmethylin의 작용성이 동일한지를 면밀히 비교 검토하고자 하였다. 아울러 그동안의 연구결과에서 methiozolin의 작용성에 영향을 줄 수 있는 여러 가지 식물대사과정, 즉 일반 대사과정의 초기 기질, plastoquinone/tocopherol 생합성 과정, isoprenoid lipid 생합성 과정, 지방산 생합성 과정의 일부 중간산물과 항산화물질들의 공급(supplementation)에 따라 methiozolin에 의해 유도되는 제초증상 및 살초활성이 어떠한 양상으로 증감되는지를 조사하였다. 이들의 결과는 작용점 유추 뿐만 아니라 살초작용에 어떠한 생리요인들이 관여되는지에 대한 정보를 보다 폭넓게 제시해 줄 수 있을 것이기 때문이다.
재료 및 방법
실험 생물
공시된 생물종은 좀개구리밥(Lemna paucicostata PC3033, 이하 LEMPA라고 함)은 일정 조건의 생육실 (온도 25℃, 광주기 14시간, 광도 20-40 μmol m-2s-1 조건)에서 1x mDM 배지에(Kim and Kim, 2020) 계대배양중인 것을 사용하였다.
공시화합물
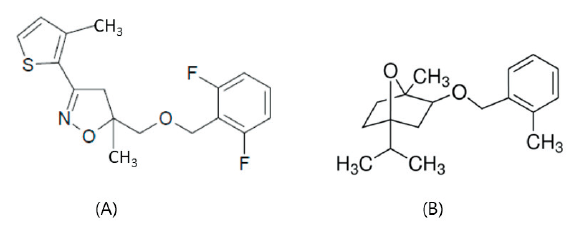
작용생리실험에 기본적으로 사용한 제초제 methiozolin (CAS #: 403640-27-7; Fig. 1A)은 자체 합성한 화합물(순도 99%)을 공시하였고, cinmethylin (CAS #: 87818-31-3; Fig. 1B)은 Supelco사(Pennsylvania, USA)에서 생산한 원제(technical grade, 순도≥98.0%)를 구입하여 사용하였다. 한편, LEMPA에 대한 methiozolin의 작용성 증감에 미치는 영향 실험을 위해서 총 15가지 화합물을 공시하였다(Table 1).
좀개구리밥에 대한 제초활성 평가
기본 배양액(1x mDM)에 여러 농도의 시험용액을 조제한 다음, 투명 플라스틱 컵에 30 mL씩 분주하였다. 그 후 식물생육실에서 계대배양중인 3.9-4.1 frond 생육단계의 좀개구리밥(LEMPA) 5개체를 골라 각각의 시험용액에 접종하였다. 접종된 용기를 직사각형 반투명 플라스틱 박스에 담고 바닥에 일정량 수분을 공급한 다음 증발을 억제하기 위해 투명필름의 덮개를 하고, 생육실(25℃ 항온, 14 hr 명조건, 형광등 45-55 μmol m-2s-1)에 옮겨 5-6일간 배양하였다. 화합물의 활성을 평가하기 위해 먼저 배양 종료후의 생육상태와 제반 증상을 달관조사하였다. 그 후 확대경을 통해 0.1 mm 크기 이상의 엽상체 개수를 조사한 후 생장한 개체 모두를 수집하여 물기를 제거한 다음 생체중(fresh weight, FW)을 측정하였다. 생체중 측정이 완료된 시료는 10 mL methanol이 담긴 falcon tube에 침지시켜 1일 동안 실온 암조건에서 색소를 추출한 후 UV/VIS spectrophotometer (DU800, Beckman Coulter, Brea, USA)를 이용하여 470, 652.4, 665.2 nm에서의 흡광도 값을 측정, Lichtenthaler (1987) 방법에 의해 광합성색소를 정량하였다. 색소가 추출된 잔여시료(residues)는 별도로 수집하여 90℃에 1일 이상 건조시킨 다음 건물중(dry weight of methanol-extracted residues, DWM)을 조사하였다. 공시 화합물의 생육억제활성은 기본적으로 무처리구에 대한 상대 비율(%)로 나타내었다.
좀개구리밥에 대한 methiozolin 제초활성을 경감시키는 여러 가지 화합물의 영향
좀개구리밥에 대한 methiozolin의 활성농도 범위내에서 생리기능에 영향을 주는 여러 가지 화합물을 대상으로 여러 농도조합의 혼합물을 조제한 다음, LEMPA를 접종하여 위에 기술한 평가방법과 동일한 조건에서 5-6일간 배양하면서 methiozolin의 제초활성 경감정도를 조사하였다.
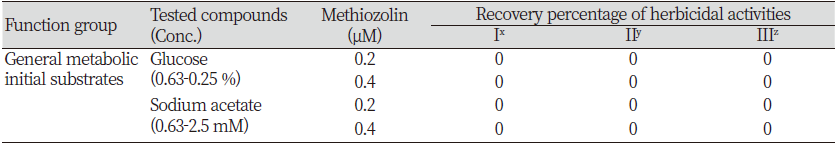
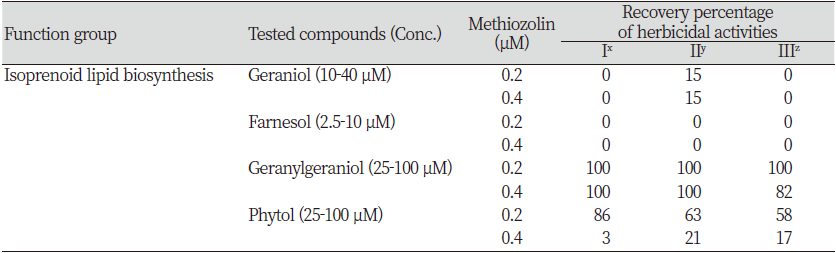
검토된 처리 화학물질과 식물기능으로서는 1) 식물체 기본대사의 초기 기질(substance)인 glucose 또는 acetic acid의 공급에 의해서 methiozolin의 제초활성이 경감되는지, 2) Tyrosine ~ tocopherol 대사과정의 주요 대사물질인 tyrosine, 4-hydroxyphenyl pyruvate (4-HPP), homogentisic acid (HGA), tocopherol 투여에 의해 methiozolin의 제초활성이 경감되는지, 3) Isoprenoid lipid 생합성 과정의 주요 대사물질인 geraniol, farnesol, geranylgeraniol, phytol의 투여에 의해 methiozolin의 제초활성이 경감되는지, 4) 지방산생합성과정의 주요 대사물질인 palmitic acid 또는 oleic acid 투여에 의해 methiozolin의 제초활성이 경감되는지, 5) 항산화 물질 ascorbic acid, β-carotene, Trolox, α-tocopherol 투여에 의해서 methiozolin 제초활성이 경감되는지 등을 조사하였다.
기본적인 실험방법은 앞과 동일하였으며, 좀개구리밥에 각각의 혼합물을 처리한 후 5-6일간 배양한 다음 생육상태와 제반 증상을 달관조사하였다. 여러 화합물이 methiozolin 제초활성을 경감시키는 정도는 methiozolin 제초증상의 세가지 외견상 생육지표, 즉 어린 엽상체의 황화(지표 I), 개체의 비정상적 생장정도(증식억제, 엽상체 포개짐, 생장자세 이상 및 신규 엽상체의 소형화 등) (지표 II), 근생장 억제(지표 III)를 가지고 무처리 대비 회복정도의 상대적 평가를 수행하였다.
엽록소 형광분석
좀개구리밥에 methiozolin과 cinmethylin 약제를 처리한 다음 6일 배양후 엽상체를 대상으로 FluoPen (FP110/D, Photon Systems Instrument, Drásov, Czech Republic)을 이용하여 엽록소 형광분석을 통해 OJIP와 NPQ1 반응패턴을 조사하였다.
결과 및 고찰
좀개구리밥에 대한 methiozolin과 cinmethylin의 제초활성특성 비교
서로 다른 화학구조를 가졌을지라도 처리후 동일한 제초증상이 발현되면 식물체 내에서 같은 작용점을 가진다라고 추정할 수 있다. 본 연구에서는 개구리밥과(Lemnaceae) 식물을 가지고 methiozolin과 cinmethylin이 같은 피해증상을 유발하는지를 면밀히 조사하였다. 두 약제를 개구리밥(Spirodela polyrhiza)에 처리한 경우 정확히 동일증상이 발현되었던 것처럼(data not shown) 좀개구리밥(LEMPA)에 처리한 경우에도 동일하게 개체증식억제 및 엽상체 소형화, 배양초기에서의 어린 엽상체 황화(chlorosis)와 배양후기에서의 엽상체 접합부위 백화, 엽상체 형태 이상 및 엽상체 포개짐, 헛뿌리 생장억제, 엽상체 일부조직에서의 수침현상/투명화(hyperhydricity/vitrification) 발현 등의 제초증상이 나타났다(Fig. 2). Cinmethylin 처리후 얻어진 생장지표의 처리농도별 반응패턴은, 엽상체 개수(frond number dish-1)의 경우 저농도 처리에서는 무처리구에 비해 개수가 소폭 증가하다가 농도가 증가함에 따라 감소하였다(Table 2). 그러나 생체중(FW dish-1), 건물중(DWM dish-1) 및 엽상체 개당 생체중은 농도가 증가함에 따라 감소하였으며, 생체중 대비 건물중은 증가하는 경향이었다. 이들의 패턴은 methiozolin 처리에서도 유사한 경향이었다. 한편 cinmethylin 처리후 얻어진 광합성 색소함량지표의 처리농도별 반응패턴에 있어서, 엽록소(total chlorophylls dish-1)와 카로티노이드(total carotenoids dish-1) 함량 및 엽록소 함량 대비 카로티노이드 함량비율은 화합물처리 농도 증가에 따라 감소하였다(Table 3). 한편 약제처리농도에 따른 건물중 단위무게당 엽록소 함량은 큰 변화가 없었다. 또한 광합성 색소함량의 변동은 methiozolin 처리에서도 동일하게 나타나는 경향이었다.
Table 2. Effect of cinmethylin and methiozolin on the growth of Lemna pausicostata.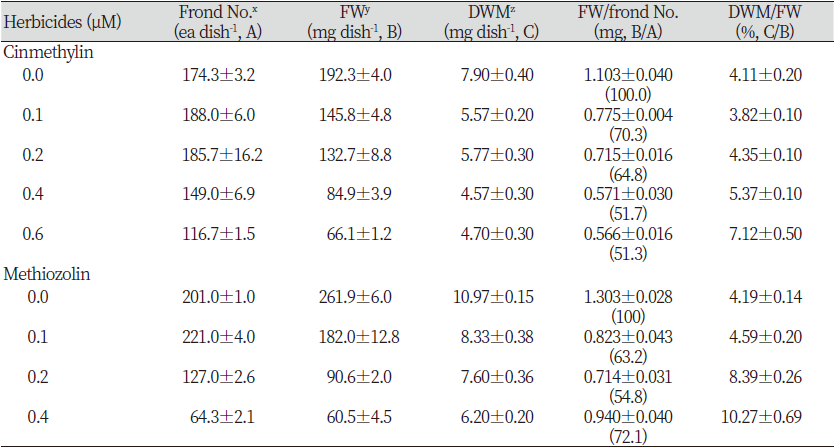
|
Table 3. Effect of cinmethylin and methiozolin on the photosynthetic pigments content of Lemna pausicostata.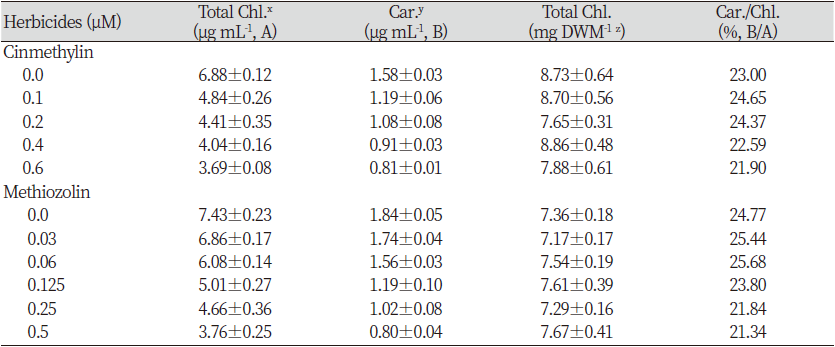
|
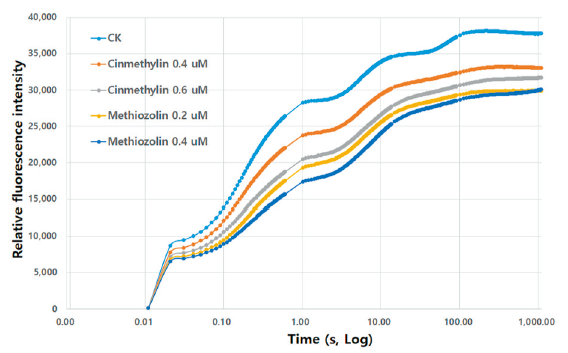
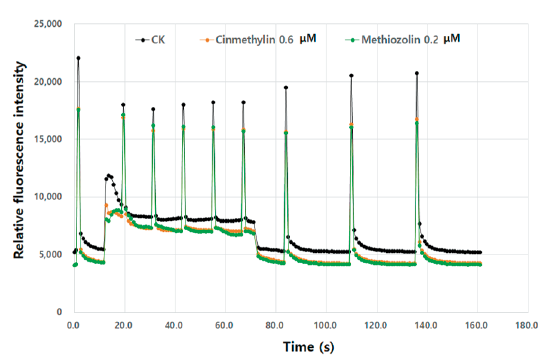
한편 엽록소 형광분석으로 methiozolin과 cinmethylin간의 반응차이를 검토해 보았다. Chlorophyll fluorescence fast-transient analysis (OJIP)는 광합성전자전달계의 전자흐름 장애 여부를 판단할 수 있는 바, diuron과 같은 PSII 저해제는 JI부위의 급격한 상승이 나타나지만(Battaglino et al., 2021) 본 실험의 경우엔 diuron 패턴과는 달리 전체적으로 낮은 전자흐름을 보였으며 두 제초제는 같은 양상을 나타냈다(Fig. 3). 또한 non-photochemical quenching (NPQ)은 과잉 빛에너지의 열분산을 나타내는 지표로서 thylakoid membrane energization과 밀접한 관련이 있다고 알려져 있는데(Pinnola and Bassi, 2018), 제초제 처리시 전체적으로 더 낮아지는 양상을 보여 무처리구와는 뚜렷한 차이를 나타내었지만 두 제초제 간에는 동일한 패턴을 나타내었다(Fig. 4). 공시화합물에 의해 NPQ값이 무처리에 비해 낮아진 이유는 어떤 원인에 의해 thylakoid membrane 기능이 전반적으로 장애를 받고 있기 때문으로 추정된다. 따라서 이상의 여러 가지 실험결과들을 종합해 볼 때, 두 제초제는 식물체 내에서 동일한 작용점을 가지는 것으로 여겨졌다.
Glucose 또는 acetic acid가 methiozolin 제초활성 경감에 미치는 효과
식물에 있어서 glucose는 광합성의 일차산물로서 에너지 대사, cellulose/지방산/핵산/아미노산 등과 같은 구조분자 생성, starch와 같은 저장물질 생성과정의 주요 기질로서 사용된다. Glucose (0.063-0.25%)를 LEMPA 생장시 추가공급했을 때, 외견상의 특별한 증상없이 엽상체 개수(처리구 당 개수)가 무처리구에 비해 감소되고 건물중(처리구 당 mg)은 증가되며, 엽록소 함량(g 건물당 mg)은 감소되는 경향을 나타낸다. 그런데 methiozolin과 함께 처리할 때 methiozolin (0.1-0.2 μM) 처리에 의한 엽상체 개수 감소를 미약하게나마 회복시키는 경향이었지만 건물중과 엽록소 함량에는 별다른 영향을 주지 않으면서 각자의 활성만 나타내었다. 한편 methiozolin 0.4 μM과 glucose 혼합 처리시에는 methiozolin 단독효과만을 나타내었다(data not shown).
아세트산은 세포내에서 acetyl-CoA 등으로 바뀌어 TCA 회로에 유입, ATP 생산에 사용되거나 lipid 또는 flavonoid와 같은 다른 대사과정에 사용될 수 있다(Rasheed et al., 2018; Perez de Souza et al., 2020). 아세트산(0.063-2.5 mM)을 LEMPA 생장시 추가공급했을 때, 외견상의 특별한 증상없이 엽상체 개수와 엽록소 함량의 감소가 아주 미약하게 관찰되었지만 건물중에는 거의 영향이 없었다. 이를 methiozolin과 함께 처리할 경우, methiozolin (0.1-0.4 μM) 처리에 의한 생장억제 또는 제반증상을 아세트산이 회복시키거나 증강시키는 영향이 없었다(data not shown). 따라서 glucose나 아세트산의 공급은 methiozolin의 작용성에 그다지 영향을 미치지 않는 것으로 여겨졌다(Table 4).
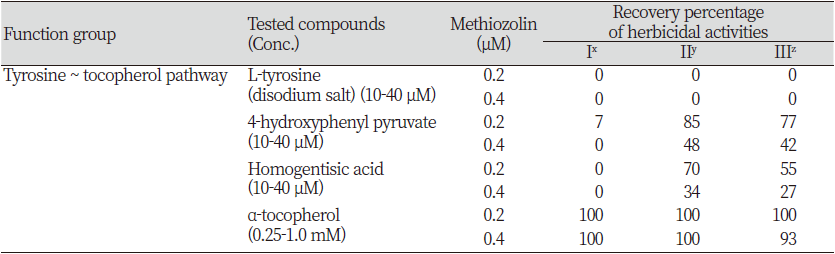
Tyrosine ~ tocopherol 대사과정 주요물질이 methiozolin 제초활성 경감에 미치는 효과
Tyrosine은 비필수 아미노산으로서 shikimate pathway를 통해 주로 생합성되며 각종 단백질 생합성의 기질, 신경전달물질 및 호르몬의 전구물질, alkaloids/natural phenols/melanin pigment/coenzyme Q10/plastoquinones/tocopherols 등의 전구물질, 광계 II에서의 산화된 엽록소의 환원을 위한 electron donor로서 역할을 한다(Liu and Lu, 2016; Wikipedia, 2021). Tyrosine은 tyrosine aminotransferase에 의해 4-hydroxyphenyl pyruvate (HPP)로 이어서 4-hydroxyphenylpyruvate dioxygenase (HPPD) 효소에 의해 homogentisic acid (HGA)로 전환된다(Pellaud and Mène-Saffrané, 2017). HGA는 phytyl pyrophosphate (PPP)와 반응하여 tocopherol이, HGA와 solanesyl pyrophosphate (SPP)은 homogentsate solanesyltransferase (HST)와 반응하여 2-methyl-6-solanesyl-1,4-benzoquinol이 되고 이들을 통해 plastoquinone이 생합성되며(Liu and Lu, 2016; Pellaud and Mène-Saffrané, 2017), geranylgeranyl pyrophosphate (GGPP)와 반응하여 tocotrienol 등이 생합성된다고 한다(Pellaud and Mène-Saffrané, 2017). 여기에서 HPPD 효소는 callistemone, isoxazole, pyrazole, triketone 계열의 여러가지 제초제의 작용점이며(WSSA, 2021), HST 효소는 cyclopyrimorate의 작용점(Shino et al., 2018)으로 알려져 있다. HGA와 PPP의 결합을 통해 최종적으로 생성된 tocopherol은 활성산소종(reactive oxygen species) 소거, 막안정화(membrane stabilization), 효소활성 조절, 세포신호전달(cellular signaling), 세포증식(cell proliferation) 및 유전자 발현 등에 영향을 미친다고 알려져 있다(Dumanović et al., 2021; Niki and Abe, 2019; Trebst, 2003).
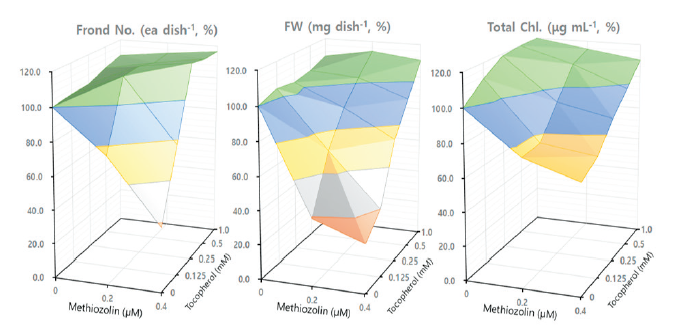
본 연구에서는 상기 대사과정상에서 tyrosine, HPP, HGA 및 α-tocopherol의 영향을 검토하였다. Tyrosine (2.5-10 μM)를 LEMPA 생장시 추가공급했을 때, 그 자체로는 외견상 특별한 증상도 없을 뿐만 아니라 엽상체 개수, 건물중, 광합성 색소 함량 등도 변함이 없었다. 그런데 tyrosine+methiozolin 처리의 경우, 0.1-0.2 μM methiozolin에서는 별다른 영향이 없었지만(Table 5) 0.4 μM methiozolin 처리시에는 methiozolin에 의한 엽상체 개수 및 건물중 감소를 tyrosine이 미약하게나마 오히려 증진시키는 경향을 보였으나(data not shown), methiozolin 제초증상의 외견상 생장지표를 회복시키지는 못하였다(Table 5). HPP (10-40 μM)를 LEMPA 생장시 추가공급했을 때, 그 자체로는 외견상 특별한 증상도 없을 뿐만 아니라 엽상체 개수와 광합성 색소 함량에는 영향을 미치지 않았고 건물중의 경우는 약간 감소되는 경향이었다. 그런데 methiozolin과 함께 처리할 경우, 0.2-0.4 μM methiozolin+HPP 처리시에는 methiozolin에 의한 엽상체 개수 감소가 HPP에 의해 상당히 회복되었지만 건물중 감소는 약간만 회복되었으며, 광합성 색소함량은 별다른 변화가 없었다(data not shown). Methiozolin 제초증상의 외견상 생장지표들을 통해 HPP처리에 의한 회복효과를 조사했을 경우, 지표 I은 거의 회복되지 못했지만 지표 II의 경우는 methiozolin 0.2, 0.4 μM 처리시 각각 85, 48%의 회복효과가 있었고 지표 III의 경우는 각각 77, 42%의 회복 효과를 나타내었다(Table 5). HGA (10-40 μM)를 처리한 경우에도 HPP와 거의 비슷한 경향를 보였으나 회복효과 면에서는 HPP보다 약 15% 정도 감소하였다(Table 5). α-Tocopherol (0.25-1.0 mM)을 LEMPA 생장시 추가공급했을 때, 그 자체로는 외견상 특별한 이상 증상 없이 엽상체 개수가 10% 정도 증가되었지만 건물중과 광합성 색소 함량에는 거의 변화가 없었다. 그런데 0.2-0.4 μM methiozolin+tocopherol 처리시에는 methiozolin에 의한 엽상체 개수, 건물중 및 엽록소 함량 감소가 거의 100% 회복되었다(Fig. 5). Methiozolin 제초증상의 외견상 생장지표 세가지를 통해 tocopherol 처리에 의한 회복효과를 달관조사했을 경우, 혼합처리농도 조합에서 지표 I, II, III 모두 거의 회복되는 효과를 나타내었다(Table 5; Fig. 6).
Isoprenoid lipid 대사과정 주요물질이 methiozolin 제초활성 경감에 미치는 효과
엽록체와 세포질은 각각 다른 기질을 이용하여 5탄소 골격의 isopentenyl pyrophosphate (IPP)를 생성하며 IPP를 기본단위로 하여 탄소 10개의 geranyl pyrophophate (GPP), 탄소 15개의 farnesyl pyrophophate (FPP), 탄소 20개의 geranylgeranyl pyrophophate (GGPP)의 지질성분이 생합성된다. GPP를 전구물질로 하여 GGPP, monoterpenes 등이 생성되고(Pulido et al., 2012), FPP를 전구물질로 하여 polyprenols, triterpenes, sterols, brassinosteroids, sesquiterpenes, prenylated proteins 등이 생성되며(Pulido et al., 2012), GGPP를 전구물질로 하여 chlorophylls, tocopherols, phylloquinone, carotenoids, plastoquinone, prenylated proteins 등이 생성되어(Gutbrod et al., 2019; Pulido et al., 2012) 생체내 제반 생리기능에 기여한다. 한편 탄소 20개의 phytyl pyrophosphate는 chlorophyllide와 반응하여 chlorophyll의 구성성분이 되며, 비타민 E와 비타민 K1 합성의 전구물질로도 사용될 수 있다(Gutbrod et al., 2019).
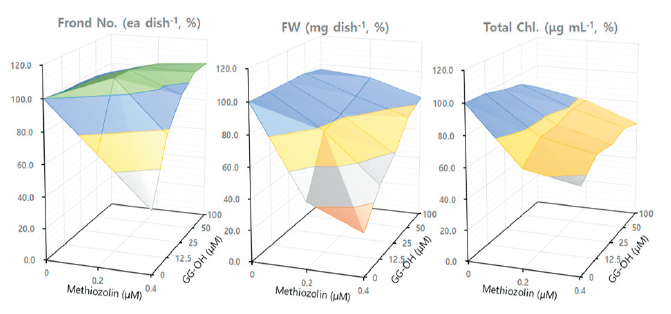
본 연구에서는 상기 대사과정의 중간물질로 역할을 할 수도 있는 geraniol (G-OH), farnesol (F-OH), geranylgeraniol (GG-OH), phytol을 대상으로 methiozolin의 제초활성 경감에 미치는 영향을 검토해 보았다. G-OH (10-40 μM)를 LEMPA 생장시 추가공급했을 때, 외견상 특별한 증상도 없을 뿐만 아니라 엽상체 개수, 건물중, 광합성 색소 함량 등도 변함이 없었다. 그런데 methiozolin과 함께 처리할 경우, 0.2-0.4 μM methiozolin+G-OH 처리시에는 methiozolin에 의한 엽상체 개수 및 건물중 감소를 매우 미약하게나마 회복시키는 경향을 보였지만 광합성 색소에 대해서는 영향이 없었다(data not shown). 마찬가지로 methiozolin 제초증상의 외견상 생장지표 세 가지를 통해 G-OH 처리에 의한 회복효과를 달관조사했을 경우, 혼합처리농도 조합에서 지표 I과 지표 III에서는 회복효과가 없었지만 지표 II에서는 약 15%의 회복효과를 나타내었다(Table 6). F-OH (2.5-40 μM)를 LEMPA 생장시 추가공급했을 때, 농도에 의존하여 제초활성효과가 현저히 나타났는데 40 μM에서는 개체가 거의 모두 고사하는 정도였다(data not shown). 이러한 특성의 F-OH를 0.2-0.4 μM methiozolin과 혼합처리할 때 methiozolin에 의한 제초활성의 회복효과는 관찰할 수 없었다(Table 6). 한편 GG-OH (25-100 μM)를 LEMPA 생장시 단독으로 공급했을 때, 외견상 특별한 증상없이 엽상체 개수, 건물중, 광합성 색소 함량 등이 매우 미약하게 감소하는 경향이었다. 그런데 0.2-0.4 μM methiozolin+GG-OH 처리시에는 methiozolin에 의한 엽상체 개수, 건물중, 광합성 색소 감소를 완전히 회복시켰으며 엽상체 개수는 오히려 증진되는 결과를 보였다(Fig. 7). 마찬가지로 methiozolin 제초증상의 외견상 생장지표 세 가지를 통해 GG-OH 처리에 의한 회복효과를 달관조사했을 경우, 0.2 μM methiozolin 혼합처리에서는 지표 I, II, III 모두 100% 회복되었으며, 0.4 μM methiozolin 혼합처리에서는 지표 I과 지표 II에서는 100% 회복되었으나 지표 III의 뿌리 생장억제 회복은 82% 정도만 이루어졌다(Table 6; Fig. 8). 그리고 phytol (25-100 μM)을 LEMPA 생장시 단독으로 공급했을 때, 외견상 특별한 증상없이 엽상체 개수, 건물중, 광합성 색소 함량 등이 매우 미약하게 감소하는 경향이었다. 그런데 0.2-0.4 μM methiozolin+phytol 처리시에는 methiozolin에 의한 엽상체 개수, 건물중, 광합성 색소 감소를 어느 정도 회복시켰지만 GG-OH보다는 회복효과가 낮았고 활성농도폭이 좁은 경향이었다(data not shown). 마찬가지로 methiozolin 제초증상의 외견상 생장지표 3가지를 통해 phytol 처리에 의한 회복효과를 달관조사했을 경우, 0.2 μM methiozolin에서는 지표 I, II, III에서 각각 86, 63, 58% 정도 회복됨으로서 엽상체 황화에 대한 회복 효과가 상대적으로 높은 경향이었지만, 0.4 μM methiozolin에서는 전반적으로 회복효과가 급감하였다(Table 6).
지방산 생합성과정의 palmitic acid 또는 oleic acid가 methiozolin 제초활성 경감에 미치는 효과
Eukaryotic cell에서의 지방산 생합성은 엽록체의 스트로마에서 acetyl-CoA와 malonyl-CoA와의 결합에 의해 출발한다. 이어 fatty acid synthase complex (FAS) 활성에 의해 palmitoyl-ACP (16:0-ACP)와 stearoyl-ACP (18:0-ACP)가 생성되며 18:0-ACP는 fatty acid desaturases (FADs) 작용에 의해 oleoyl (18:1)-ACP로 전환된다. 이들 fatty acyl-ACP는 각각의 fatty acyl-ACP thioesterase (FAT)에 의해 free fatty acids로 변환되어 세포질로 빠져나간 다음, 세포질에서 acyl-CoA로 전환된 후 소포체(endoplasmic reticulum)에서 glycerides 생성에 쓰이고 이어서 FADs에 의해 linoleate (18:2)-, linolenate (18:3)-lipid가 생성된다(He et al., 2020). 이들 acyl-CoA 또는 glycerides은 더욱 반응이 진전되어 긴사슬지방, 당지질, 인지질 등으로 전환되는 바, 이들 지질성분은 기본적으로 세포막의 구성성분, 단백질의 표적이동, 여러 세포기능의 signal molecules (생체내 전령)로서 역할을 할 뿐만 아니라 생체에너지 저장 기능도 한다(Caillaud, 2019; He and Ding, 2020; Hernández and Cejudo, 2021; Yoshihara et al., 2021)
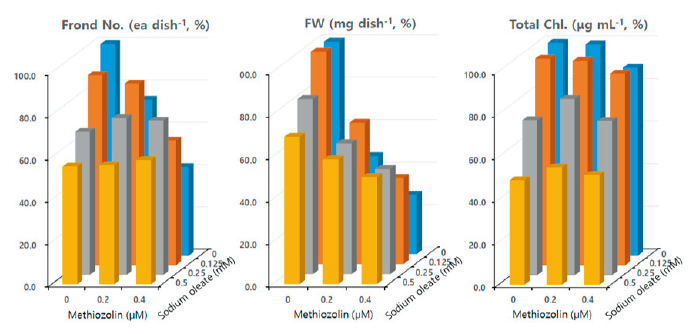
본 연구에서는 상기 대사과정의 중간물질로 역할을 할 수 있는 palmitate와 oleate를 대상으로 methiozolin의 제초활성 경감에 미치는 영향을 검토해 보았다. Sodium palmitate (0.63-1.0 mM)를 LEMPA 생장시 단독 공급했을 때, 농도에 의존하여 외견상 특별한 이상 증상없이 엽상체 개수, 건물중, 광합성 색소 함량 등을 비교적 뚜렷하게 감소시키는 경향이었다(data not shown). 이러한 특성의 palmitate를 0.1-0.4 μM methiozolin과 혼합처리하였을 때 methiozolin에 의한 엽상체 개수와 건물중 감소에 있어서 약간의 회복효과가 있었고 상대적으로 엽상체 개수의 회복효과가 높았지만, 광합성 색소감소의 회복효과는 관찰되지 않았다(data not shown). 마찬가지로 methiozolin 제초증상의 외견상 생장지표 세 가지를 통해 sodium palmitate 처리에 의한 회복효과를 달관조사했을 경우, 0.2 μM methiozolin에서는 지표 I, II, III에서 각각 0, 14, 4% 정도 회복시킴으로서 상대적으로 비정상적 생장으로부터의 회복 효과가 약간 나타났지만, 0.4 μM methiozolin에서는 회복효과가 전혀 없었다(Table 7). 한편 sodium oleate (0.125-0.5 mM)를 LEMPA 생장시 단독 공급했을 때, 농도에 의존하여 외견상 특별한 이상 증상없이 엽상체 개수, 건물중, 광합성 색소 함량 등이 비교적 뚜렷하게 감소되는 경향이었다(Fig. 9). 이러한 특성의 sodium oleate를 0.2-0.4 μM methiozolin과 혼합처리하였을 때 methiozolin에 의한 엽상체 개수, 생체중, 광합성 색소감소의 뚜렷한 회복효과가 나타났다(Fig. 9). 마찬가지로 methiozolin 제초증상의 외견상 생장지표 세 가지를 통해 sodium oleate 처리에 의한 회복효과를 달관조사했을 경우, 0.2 μM methiozolin에서는 지표 I, II, III에서 모두 sodium oleate 단독처리시의 효과 정도까지 100% 회복되었고, 0.4 μM methiozolin에서는 각각 100, 100, 82%의 회복효과를 보였다(Table 7; Fig. 10).
여러 가지 항산화물질이 methiozolin 제초활성 경감에 미치는 효과
식물에서의 대사과정은 대부분 산소를 기반으로 하기 때문에 여러 가지 활성산소종의 생성은 필수적인데 특히 엽록체 내의 광합성계 또는 생체막 산화과정에서 그 정도가 뚜렷하다. 이들 활성산소종은 반응성이 높아 적정 농도 이하로 제어되지 않으면 유해한 결과가 초래되기 때문에 이를 방어하기 위하여 식물세포내에서는 항산화 시스템이 잘 발달되어 있다. 항산화 시스템은 일반적으로 효소적 시스템과 비효소적 시스템으로 구분할 수 있다. 효소적 시스템으로서 glutathione peroxidase, ascorbate peroxidase, superoxide dismutase, catalase 등의 역할이 잘 밝혀져 있다(Dumanović et al., 2021; Pinnola and Bassi, 2018), 비효소적 시스템으로서는 ascorbate (ASC), glutathione, carotenoids, plastoquinones, tocopherols 등의 물질이 있는데(Dumanović et al., 2021; Pinnola and Bassi, 2018), 이들 중에서 친수성인 ASC와 glutathione은 세포질에서, 친유성인 carotenoids와 tocopherols은 주로 세포막에서 기능한다.
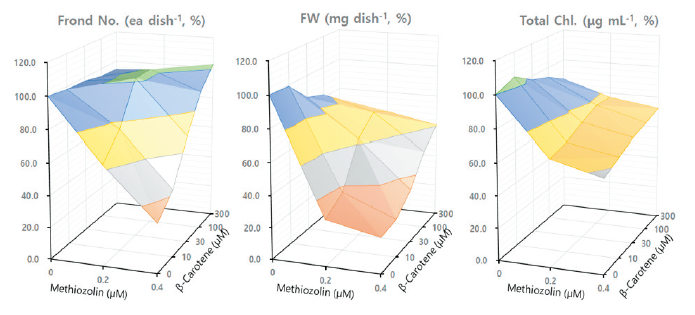
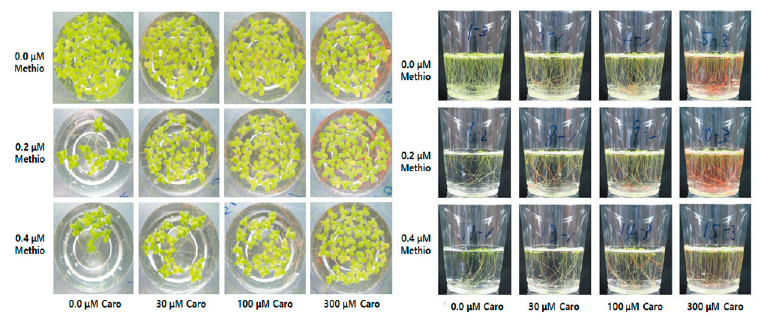
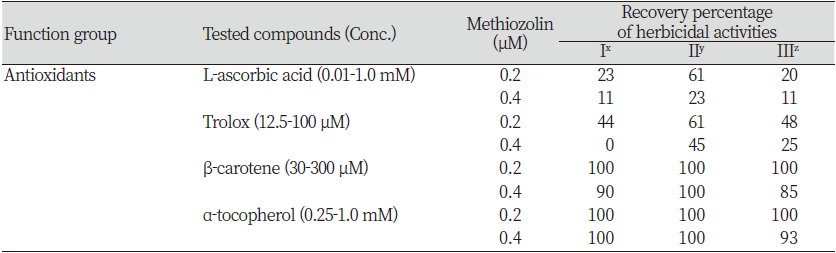
본 연구에서는 항산화 활성을 갖는 ascorbic acid, Trolox (수용성 비타민 E 유도체), β-carotene, α-tocopherol (vitamine E)을 대상으로 methiozolin의 제초활성 경감에 미치는 영향을 검토하였다. Ascorbic acid (0.01-1.0 mM)를 LEMPA 생장시 단독 공급했을 때, 농도에 의존하여 외견상 특별한 이상 증상없이 엽상체 개수와 광합성 색소 함량은 약간씩 감소되었지만 건물중은 증가되는 경향이었다(data not shown). Ascorbic acid를 0.1-0.4 μM methiozolin과 혼합처리 하였을 때 methiozolin에 의한 엽상체 개수, 건물중, 광합성 색소 감소에 있어서 약간의 회복효과가 있었다(data not shown). 마찬가지로 methiozolin 제초증상의 외견상 생장지표 세 가지를 통해 ascorbic acid 처리에 의한 회복효과를 달관조사했을 경우, 0.2 μM methiozolin에서는 지표 I, II, III에서 각각 23, 61, 20% 정도 회복되었고, 0.4 μM methiozolin에서는 각각 11, 23, 11%의 회복효과를 보였다(Table 8). Trolox (12.5-100 μM)를 LEMPA 생장시 단독으로 공급했을 때, 농도가 증가함에 따라 엽상체 개수와 건물중은 감소되었지만 광합성 색소 함량에는 별다른 영향을 미치지 않았다(data not shown). 이러한 특성의 Trolox를 0.2-0.4 μM methiozolin과 혼합처리하였을 때, 엽상체 개수와 건물중 감소는 어느 정도 회복되었지만 광합성 색소감소에 대한 회복효과는 미미한 경향이었다(data not shown). 마찬가지로 methiozolin 제초증상의 외견상 생장지표 세 가지를 통해 Trolox 처리에 의한 회복효과를 달관조사했을 경우, 0.2 μM methiozolin에서는 지표 I, II, III에서 각각 44, 61, 48% 정도 회복되었고, 0.4 μM methiozolin에서는 각각 0, 45, 25%의 회복효과를 보여 ascorbic acid 처리에서와 같이 생장회복 효과가 상대적으로 약간 높게 나타났다(Table 8). β-carotene (30-300 μM)를 LEMPA 생장시 단독으로 공급했을 때, 농도가 증가함에 따라 외견상 특별한 이상 증상없이 건물중이 감소되었지만 광합성 색소 함량은 증가되었고, 엽상체 개수에는 거의 영향을 미치지 않았다(data not shown). 이러한 특성의 β-carotene을 0.2-0.4 μM methiozolin과 혼합처리하였을 때 엽상체 개수는 완전히 회복되었고, 건물중과 광합성 색소의 회복은 중간정도로서 β-carotene 단독처리 만큼은 회복되지 않았다(Fig. 11). 마찬가지로 methiozolin 제초증상의 외견상 생장지표 세 가지를 통해 β-carotene 처리에 의한 회복효과를 달관조사했을 경우, 0.2 μM methiozolin에서는 지표 I, II, III에서 모두 100% 회복되었고, 0.4 μM methiozolin에서는 각각 90, 100, 85%의 회복효과를 보여 약해로부터의 회복 효과가 상대적으로 높게 나타났다(Table 8; Fig. 12). 한편 methiozolin 제초활성 경감에 미치는 α-tocopherol (vitamine E)의 처리효과는 앞에서 기술한 바와 같이 매우 높은 회복효과를 나타냈다(Table 5; Fig. 5 and 6)
이상의 결과를 토대로 검토해 볼 때, 항산화 물질이 methiozolin 제초활성 경감에 미치는 효과에 있어서는, 세포질에서 항산화 작용을 하는 ascorbic acid와 Trolox 보다는 세포막에서 항산화작용을 하는 β-carotene과 α-tocopherol 처리에서 높은 약해 경감효과를 보였고 chlorosis 증상의 회복도 뚜렷한 경향을 나타내었다.
이상의 실험결과를 종합해 볼 때, methiozolin과 cinmethylin은 좀개구리밥에서 동일한 제초증상이 발현되었고(개체증식억제, 엽상체 일부조직 황화, frond stack, 엽상체 형태 이상, 헛뿌리 생장억제 등), 제초활성 생리지표들에 있어서도 같은 패턴을 나타내었다. 그리고 식물대사과정의 중간산물 공급에 따른 methiozolin 살초작용성의 증감을 조사한 결과, methiozolin에 의해 나타나는 제초증상의 세 가지 지표 모두를 거의 회복시키는 화합물은 sodium oleate (Table 7), geranylgeraniol (Table 6), β-carotene (Table 8), α-tocopherol (Table 8)이었다. 일반적으로 어떤 화합물이 대사과정의 특정 효소를 억제할 경우 그 효소의 기질을 외부에서 공급하면 억제작용이 잘 회복되지 않지만 그 작용효소의 산물을 공급했을 때 억제작용이 회복된다면 그 효소가 작용점일 가능성이 있는 것으로 판단한다. 이러한 가능성을 토대로 검토해 보았을 때 본 실험의 경우에 가장 적합한 양상을 보인 것은 sodium oleate 처리 결과이다. 한편 isoprenoid 생합성과정의 geranylgeraniol도 methiozolin 제초증상에 대해 매우 높은 회복효과를 나타내었지만 이는 대사과정 중 GGPP 이전 단계의 특정효소를 저해하였기 때문이라기 보다는 다른 간접적 원인에 의해 회복되었을 가능성이 있다. 왜냐하면 GPP-GGPP 이전단계 어느 지점을 methiozolin이 억제하였다면 G-OH, F-OH, GG-OH 공급처리 모두에서 어느 정도 비슷한 회복효과를 나타냈어야 하나 그러지 않았기 때문이다. 연구보고에 의하면 farnesol과 geranylgeraniol는 대사과정에서 기질로서의 역할(Gutbrod et al., 2019) 이외에 막구조(membrane structure)의 조절과 안정화에도 기여한다고 하였다(Funari et al., 2005). 그리고 β-carotene과 α-tocopherol의 공급에 의한 methiozolin 제초증상의 완전한 회복도 이들 물질의 생합성과정을 억제했기 때문이 아닐 가능성이 있다. 왜냐하면 carotenoid와 tocopherol 생합성 과정상의 특정 효소를 억제하는 화합물들은 작용생리 특성상 식물체의 백화를 유도하는 특징을 가지기 때문이다(Clough et al., 2016; Ndikuryayo et al., 2017). 그러나 methiozolin은 근본적으로 잡초의 완전한 백화를 유도시켜 제초작용을 나타내는 화합물이 아니기 때문에(Brabham et al., 2021; Koo et al., 2010) 본 실험에서의 β-carotene과 α-tocopherol 처리에 의한 methiozolin 제초증상의 회복은 활성산소의 제거나 막안정화와 같은(Domonkos et al., 2013; Guidi et al., 2017; Trebst, 2003) 간접적 효과라 여겨진다.
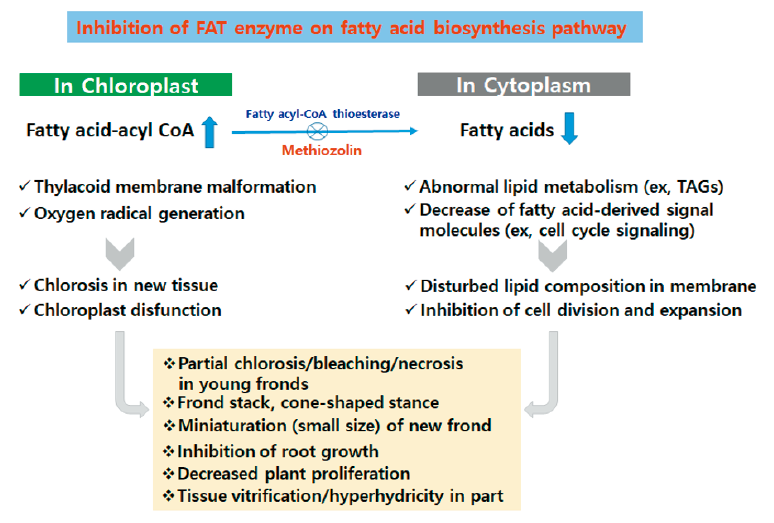
Methiozolin의 좀개구리밥에 대한 주요 제초증상으로서 1) 어린 엽상체의 황화, 2) 증식억제, 엽상체 포개짐, 생장자세 이상 및 신규 엽상체의 소형화 등과 같은 개체의 비정상적 생장, 3) 근신장 억제 등을 들 수 있다. 본 실험결과를 통해 이러한 증상이 어떻게 해서 유도되었을지를 유추해 보면, 먼저 약제 처리시 어린 조직에서 황화증상(chlorosis) 증상이 발현되므로 methiozolin의 작용은 엽록체에서 이루어지는 것으로 사료된다. 즉 분화된 어린 식물조직이 발달하려면 세포분열과 함께 세포성장이 이루어지고 세포내 소기관도 함께 발달되어야 한다. 엽록체의 경우도 틸라코이드막을 비롯하여 광합성 색소를 포함한 광합성계 구성물질의 왕성한 생성과 막내로의 유입 및 안정화가 진행되어야 한다. 그런데 어떠한 원인으로 인해 막이 안정화되지 않을 때에는 유입된 색소 특히 엽록소도 쉽게 소실될 것이기 때문이다. 한편 개체증식(분열)의 억제와 근신장의 현저한 감소는 methiozolin이 세포분열 및 생장의 억제와 밀접한 관련이 있음을 시사한다. 세포분열억제는 여러 가지 원인에 의해 나타날 수 있지만 methiozolin이 잡초에 처리되었을 때 나타나는 전반적인 증상으로 보아 기존의 장쇄지방산(very long chain fatty acid) 생합성 저해제, tubulin 또는 셀룰로오스 생합성 저해제 등과는 다르며 오히려 acetyl CoA carboxylase (ACCase) 저해제에 가깝다. 여러 보고에 의하면 지방산 생합성과정을 통해 생성되는 여러 가지 지질 성분은 막구성 뿐만 아니라 세포분열 및 기타 신호전달물질로서도 역할을 하여 다방면의 생리기능에 기여하는 것으로 알려지고 있다(Caillaud, 2019; He et al., 2020; Hernández and Cejudo, 2021; Yosihara et al., 2021). 그렇기 때문에 methiozolin이 지방산생합성을 저해한다고 가정했을 경우, 좀개구리밥에서 나타나는 여러가지 비정상적 생장의 원인을 잘 설명할 수 있다. 즉, methiozolin은 엽록체 내의 막구조 형성과 안정화(membrane formation and stabilization)에 장애를 일으켜 엽록소의 소실을 동반하면서 황화 및 활성산소 발생을 초래하고, 아울러 lipid signaling system의 교란에 따른 세포분열억제가 강하게 동반되어 생장정지 및 변형이 유도되는 것으로 여겨진다(Fig. 13). 이상의 제반 실험결과와 기존의 타 연구결과들을 종합검토해 볼 때, cinmethylin처럼 엽록체 내의 지방산 생합성과정의 fatty acid thioesterase 저해가(Brabham et al., 2021; Campe et al., 2018) methiozolin 제초작용의 주요 원인일 것으로 생각되었다.